Муравьиная, Уксусная, Пропионовая, Изомасляная, н-масляная, Изовалериановая, Валериановая, Капроновая, Энантовая, Каприловая, Пеларгоновая.
Основу летучих кислот составляет уксусная кислота, которая образуется в винах при спиртовом брожении из сахаров, а также из винной кислоты и глицерина, а при развитии молочнокислых бактерий и из спирта - росте уксусных бактерий.
В сусле содержится 0,02-0,05 г/дм3 уксусной кислоты, винах - 0,2- 1,5 г/дм3. Содержание летучих кислот (в пересчёте на уксусную) в винах молодых (не старше 1 года) должно быть: в белых - не выше 1,2 г/дм3 в красных - не 1,5 г/дм3 в выдержанных и коллекционных винах: белых - более 1,5 г/дм3, красных - не более 1,75 г/дм3. >В больных винах уксусной кислоты накапливается 3-4 г/дм3 и эти больные вина могут быть направлены приготовлёние винного уксуса или переброжены со свежим суслом, в результате чего содержание уксусной кислоты снижается.
72. Значение глицерина для в\д. Его формула, свойства.
Важнейшей составной частью экстракта являются трехатомный спирт глицерин (СН2ОН—СНОН—СН2ОН) и двухатомный спирт 2,3- бутиленгликоль (СН3—СНОН—СНОН—СН3), образующиеся в процессе спиртового брожения как естественные вторичные продукты этого центрального акта виноделия.
Выход глицерина постоянен: от 6 до 12 г на 100 г образующегося этилового спирта. Поэтому, подсчитав ожидаемое количество глицерина и сделав анализ его фактического наличия, можно судить о натуральности происхождения вина. Количество глицерина показывает степень сбраживания сахаров. Так, в столовых винах глицерина в 5—8 раз больше, чем в десертных. Мистель (спиртованное сусло) вообще не содержит глицерина. В сухих винах глицерин находят в количествах 7—8 г/л, что составляет примерно 1/3 приведенного или 1/2 остаточного экстракта. В винах Сотерна и Токая, полученных из ягод, пораженных Botrytis cinerea, глицерина может быть до 30 г/л. 2,3-бутиленгликоль содержится в незначительных количествах: от 0,2 до 0,6 г/л.
Глицерин благоприятно сказывается на вкусе столовых вин, придавая им особую полноту, ощущение приятной сладости и мягкости.
73. Высшие спирты вина, источники их образования.
ВЫСШИЕ СПИРТЫ, сивушные спирты. К ним относятся: пропиловый, бутиловый, амиловый, гексиловый, гептиловый, октиловый, нониловый, лециловый и др. спирты, а также их изомеры.
В винограде содержится 10—30 мг/дм3, в красных винах — 300—600, в белых — 150—400мг/дм3 высшых спиртов. Пороговые концентрации по аромату большинства В.с. (от С4 до С10) находятся в пределах 10—100мг/дм3, выше С10 — 1—5мг/дм3. В винах основное количество высшых спиртов образуется при брожении (около 90°,,). Различают два пути синтеза высшых спиртов дрожжевой клеткой: переамишированием аминокислот и пировиноградной кислоты, возникающими при спиртовом брожении, а также в процессе синтеза некоторых аминокислот живой дрожжевой клеткой. Биосинтез высшых спиртов зависит от физиологически особенности используемого штамма дрожжей, >степени аэрации, азотистого состава и рН среды, температуры брожения; их накопление протекает синхронно накоплению биомассы дрожжей. При выдержке и обработке вин содержание В.с. уменьшается в результате окисления и переэтерификации. Если первая переливка задерживается, то количество В.с. в вине может увеличиться. В.с. токсичны. Они обладают определенным ароматом и являются важной причиной многообразных оттенков в аромате и вкусе напитков. Метод колич. определения суммы В.с. основан на реакции с парадиметиламинобензальдегидом в кислой среде. Для раздельного определения В.с. используют методы газожидкостной хроматографии.
74.. Дать оценку свойствам высших спиртов.
Одноатомные спирты - спирты, у которых имеется одна гидроксильная группа. Бывают первичные, вторичные и третичные спирты:
- у первичных спиртов гидроксильная группа находится у первого атома углерода, у вторичных - у второго, и т.д.

Свойства спиртов, которые являются изомерными, во многом похожи, но в некоторых реакциях они ведут себя по-разному. Сравнивая относительную молекулярную массу спиртов (Mr) c относительными атомными массами углевордородов, можно заметить, что спирты имеют более высокую температуру кипения. Это объясняется наличием водородной связи между атомом H в группе ОН одной молекулы и атомом O в группе ОН другой молекулы. При расторении спирта в воде образуются водородные связи между молекулами спирта и воды. Этим объясняется уменьшение объёма раствора (он всегда будет меньше, чем сумма объёмов воды и спирта по отдельности). Наиболее ярким представителем химических соединений этого класса является этиловый спирт. Его химическая формула C2H5-OH. Концентрированный этиловый спирт (он же - винный спирт или этанол) получают из разбавленных его растворов путём перегонки; действует опьяняюще, а в больших доза - это сильный яд, который разрушает живые ткани печени и клетки мозга.
Свойства спиртов: 1 ) Горение: Как и большинство органических веществ спирты горят с образованием углекислого газа и воды: C2H5-OH + 3O2 -->2CO2 + 3H2O. При их горении выделяется много теплоты, которую часто используют в лабораториях (лабораторные горелки). Низшие спирты горят почти бесцветным пламенем, а у высших спиртов пламя имеет желтоватый цвет из-за неполного сгорания углерода.
2) Реакция со щалочными металлами C2H5-OH + 2Na --> 2C2H5-ONa + H2. При этой реакции выделяется водород и образуется алкоголят натрия. Алкоголяты похожи на соли очень слабой кислоты, а также они легко гидролизуются. Алкоголяты крайне неустойчивы и при действии воды - разлагаются на спирт и щелочь. Отсюда следует вывод, что одноатомные спирты не раегируют со щелочами!
3) Реакция с галогеноводородом C2H5-OH + HBr --> CH3-CH2-Br + H2O. В эитой реакции образуется галогеноалкан (бромэтан и вода). Такая химическая реакция спиртов обусловлена не только атомом водорода в гидроксильной группе, но и всей гидроксильной группой!
4) Внутримолекулярная дегидратация (в присутствии катализатора H2SO4) 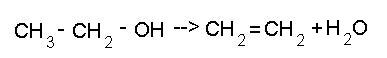 В этой реакции при действии концентрированной серной кислоты и при нагревании происходит дегидратация спиртов. В процессе реакции образуется непредельный углеводород и вода.
В этой реакции при действии концентрированной серной кислоты и при нагревании происходит дегидратация спиртов. В процессе реакции образуется непредельный углеводород и вода.
5) реакция с карбоновыми кислотами:  Если добавить к спирту карбоновую ксилоту, например уксусную, то произойдёт образование простого эфира. Но сложные эфиры менее устойчивы, чем простые эфиры.
Если добавить к спирту карбоновую ксилоту, например уксусную, то произойдёт образование простого эфира. Но сложные эфиры менее устойчивы, чем простые эфиры.
6) Окисление спиртов. Кислородом воздуха при обычной температуре спирты не окисляются, но при нагревании в присутствии катализаторов идёт окисление. Примером может служить оксид меди (CuO), марганцовка (KMnO4), хромовая смесь.
75. Превращения сернистой кислоты в сусле и вине.
Поступивший в сусло или вино сернистый ангидрид образует сернистую кислоту, которая остается неизменной в очень малом количестве: частично она окисляется в серную кислоту, в вине большая часть ее вступает в соединение с альдегидами и дает альдегидосернистую кислоту Установлено, что сернистая кислота вступает в соединение не только с альдегидами, но и с сахарами (альдозами), давая глюкозо сернистую кислоту. В умеренно окуренном вине сернистая кислота находится в форме сернисто альдегидного соединения и только при очень сильном окуривании возникает глюкозо сернистое соединение. Так как последнее очень быстро распадается, то физиологически оно иначе расценивается, чем альдегидосернистая кислота, а связанная сернистая кислота в сусле и сладком вине иначе, чем в сухом вине. Поэтому необходимо избегать сильного окуривания сусел и сладких вин. Наибольшее антисептическое действие оказывает свободная сернистая кислота; связанные (с альдегидами) ее формы оказывают значительно меньшее антисептическое действие. Быстрый переход сернистой кислоты в связанное состояние является причиной почти мгновенного изменения свойств сернистой кислоты, введенной в вино. Благодаря этому переходу сернистая кислота теряет в значительной степени антисептические свойства. Но необходимо указать, что при малейшем нарушении равновесия, например, при окислении свободной сернистой кислоты в серную, некоторая часть альдегидосернистой кислоты расщепляется, давая новое количество свободной сернистой кислоты, чем и восстанавливается нарушенное равновесие. Таким образом, на связанную с альдегидами (в том числе с глюкозой) сернистую кислоту мы можем смотреть как на запас сернистой кислоты, появление которой в свободном состоянии регулируется окислительным процессом и, кроме того, зависит от состава сусла, введенной дозы, техмпературы. Известно также, что после введения сернистого ангидрида в вино количество оставшейся в нем свободной сернистой кислоты и ее антисептическое действие зависит от рН вина. Согласно исследованиям профессора Чилийского университета Рюи Барбоза из общего количества сернистой кислоты в вине при рН 2,8 антисептическим действием обладает 10%, а при рН 3,8— только 1%.
76. Химизм проявления антиоксидантных свойств сернистой кислоты.
Впервые ученые открыли важную роль АЛК в 50-ых годах прошлого века. В 1988 году были обнаружены антиоксидантные свойства АЛК. Альфа-липоевая кислота – это сернистая жирная кислота, которую можно было бы отнести к витаминам, если бы не тот факт, что она может синтезироваться в организме человека. Как липоамид, альфа-липоевая кислота является кофактором выработки энергии. В данной функции ее также называют липоат. АЛК образуется естественным путем в виде соединения, синтезируемого растениями и животными, в том числе человеком. Благодаря данному свойству, альфа-липоевая кислота может выступать в качестве кофактора для ряда важных ферментов. Кроме того, она является эффективным антиоксидантом. Естественным путем синтезируется только R-изомер АЛК. 
Антиоксидантные свойства АЛК настолько велики, что некоторые ученые называют ее «универсальным антиоксидантом». В ходе исследований было установлено, что АЛК функционирует в комплексе с витаминами C и E, увеличивая их эффективность в борьбе со свободными радикалами. Об этом также уже упоминалось выше. Исследования показали, что фактически АЛК может заменять витамин C при его дефиците. Несвязанная АЛК напрямую нейтрализует свободные радикалы как в мембранах, так и в клетках, поскольку данное соединение растворимо и в воде, и в жирах. Способность нейтрализовать свободные радикалы является чрезвычайно важным достоинством альфа-липоивой кислоты. Тем не менее, всю свою мощь АЛК проявляет в сочетании с другими антиоксидантами. АЛК может имитировать другие антиоксиданты, а также повышать их эффективность за счет повторного использования.
77. Объяснить химическую сущность обработки вин ЖКС.
Химические методы обработки. Они предусматривают введение в вино различных химических веществ и соединений (ЖКС, сернистую, сорбиновую, аскорбиновую, метавинную кислоты и др.), вступающих в реакции с компонентами вина и блокирующих их, что делает вина стабильными. Одним из основных приемов такой обработки является деметаллизация вина, проводимая для удаления из вина избытков металлов, приносимых в основном плохо обработанным металлическим оборудованием и емкостями. Деметаллизацию проводят при содержании железа свыше 10—12 мг/л обработкой вина так называемой желтой кровяной солью (ЖКС) —железисто-синеродистым калием K4Fe(CN)6. Это химическое соединение, вступающее в реакцию с тяжелыми металлами, находящимися в вине, реагирует с окисными солями железа, давая темно-синий осадок берлинской лазури и с закисными, образуя светло-синий осадок ферроцианида железа. Обработка ЖКС наряду с деметаллизацией ускоряет созревание вина, снижает его ОВ-потенциал. Вместе с ЖКС применяют желатин, бентонит, полиакриламид. Для удаления тяжелых металлов иногда применяют фитин — тетракальциевую соль инозитфосфорной кислоты. Он получается из пшеничной клейковины. Фитин растворим в вине, и действует путем сорбции, выделяя из вина трехвалентное железо в виде объемистого белого осадка. Дозировка — 5 мг на 1 кг удаляемого железа. Действие проявляется через 3—4 суток. Обработку фитином совмещают с оклейкой белковыми веществами. Проводят обработку с хорошей аэрацией, чтобы перевести двухвалентное железо в трехвалентное. Для деметаллизации ординарных вин разрешено применять трилон Б — двунатриевую соль этилендиаминтетрауксусной кислоты. Трилон Б образует в вине прочные, хорошо растворимые комплексные соединения металлов. Металлы при этом не выводятся, но они блокируются и становятся неспособными к металлокассовым помутнениям. Для обеспечения микробиальной стабильности вин их обрабатывают с помощью двух основных консервантов: сернистой и сорбиновой кислот. Однако при нарушении их дозировок нарушается вкусовая гармония и ухудшается качество вина.
78. Изменения, происходящие в составе сусла и вина при спиртовании.
Бродящее сусло спиртуется для того, чтобы остановить брожение и сделать вино биологически стойким от вторичного брожения. Сусло, концентрированное до 80 г/100 мл сахара, не бродит. Вино же является «прочным» при 18% об. спирта, то есть одна объемная единица спирта по консервирующей способности приравнивается к 4,5 весовым единицам сахара. Если общее количество консервирующих единиц будет не менее 80, то вино является прочным. Нижним пределом содержания спирта в портвейнах является 17% об. при 7 г/100 мл сахара. Вносимый в вино спирт обеспечивает не только прочность против забраживания, болезней, но и существенно влияет на вкус вина. Крепость вина не должна превышать 20% об. Чем выше спиртуозность, тем более экстрактивными должны быть исходные виноматериалы.
При спиртовании бродящего сусла происходит частичное осаждение белковых соединений, а также винного камня и виннокислого кальция. Общее содержание азотистых веществ снижается в среднем с 451—470 до 320—351 мг/л. Осаждаются также пектиновые вещества и камеди. Вместе с этим отмечается снижение титруемой кислотности с 6,1—6,7 до 5,5— 6,0 г/л. После введения спирта вино первое время имеет сырой букет и негармоничный вкус. По истечении некоторого времени (через два, иногда и более месяцев) вино теряет жгучесть и становится более мягким и гармоничным, спирт, как говорят, виноделы, ассимилировался. Механизм ассимиляции спирта пока еще не выяснен. При смешивании спирта с водой ассимиляция происходит быстро и чувствуется образование неприятных тонов в аромате. В то же время после спиртования бродящего сусла вначале ясно улавливаются неприятные запахи, которые затем исчезают. Скорость ассимиляции спирта имеет значение при выпуске ординарных вин в молодом возрасте и при доведении до кондиции выдержанных вин. При производстве некоторых вин сусло спиртуется на мезге. В этом случае также можно применять уравнение Г. Г. Желткевича, но в расчетах из общего объема сусла вычитают 15—18% на мезгу. Кроме того, следует учитывать, что мезга (кожица) впитывает спирт, поэтому его нужно брать примерно на 12% больше, чем при спиртовании сусла без мезги. При спиртовании на мезге надо особенно тщательно перемешивать спирт с мезгой, применяя для этого механические мешалки.




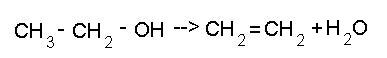 В этой реакции при действии концентрированной серной кислоты и при нагревании происходит дегидратация спиртов. В процессе реакции образуется непредельный углеводород и вода.
В этой реакции при действии концентрированной серной кислоты и при нагревании происходит дегидратация спиртов. В процессе реакции образуется непредельный углеводород и вода. Если добавить к спирту карбоновую ксилоту, например уксусную, то произойдёт образование простого эфира. Но сложные эфиры менее устойчивы, чем простые эфиры.
Если добавить к спирту карбоновую ксилоту, например уксусную, то произойдёт образование простого эфира. Но сложные эфиры менее устойчивы, чем простые эфиры.



