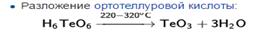Кислород. Строение молекулы кислорода. Получение и химические свойства кислорода. Озон, строение молекулы, получение и применение озона.
Кислород — химически активный неметалл, является самым лёгким элементом из группы халькогенов. Простое вещество кислород при нормальных условиях — газ без цвета, вкуса и запаха, молекула которого состоит из двух атомов кислорода (формула O2). По электроотрицательности кислород уступает только фтору, степень окисления его в большинстве соединений равна –2. Аллотропные формы кислорода - озон — при нормальных условиях газ голубого цвета со специфическим запахом, молекула которого состоит из трёх атомов кислорода (формула O3).
Лабораторные способы получения О2
1.Термическое разложение солей
2 KNO3 = 2 KNO2 + O2
2 KСlO3 = 2 KCl + 3 O2
2 KMnO4 = K2 MnO4 + MnO2 + O2
BaO2 = BaO + ½ O2
Промышленные способы получения О2
1. Сжижение воздуха (tкип(O2)= -183oC), tкип(N2)= - 196oC)
2.Электролизом водных растворов щелочей, который сводится к электролизу H2O
Химические свойства О2
1.Плохо растворим в воде
2. Реагирует с большинством металлов и неметаллов
2Са + О2 = 2СаО
О2 + N2 эл. разряд 2 NO(t ≈ 3000oC)
4P + O2 = 2P2O5
H2S + O2 = SO2 + H2O
2ZnS + 3O2 = 2ZnO + 2SO2
CH4 + O2 = CO2 + H2O
K + O2 = K[O2]- - надпероксид калия
2Na + O2 = Na2O2 - пероксид натрия
Молекула озона О3.
О3 – голубоватый газ с сильным запахом, означает «пахучий»: в сосновых лесах его много, у морского побережья, после грозы. Образуется из О2 под действием УФ излучения и при грозовых разрядах:
3О2 hν 2О3 ∆G = - 323 кДж
ОЗОН
Озон – сильнейший окислитель, окислительная способность обусловлена нестойкостью его молекул, которые при обычной температуре распадаются с образованием атомарного кислорода, который активнее молекулы кислорода О2, на этом и основано окислительное действие его.
O3 ↔ O2 + O ΔH=-142 кДж/моль
Окисляет почти все металлы, действуют на неметаллы, обесцвечивает красители, убивает микробы. При высоких концентрациях – яд.Молекула имеет угловое строение.
Связь трехцентровая (центральный атом О+4 находится в sp2-гибридизации, связи его с двумя крайними атомами кислорода неравноценны, одна двойная, одна одинарная).
Качественная реакция на озон, крахмальная бумага, смоченная раствором KI синеет в присутствии озона в результате выделения I2,озон более сильный окислитель, чем О2 с ним эта реакция не протекает.
Применяется для дезинфекции питьевой воды, при отбеливании тканей и минеральных масел, как реагент в неорганическом и органическом синтезе.
В атмосфере озоновый слой (на высоте около 25 км) защищает живой мир от воздействия ультрафиолетового излучения.
Нахождение бора в природе. Получение бора. Карбораны. Соединения бора с азотом. Борные кислоты и их соли. Применение соединений бора.
Нахождение в природе
Бор принадлежит к числу распространенных элементов: содержание его в земной коре составляет приблизительно 5. 10-4% от общего числа атомов коры. Бор встречается в природе в основном в виде борной кислоты H3BO3 и солей ее полимерных форм: борокальцит СаB4O7. 4H2O, борацит 2Mg3B8O15. МgСl2.и др.
Получение
В промышленности из природных боратов сплавлением с содой получают буру. При обработке природных минералов бора серной кислотой образуется борная кислота. Из борной кислоты H3BO3 прокаливанием получают оксид B2O3, а затем его или буру восстанавливают активными металлами (магнием или натрием) до свободного бора:
B2O3 + 3Mg = 3MgO + 2B,
2Na2B4O7 + 3Na = B + 7NaBO2.
При этом в виде серого порошка образуется аморфный бор. Кристаллический бор высокой чистоты можно получить перекристаллизацией, но в промышленности его чаще получают электролизом расплавленных фтороборатов или термическим разложением паров бромида бора BBr3 на раскаленной до 1000-1500 °C танталовой проволоке в присутствии водорода:
2BBr3 + 3H2 = 2B + 6HBr
Возможно также использование крекинга бороводородов:
В4H10 = 4B + 5H2.
Биологическая роль, применение в медицине и народном хозяйстве бора и его соединений.
Бор наряду с марганцем, медью, молибденом и цинком входит в число пяти важнейших микроэлементов, необходимых растительным и животным организмам. Установлено, что бор влияет на углеводный и белковый обмен.
В медицине применяются борная кислота и бура в качестве антисептиков.
Борные удобрения (осажденные бораты магния) широко используются в сельском хозяйстве.
Чистый бор очень широко используется в атомных реакторах, используется в производстве сплавов на основе черных и цветных металлов для повышения их износостойкости и жаропрочности.
Свойства.
SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. Получают, окисляя оксид серы (IV) кислородом воздуха при нагревании, в присутствии катализатора (V2O5, Pt, NaVO3 или оксид железа(III) Fe2O3):
При взаимодействии с водой образует серную кислоту: SO3 +H2O=H2SO
Взаимодействует с основаниями: 2KOH+ SO3= K2SO4+H2O
и оксидами: CaO+SO3=CaSO4
SO3 характеризуется сильными окислительными свойствами, обычно восстанавливается до диоксида серы:
5SO3+2P=H2O5+5SO2
При взаимодействии с хлороводородом образуется хлорсульфоновая кислота:
SO3+HCl=HSO3Cl
Также взаимодействует с двухлористой серой и хлором, образуя тионилхлорид:
SO3+Cl2+2SCl2=3SOCl
Триоксид селена -бесцветные кристаллы тетрагональная сингонии
Разложение селеновой кислоты: H2SeO4 =P2O5=SeO3+H2O

Триокси́д теллу́ра — неорганическое соединение теллура и кислорода с формулой TeO3
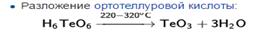

Общая характеристика галогенов: нахождение в природе, способы получения, физические и химические свойства. Галогеноводороды и галогениды металлов. Кислородсодержащие кислоты галогенов и их соли.
Галогены (от греч. halos - соль и genes - образующий) - элементы главной подгруппы VII группы периодической системы: фтор, хлор, бром, йод, астат.
1) Общая электронная конфигурация внешнего энергетического уровня - nS2nP5.
2) С возрастанием порядкового номера элементов увеличиваются радиусы атомов, уменьшается электроотрицательность, ослабевают неметаллические свойства (увеличиваются металлические свойства); галогены - сильные окислители, окислительная способность элементов уменьшается с увеличением атомной массы.
3) Молекулы галогенов состоят из двух атомов - F2, Cl2, Br2, I2.
4) С увеличением атомной массы окраска становится более темной, возрастают температуры плавления и кипения, а также плотность.
5) Сила галогеноводородных кислот возрастает с увеличением атомной массы.
6) Галогены могут образовывать соединения друг с другом (например, BrCl)
Физические свойства галогенов существенно различаются: так, при нормальных условиях
F2 – зеленовато – жёлтый, трудно сжижаемый газ с резким запахом. Фтор крайне токсичен, при попадании а организм человека вызывает отёк лёгких, разрушение зубов, ногтей, ломкость кровеносных сосудов, повышает хрупкость костей.
Cl2 – также газ желто – зеленого цвета, но сжижается легко;
Br2 – красно- коричневая густая жидкость со зловонным запахом, ядовит (единственный жидкий при обычных условиях неметалл).
I2 – фиолетовые кристаллы. Для человека смертельная доза 2-3 г йода, но в форме иодид - ионов безвреден.
Нахождение в природе
F CaF2 - плавиковый шпат
Na3[AlF6] – криолит
Ca+25(PO4)-33F - фтораппатит
Cl NaCl - поваренная (каменная соль)
KCl∙NaCl- сильвинит
KCl∙MgCl2∙6H2O- карналит
Br в нефтяных скважинах
I в морской воде
Способы получения
F2 - только электролизом расплавов солей (в смеси с HF) KF∙HF
Электроды из Ni, либо сплавов Ni с Fe, Mn, Cu, т. к. F2 очень активен и реагирует почти со всеми элементами. Ni устойчив в атмосфере фтора за счёт образования плёнки NiF2. Поэтому F2 хранят в баллонах, выполненных на основе сплавов никеля.
CoF3 = CoF2 + ½F2
в лаборатории разложением фторидов.
Сl2 - в лаборатории действием сильных окислителей на соляную кислоту
2KMnO4 + 16HCl → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
(при обычной температуре)
MnO2 + 4HCl → Cl2 + MnCl2 + 2H2O
2AuCl3 → 2Au + 3Cl2
Промышленный способ – электролиз водных растворов поваренной соли NaCl
электролиз
2NaCl + 2H2O → H2 + Cl2 + 2NaOH
K (-) 2H2O + 2ē = H2 + 2ОH-
А (+) 2Cl- - 2ē = Cl2
Br2 и I2 получаются реакциями замещения
2KBr + Cl2 → 2KCl + Br2
NaЭ + MnO2 + H2SO4 → Э2 +MnSO4 + Na2SO4 + H2O (Э=Br2,I2)
NaI + NaNO3 + H2SO4 → I2 + NO2 + Na2SO4
Химические свойства галогенов
Фтор реагирует со взрывом со всеми металлами и неметаллами, кроме O2, N2, Гal2 при этом во всех соединениях с фтором элементы имеет высшую степень окисления.
Например:
SiO2 + 2F2 = Si+4F4 + O2 (во фторе горит SiO2, H2O)
t = 0º – 90º Н2O + F2 = Н+F + O+2F2 (H2O + F2=HF + O2 (O3)
2 Au + 3F2 = 2AuF3
5P + 5F2 = 2PF5
2NH3 + 3F2 = 6HF + N2
F2 + NaOHP → NaF + OF2 + H2O
2F2 + 4NaOHК → 4NaF + O2 + 2H2O
В ряду Cl2, Br2, I2 окислительная активность падает, а восстановительная активность увеличивается, поэтому, если протекает реакция, хлор выступает в роли окислителя.
Cl2 + I2 + H2O→HCl + HIO3
ок. восст
1) Галогены реагируют с неметаллами, образовывая галогениды:
2) С металлами, которые приобретают высшую степень окисления:
2Fe + 3Cl2 → 2FeCl3
3) реагируют с H2, только Br2 и Cl2
4)Cl2 и Br2 реагируют с H2O образуя хлорную и бромную воду, а с I2 реакция практически не протекает
Гal2 + H2O→HГal + HГalO
5) Сl взаимодействует с растворами щёлочей, продукты зависят от температуры
Cl2 +NaOH → NaCl + NaClO + H2O - на холоду
Гипохлорит натрия
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 2H2O – при нагревании
(Хлорат натрия)
с I2 один продукт, NaIO3, а NaIO – не образуется.
I2 + NaOH → NaI + NaIO3 + H2O
Галогенводороды и галогениды
HF H2 + F2 – не получается из-за высокой Q
1)СaF2 + H2SO4 → CaSO4↓ + 2HF↑
2)KHF2 → KF + HF
HCl
1) H2 + Cl2 → 2HCl
2) NaClк + H2SO4 конц. → NaHSO4 + HCl↑
3) BCl3 + H2O → H3BO3 + HCl↑
HI, HBr
HBr и HI получают гидролизом галогенидов фосфора.
PBr3 + H2O → HBr↑+ H3PO3-
PI3 + 3H2O → H3PO3 + 3HI
Галогениды К галогенидным минералам относятся фтористые, хлористые и очень редкие бромистые и иодистые соединения. Фтористые соединения (фториды), генетически связаны с магматической деятельностью, они являются возгонами вулканов или продуктами гидротермальных процессов, иногда имеют осадочное происхождение. Типичные минералы класса фторидов — виллиомит NaF, флюорит CaF2, криолит Na3AlF6; класса хлоридов — галит NaCl, сильвин КCl, карналлит KMgCl3·6(H2O). Сырьё в пищевой, химической, металлургической промышленности[1].
Кислородсодержащие кислоты галогенов и их соли
KClO → KCl + O2 - Гипохлорит калия
KClO → KCl + KClO2
(KClO3)
(KClO4)
Cl2 + Ca(OH)2 → CaOCl2 + H2O -очень сильный окислитель даже на воздухе разлагается (белильная известь)
Cl2O7 - маслянистая бесцветная жидкость, получается обезвоживанием HСlO4
2HСlO4 + P2O5 → Cl2O7 + 2HPO3