

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Оснащения врачебно-сестринской бригады.
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
В отличие от диаграммы с устойчивым химическим соединением, диаграмма состояния, где два компонента образуют неустойчивое химическое соединение, которое при нагреве до определенной температуры разлагается на жидкость и один из компонентов, т.е. не расплавляется полностью. На линии DCF находятся в равновесии три фазы: жидкость концентрации D, кристаллы компонента В и кристаллы химического соединения AnBm.
При нагреве неустойчивое химическое соединение AnBm распадается на жидкость концентрации D и кристаллы В. При охлаждении, произойдет обратная реакция: LD+B→ AnBm.
Реакция эта подобна перитектической; жидкость реагирует с ранее выпавшими кристаллами, но образует не новый твердый раствор, как в случае перитектической реакции, а химическое соединение.
Процесс кристаллизации Ι в равновесных условиях будет протекать следующим образом. В точке 1 начинается кристаллизация, выпадают кристаллы В, и концентрация жидкости изменяется по кривой 1 – D. В точке 2 при постоянной температуре образуется неустойчивое химическое соединение.
По окончании реакции в избытке остается жидкость, которая кристаллизуется с выделением соединения AnBm до тех пор, пока концентрация жидкости не достигает точки Е. Тогда оставшаяся жидкость кристаллизуется в эвтектику, состоящую из кристаллов А и химического соединения. Следовательно, на кривой будет иметь две площадки: верхнюю, соответствующую образованию неустойчивого химического соединения, и нижнюю, соответствующую образованию эвтектики А+ AnBm.
2.Диаграмма состояния железоуглеродистых сплавов.
Основы диаграммы Fe – C были созданы Д.К.Черновым, который в 1868 г. впервые установил существование критических точек железа и зависимости температуры этих точек от содержания углерода в сплаве. В последующие годы Ф.Осмонду удалось измерить эти температуры, и с использованием разработанной Д.Гиббсом теории фазовых равновесий Р. Аустен в 1899 г. построил первую диаграмму состояния Fe – C. Несколько позже более полный, близкий к современному вид диаграммы представил Г.Розенбум, после чего продолжались ее исследования, вносились поправки и уточнения.
|
|
Углерод относится к неметаллам. Обладает полиморфным превращением, в зависимости от условий образования существует в форме графита с гексагональной кристаллической решеткой (температура плавления – 3500 0 С, плотность – 2,5 г/см3) или в форме алмаза со сложной кубической решеткой с координационным числом равным четырем (температура плавления – 5000 0 С).
В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения – цементита (Fe3C), а также в свободном состоянии в виде графита (в серых чугунах).
Углерод в сплавах после охлаждения находится в составе феррита и цементита. Так как феррит содержит ничтожно мало углерода, то с увеличением концентрации углерода в сплавах прямо пропорционально возрастает количество цементита: при 0,8%С его доля составляет 12%, при 2,0%С доля цементита равна 30%, а при 4%С количество цементита достигает 60%. Поскольку цементит является твердой и хрупкой фазой, то с ростом концентрации углерода у сталей и белых чугунов увеличиваются твердость, пределы прочности и текучести, электросопротивление, уменьшаются плотность, пластичность, ударная вязкость, теплопроводность и магнитная проницаемость.
Железо – переходный металл серебристо-светлого цвета. Имеет высокую температуру плавления – 1539o С  5o С.
5o С.
В твердом состоянии железо может находиться в двух модификациях. Полиморфные превращения происходят при температурах 911o С и 1392o С. При температуре ниже 911o С существует  с объемно-центрированной кубической решеткой. В интервале температур 911…1392o С устойчивым является
с объемно-центрированной кубической решеткой. В интервале температур 911…1392o С устойчивым является  с гранецентрированной кубической решеткой. Выше 1392o С железо имеет объемно-центрированную кубическую решетку и называется
с гранецентрированной кубической решеткой. Выше 1392o С железо имеет объемно-центрированную кубическую решетку и называется  или высокотемпературное
или высокотемпературное  . Высокотемпературная модификация
. Высокотемпературная модификация  не представляет собой новой аллотропической формы. Критическую температуру 911oС превращения
не представляет собой новой аллотропической формы. Критическую температуру 911oС превращения  обозначают точкой
обозначают точкой  , а температуру 1392o С превращения
, а температуру 1392o С превращения  - точкой А4.
- точкой А4.
|
|
При температуре ниже 768o С железо ферромагнитно (Иными словами, ферромагнетик — такое вещество, которое (при температуре ниже точки Кюри) способно обладать намагниченностью в отсутствие внешнего магнитного поля), а выше – парамагнитно. Точка Кюри железа 768o С обозначается А2.
Железо технической чистоты обладает невысокой твердостью (80 НВ) и прочностью (предел прочности –  , предел текучести –
, предел текучести – 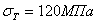 ) и высокими характеристиками пластичности (относительное удлинение –
) и высокими характеристиками пластичности (относительное удлинение –  , а относительное сужение –
, а относительное сужение – 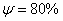 ). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна.
). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна.
Железо характеризуется высоким модулем упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая высокую жесткость деталей из этих сплавов.
Железо со многими элементами образует растворы: с металлами – растворы замещения, с углеродом, азотом и водородом – растворы внедрения.
Процессы при структурообразовании железоуглеродистых сплавов
Линия АВСD – ликвидус системы. На участке АВ начинается кристаллизация феррита (δ), на участке ВС начинается кристаллизация аустенита, на участке СD – кристаллизация цементита первичного.
Линия AHJECF – линия солидус. На участке АН заканчивается кристаллизация феррита (δ). На линии HJB при постоянной температуре 14990С идет перетектическое превращение, заключающееся в том, что жидкая фаза реагирует с ранее образовавшимися кристаллами феррита (δ), в результате чего образуется аустенит:
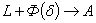
На участке JЕ заканчивается кристаллизация аустенита. На участке ECF при постоянной температуре 1147o С идет эвтектическое превращение, заключающееся в том, что жидкость, содержащая 4,3 % углерода превращается в эвтектическую смесь аустенита и цементита первичного:
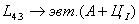
Эвтектика системы железо – цементит называется ледебуритом (Л), по имени немецкого ученого Ледебура, содержит 4,3 % углерода.
|
|
При температуре ниже 727o С в состав ледебурита входят цементит первичный и перлит, его называют ледебурит превращенный (ЛП).
По линии HN начинается превращение феррита (δ) в аустенит, обусловленное полиморфным превращением железа. По линии NJ превращение феррита (δ) в аустенит заканчивается.
По линии GS превращение аустенита в феррит, обусловленное полиморфным превращением железа. По линии PG превращение аустенита в феррит заканчивается.
По линии ES начинается выделение цементита вторичного из аустенита, обусловленное снижением растворимости углерода в аустените при понижении температуры.
По линии МО при постоянной температуре 768o С имеют место магнитные превращения.
По линии PSK при постоянной температуре 727o С идет эвтектоидное превращение, заключающееся в том, что аустенит, содержащий 0,8 % углерода, превращается в эвтектоидную смесь феррита и цементита вторичного:

По механизму данное превращение похоже на эвтектическое, но протекает в твердом состоянии.
Эвтектоид системы железо – цементит называется перлитом (П), содержит 0,8 % углерода.
Название получил за то, что на полированном и протравленном шлифе наблюдается перламутровый блеск.
Перлит может существовать в зернистой и пластинчатой форме, в зависимости от условий образования.
По линии PQ начинается выделение цементита третичного из феррита, обусловленное снижением растворимости углерода в феррите при понижении температуры.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо – цементит, т.е. критические точки, имеют условные обозначения.
Обозначаются буквой А (от французского arret – остановка):
А1 – линия PSK (7270С) – превращение П А;
A2 – линия MO (7680С, т. Кюри) – магнитные превращения;
A3 – линия GOS (переменная температура, зависящая от содержания углерода в сплаве) – превращение Ф А;
A4 – линия NJ (переменная температура, зависящая от содержания углерода в сплаве) – превращение;
Acm – линия SE (переменная температура, зависящая от содержания углерода в сплаве) – начало выделения цементита вторичного (иногда обозначается A3).
Так как при нагреве и охлаждении превращения совершаются при различных температурах, чтобы отличить эти процессы вводятся дополнительные обозначения. При нагреве добавляют букву с, т.е  , при охлаждении – букву r, т.е.
, при охлаждении – букву r, т.е.  .
.
|
|
Жидкая фаза (Ж) представляет неограниченный раствор железа и углерода с равномерным распределением их атомов при наличии металлической связи между ними за счет валентных электронов.
Ферритом называется твердый раствор внедрения углерода в α- железо. Феррит имеет переменную предельную растворимость углерода: минимальную – 0,006 % при комнатной температуре (точка Q), максимальную – 0,02 % при температуре 727o С (точка P). Углерод располагается в дефектах решетки. При температуре выше 1392o С существует высокотемпературный феррит ( ) (
) ( (C), с предельной растворимостью углерода 0,1 % при температуре 1499o С (точка J)
(C), с предельной растворимостью углерода 0,1 % при температуре 1499o С (точка J)
Благодаря столь малому содержанию углерода свойства феррита совпадают со свойствами железа (низкая твердость и высокая пластичность).Он мягок (твердость – 130 НВ, предел прочности –  ) и пластичен (относительное удлинение –
) и пластичен (относительное удлинение –  ), магнитен до 768o С.
), магнитен до 768o С.
Твердый раствор углерода в высокотемпературной модификации Feα (т. е. в Feδ) часто называют δ- ферритом или высокотемпературным ферритом.
Аустенитом (А) называют твердый раствор внедрения углерода в Feg c решеткой ГЦК и размещением атома углерода в центре объема элементарной ячейки. Максимальная растворимость углерода в Feg составляет 2,14% при температуре 1147оС, что значительно превышает предельное содержание углерода в феррите. Это объясняется тем, что межатомное пространство, необходимое для наиболее благоприятных условий внедрения атома углерода, в решетке ГЦК представляет центр ячейки с размерами намного больше, чем центр грани в решетке ОЦК.
Аустенит имеет переменную предельную растворимость углерода: минимальную – 0,8 % при температуре 727o С (точка S), максимальную – 2,14 % при температуре 1147o С (точка Е).
Аустенит имеет твердость 200-250 НВ, пластичен (относительное удлинение –  ), парамагнитен.
), парамагнитен.
При растворении в аустените других элементов могут изменяться свойства и температурные границы существования.
Цементит (Ц) является карбидом железа Fe3C со сложной плотноупакованной ромбической решеткой. Он содержит 6,67 % С и обладает метастабильностью (неустойчивостью) так, что при нагреве еще до температуры плавления 1260оС начинается его распад с образованием стабильных фаз железа и углерода. Межатомные связи в решетке цементита имеют металлический и ковалентный характер, и это придает ему типичные для промежуточной фазы высокую твердость 10000 НВ и отсутствие пластичности. До температуры 210оС цементит проявляет слабые ферромагнитные свойства, при более высоких температурах он переходит в парамагнитное состояние.
|
|
В зависимости от условий кристаллизации и последующей обработки цементит может иметь различную форму — равноосных зёрен, сетки по границам зёрен, пластин, а также видманштеттову структуру (Видманштетова структура — разновидность металлографической структуры сплавов в металловедении и метеоритике, отличающаяся геометрически правильным расположением элементов структуры в виде пластин, полигонов или игл внутри составляющих сплав кристаллических зёрен).
Цементит — представитель так называемых фаз внедрения, соединений переходных металлов с легкими металлоидами. В фазах внедрения велики доля как ковалентной, так и металлической связи.
Первичный цементит кристаллизуется из жидкого сплава
Вторичный цементит - из аустенита
Третичный цементит - из феррита
3. МИКРОСТРУКТУРА СПЛАВОВ.
-Многие считают, что для оценки свойств сплавов достаточно знать их химический состав. Но это не совсем так.
-Например, многие сплавы после термообработки становятся намного прочнее, хотя химсостав при этом не меняется. И, наоборот, небольшое изменение химического состава сплава может вызвать большое изменение его механических или технологических свойств.
-На самом деле важно знать, каким образом составляющие компоненты присутствуют в сплаве, а для этого надо знать его фазовый состав. Можно считать, что химический состав определяет возможные свойства, а фактические свойства определяются фазовым составом.
-Для введения понятия Микроструктура, обратимся к фазовому составу.
|
|
|

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!