

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Интересное:
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Исходным уравнением для расчета константы равновесия при разных температурах является изобара Вант-Гоффа:
d lnKp = Δ r H°
dT RT²
Проинтегрируем уравнение Вант-Гоффа с учетом зависимости теплового эффекта реакции от температуры в виде степенного ряда:
lnKp = lnKj +∫(ΔHj + ΔraT + ΔrbT²/2 + ΔrcT³/3- Δrc`T-1)dT/RT²
lnKp = lnKj+15561,0431*T-1+3,95092435*lnT-0,00299717*Т+3,999*10-7*Т2+3006,79174*Т-2,
где Т=298,15.
Полученное уравнение содержит lnKj – константу интегрирования, рассчитаем ее, используя для этого значение lnKp,298.
Получим значение константы интегрирования, равное lnKj =-10,2569763
Теперь имеем окончательный вид уравнения для расчета константы равновесия при различных температурах:
lnKp =-10,2569763+15561,0431*T-1+3,95092435*lnT-0,00299717*Т+3,999*10-7*Т2+3006,79174*Т-2
10. Расчет численных значений ln 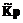 (T i)
(T i)
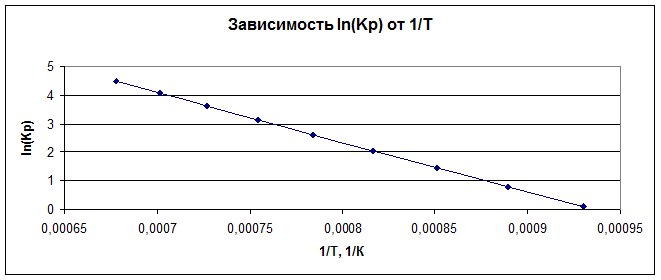
Вычислим значения lnKp и Kp в заданном интервале температур и построим график в координатах lnKp от 1/Т. Полученный график используем для обсуждения влияния температуры на смещение равновесия в рассматриваемой реакции.
| T,K | 1/T, 1/K | Ln(Kp) |
| 1075 | 0,00093 | 0,088169 |
| 1125 | 0,000889 | 0,80504 |
| 1175 | 0,000851 | 1,461379 |
| 1225 | 0,000816 | 2,064529 |
| 1275 | 0,000784 | 2,620715 |
| 1325 | 0,000755 | 3,13524 |
| 1375 | 0,000727 | 3,612655 |
| 1425 | 0,000702 | 4,056885 |
| 1475 | 0,000678 | 4,471336 |
Расчет изменения стандартной энергии Гиббса и стандартной энтропии реакции
Рассчитаем значения ΔrG°т (Дж/моль) и ΔrS°т (Дж/моль·К) в том же интервале температур.
| T,K | ΔrG°т, Дж/моль | ΔrS°т, Дж/моль·К |
| 1075 | -788,01485 | 134,7914 |
| 1125 | -7529,7404 | 134,8916 |
| 1175 | -14276,138 | 134,9766 |
| 1225 | -21026,505 | 135,0517 |
| 1275 | -27780,496 | 135,1217 |
| 1325 | -34537,961 | 135,1909 |
| 1375 | -41298,969 | 135,2632 |
| 1425 | -48063,742 | 135,3417 |
| 1475 | -54832,664 | 135,4295 |
Можно сделать вывод, что при увеличении температуры стандартная энергия Гиббса и энтропия увеличиваются.
|
|
Расчет парциальных давлений компонентов при заданном начальном составе смеси
По заданным начальным значениям количества вещества (моль): n1, n2, n3 и n4. и общему давлению р´общ. рассчитаем начальные парциальные давления участвующих в реакции газов: р´i =p´общ. × (ni/Σni).
Σni = 1
робщ. = 1 атм.
p´(С3Н8)= 1×(0,8/1) = 0,8 атм.
p´(СН4) = 1×(0,1/1) = 0,1 атм.
p´(С2Н4)= 1×(0,1/1) = 0,1 атм.
Далее, используя значения мольных долей компонентов, рассчитываем парциальные давления p´´i участников реакции при измененном в М раз
общем давлении: p´´общ. = Мp´общ.=10×1=10
p´´(С4Н10)= 10×0,8 = 8 атм.
p´´(С2Н4) = 10×0,1 = 1 атм.
p´´(С6Н14)= 10×0,1 = 1 атм.
Таблица № 3
| Вещество | n нач, моль | P’ общ, атм | p’i, атм | P” общ = МРобщ, атм | p”i, атм |
| С3Н8 | 0,8 | 1 | 0,8 | 10 | 8 |
| СН4 | 0,1 | 1 | 0,1 | 10 | 1 |
| С2Н4 | 0,1 | 1 | 0,1 | 10 | 1 |
Определение направления процесса при заданных условиях
Энергия Гиббса – одна из важнейших термодинамических функций и чаще других используется для определения направления процесса при заданных условиях (при Т=const, p=const и данном соотношении компонентов). Расчет ΔGт проводится по уравнению изотермы химической реакции. Одна из форм записи этого уравнения для нашей реакции имеет вид:
ΔrG´ = RTраб. ln(æp/Kp,T),
где æp=pпр./pреаг.= pСН4*pС2Н4 / pС3Н8=0,1*0,1/0,8=0,0125
=> ΔG´600 = -RTlnKp,600 + RTln(æp) = -8,314*60* 1,058941 + 8,314*600*ln(0,0125)
ΔG´600 = -22387,5 Дж/моль
Энергия Гиббса является критерием самопроизвольного протекания процесса. Полученное изменение энергии Гиббса меньше нуля, при Т=600 К реакция протекает самопроизвольно, равновесие смещается в сторону образования продуктов.
Определение влияния давления на смещение равновесия
Для определения влияния давления на смещение равновесия рассчитаем
ΔrG´´600 при р´´общ.= 10 атм., Т=600К и том же самом соотношении компонентов.
|
|
æ p ´´ = 125,2/150*125,2 = 0,006666666
Δ G ''600 = -8,314*650*0,357254489+ 8,314*650*ln(0,006666666)=
- 29108,43209 Дж/моль
Сравнив полученные значения ΔrG´650 и ΔrG´´650, видим, что увеличение давления приводит к уменьшению энергии Гиббса и, следовательно, к смещению равновесия в сторону продуктов (по принципу Ле-Шателье увеличение давления приводит к смещению равновесия в сторону реакции, приводящей к меньшему количеству вещества газов (в нашем случае в сторону С6Н14)).
|
|
|

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!