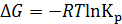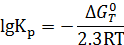Термодинамический анализ.
Образование формальдегида осуществляется в результате протекания параллельных реакций простого и окислительного дегидрирования метанола:
СН3 ОН → СН2 О + Н2 – 85,3 кДж/моль (1)
СН3 ОН + 1/2 О2 → СН2 О + Н2 О + 156,5 кДж/моль (2)
Наряду с этими реакциями в системе протекают побочные превращения.
СН3 ОН + 2/3 О2 → СО2 +H2O+ 575,1 кДж/моль (3)
СН2 О + 1/2 О2 → НСООН + 260,8 кДж/моль (4)
СН2 О → СО + Н2 + 5,4 кДж/моль (5)
2 СН2 О + Н2 О → СН3 ОН + НСООН + 60,3 кДж/моль (6)
Н2+ 1/2 О2 → Н2 О + 285,8 кДж/моль (7)
При соотношении реакций (1) и (2) равным 0,45:0,55 тепловой эффект процесса достаточен для возмещения потерь тепла системы в окружающую среду и для нагревания исходных продуктов до нужной температуры. Если это отношение соблюдается, а в исходной паровоздушной смеси содержится около 45% об. метанола процесс можно проводить в реакторах адиабатического типа, не имеющих поверхностей теплообмена.
Для расчета энергии Гиббса воспользуемся энтропийным методом:
Таблица 4.1
Термодинамические константы участников реакции.
| термодинамическая величина
| Вещество
|
| CH3OH(г)
| CH2O(г)
| HCOOH(г)
| H2O(г)
| CO(г)
| CO2(г)
| O2(г)
| H2(г)
|
|  , кДж/моль , кДж/моль
| -201,2
| -115,9
| -376,7
| -285,8
| -110,5
| -393,5
| 0,0
| 0,0
|
| 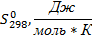
| 239,7
| 218,8
| 251,6
| 70,0
| 197,4
| 213,6
| 205,0
| 130,6
|
Расчет 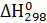 и
и 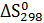 проводим по формуле:
проводим по формуле:

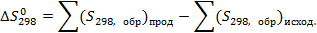
Реакция 1

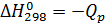 ,
, 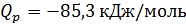
Реакция 1 идет с поглощением большого количества тепла, она
эндотермична. Для смещения равновесия вправо необходимо поддерживать
более высокую температуру в процессе дегидрировании метанола.
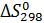 =218,8+130,6-239,7=109,7 Дж/моль*К
=218,8+130,6-239,7=109,7 Дж/моль*К
 следовательно, процесс конверсии можно осуществить при атмосферном давлении.
следовательно, процесс конверсии можно осуществить при атмосферном давлении.
Определим температуру начала реакции:
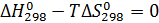
Т=  =
= 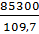 =777,85˚К=504,58˚С
=777,85˚К=504,58˚С 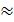 505˚С
505˚С
С учетом этой температуры расчета энергии Гиббса принимаем 700 - 1100˚К.
Аналогичные расчетные значения 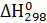 и
и 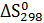 для выше приведенных реакций (1-7) представлены в таблице 4.2.
для выше приведенных реакций (1-7) представлены в таблице 4.2.
Таблица 4.2
Термодинамические величины реакций окисления метанола
| термодинамическая величина
| Номер реакции
|
| 1
| 2
| 3
| 4
| 5
| 6
| 7
|
| 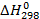 , кДж/моль , кДж/моль
| 85,3
| -156,5
| -434,2
| -175,5
| 5,4
| -104,3
| -241,84
|
| 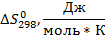
| 109,7
| 65,3
| 26,0
| -90,6
| 109,2
| -135,0
| -44,375
|
Ниже приводится расчет  для реакции 1 при различных температурах с использованием энтропийного метода.
для реакции 1 при различных температурах с использованием энтропийного метода.
 8510 Дж/моль
8510 Дж/моль
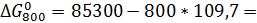 -2460 Дж/моль
-2460 Дж/моль
 -13430 Дж/моль
-13430 Дж/моль
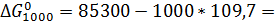 -24400 Дж/моль
-24400 Дж/моль
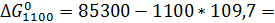 -35370 Дж/моль
-35370 Дж/моль
Аналогично были рассчитаны значения  для реакций 1-8
для реакций 1-8
Результаты представлены в таблице 3, а также отображены на рис. 1 в
координатах 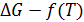
Таблица 4.3
Значения энергии Гиббса в зависимости от температуры
| t, ˚C
| T, ˚K
| № реакции и  , кДж /моль , кДж /моль
|
| 1
| 2
| 3
| 4
| 5
| 6
| 7
|
| 427
| 700
| 8510
| -202268
| -452317
| -112070
| -71040
| -9732
| -210778
|
| 527
| 800
| -2460
| -208800
| -454913
| -103008
| -81960
| 3772
| -206340
|
| 627
| 900
| -13430
| -215333
| -457508
| -93946,5
| -92880
| 17276
| -201903
|
| 727
| 1000
| -24400
| -221865
| -460103
| -84885
| -103800
| 30780
| -197465
|
| 827
| 1100
| -35370
| -228398
| -462699
| -75823,5
| -114720
| 44284
| -193028
|
Зависимость энергии Гиббса от температуры
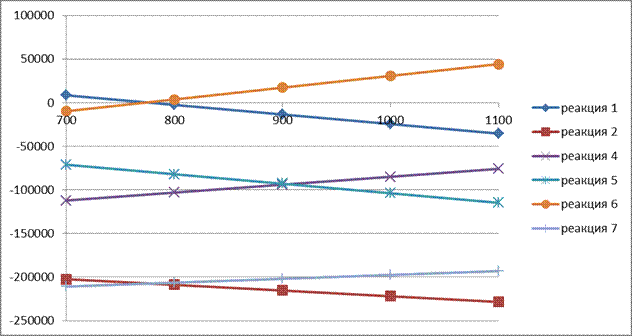
Рис. 4.1 - График зависимости энергии Гиббса от температуры
Учитывая приведенные в таблице 3 результаты, можно утверждать, что реакции 1 и 2 вероятны и полученные значения энергии Гиббса свидетельствуют о том, что термодинамическая вероятность основной реакции с увеличением температуры увеличивается.
Константа равновесия реакции 1 выражается уравнением:
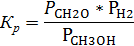
где:  ,
, 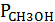 равновесные парциальные давления формальдегида, водорода и метанола соответственно.
равновесные парциальные давления формальдегида, водорода и метанола соответственно.
Зависимость константы равновесия от температуры может быть представлена в виде уравнения:
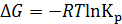
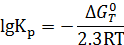

Значения констант равновесия в указанном интервале температур представлены в табл. 4.4 и на рис. 4.2
Таблица 4.4



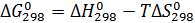
 , кДж/моль
, кДж/моль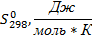
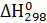 и
и 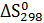 проводим по формуле:
проводим по формуле:
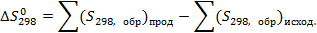

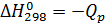 ,
, 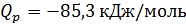
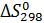 =218,8+130,6-239,7=109,7 Дж/моль*К
=218,8+130,6-239,7=109,7 Дж/моль*К следовательно, процесс конверсии можно осуществить при атмосферном давлении.
следовательно, процесс конверсии можно осуществить при атмосферном давлении.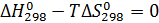
 =
= 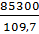 =777,85˚К=504,58˚С
=777,85˚К=504,58˚С 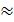 505˚С
505˚С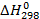 , кДж/моль
, кДж/моль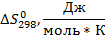
 для реакции 1 при различных температурах с использованием энтропийного метода.
для реакции 1 при различных температурах с использованием энтропийного метода. 8510 Дж/моль
8510 Дж/моль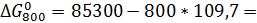 -2460 Дж/моль
-2460 Дж/моль -13430 Дж/моль
-13430 Дж/моль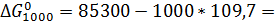 -24400 Дж/моль
-24400 Дж/моль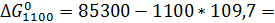 -35370 Дж/моль
-35370 Дж/моль для реакций 1-8
для реакций 1-8
 , кДж /моль
, кДж /моль
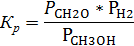
 ,
, 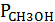 равновесные парциальные давления формальдегида, водорода и метанола соответственно.
равновесные парциальные давления формальдегида, водорода и метанола соответственно.