

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Реннин имеет значение для переваривания молочного белка казеина. Отщепление
гликопептида от казеина превращает последний в параказеин, который связывает ионы кальция, створаживается и образует нерастворимую соль. Благодаря этому молочный белок задерживается в желудке и подвергается частичному перевариванию гастриксином. У взрослых функцию реннина берет на себя соляная кислота, денатурирующая казеин.
69. Гниение белков в толстом кишечнике. Образование, всасывание в кровь и
обезвреживание в печени токсичных продуктов гниения: фенол, скатол, индол, путресцин, кадаверин и др.
При ухудшении всасывания аминокислот, при избытке белковой пищи, при нарушении деятельности пищеварительных желез недопереваренные фрагменты белков достигают толстого кишечника, где подвергаются воздействию кишечной микрофлоры. Этот процесс получил название гниение белков в кишечнике. При этом образуются продукты разложения аминокислот, представляющие собой как токсины (кадаверин, путресцин, крезол, фенол, скатол, индол, пиперидин, пирролидин, сероводород (H2S), метилмеркаптан (СН3SН)), так и нейромедиаторы (серотонин, гистамин, октопамин, тирамин).
Гниение белков также активируется при снижении перистальтики кишечника (запоры). 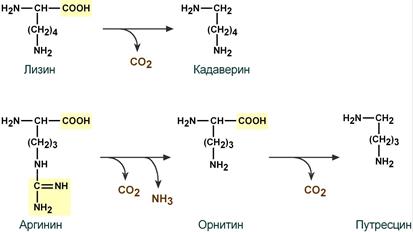
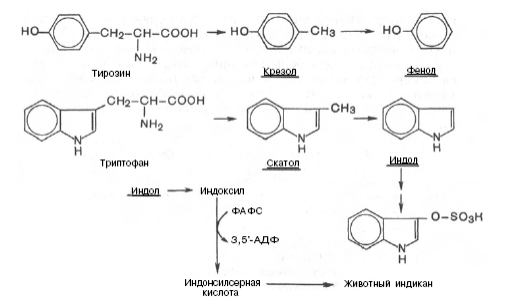
После всасывания эти продукты через воротную вену попадают в печень, где подвергаются обезвреживанию путем химического связыванияс серной или глюкуроновой кислотой с образованием нетоксичных, та кназываемых парных, кислот (например, фенолсерная кислота или скатоксилсерная кислота). Последние выделяются с мочой. Механизм обезвреживания этих продуктов изучен детально. В печени содержатся специфические ферменты – арилсульфотрансфераза и УДФ-глюкоронилтрансфераза, катализирующие соответственно перенос остатка серной кислоты из ее связанной формы – 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) и остатка глюкуроновой кислоты также из ее связанной формы – уридилдифосфоглюкуроновой кислоты (УДФГК) на любой из указанных продуктов.

70. Понятие о внутриклеточном метаболическом пуле аминокислот.Трансаминирование аминокислот. Структура кофермента и механизм переаминирования. Специфичность трансаминаз. Значение реакций трансаминирования. Диагностическое значение определения в сыворотке крови АлАТ и АсАТ.

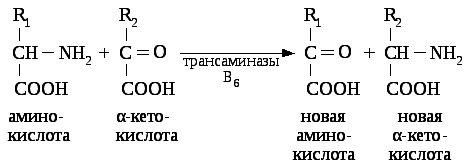
Переаминирование аминокислот – процесс обратимого переноса аминогруппы с любой аминокислоты на α - кетокислоту без промежуточного выделения аммиака.
При этом образуются новые амино- и кетокислота. Следовательно, процессы переаминирования являются одним из важнейших путей образования заменимых аминокислот.
Катализируют реакцию ферменты аминотрансферазы, Они являются сложными ферментами, в качестве кофермента они имеют пиридоксальфосфат (активная форма витамина В6).
Весь перенос аминогруппы совершается в две стадии. К пиридоксальфосфату сначала присоединяется первая аминокислота, отдает аминогруппу, превращается в кетокислоту и отделяется. Аминогруппа при этом переходит на кофермент и образуется пиридоксаминфосфат. После этого на второй стадии присоединяется другая кетокислота, забирает аминогруппу, превращаясь в новую аминокислоту, пиридоксальфосфат регенерирует.
|
|
Роль и превращение пиридоксальфосфата сводится к образованию промежуточных соединений – шиффовых оснований (альдимин и кетимин). В первой реакции после отщепления воды образуется иминовая связь между остатком аминокислоты 1 и пиридоксальфосфатом. Полученное соединение называется альдимин. Перемещение двойной связи приводит к образованию кетимина, который гидролизуется водой по месту двойной связи. От фермента отщепляется готовый продукт – кетокислота 1. 
Наиболее широко распространенными из них являются две трансаминазы – аспарагиновая (АСТ) и аланиновая (АЛТ)
|
|
Учитывая обратимость реакции переаминирования эти трансаминазы называются также глутамико-щавелевоуксусной (ГЩТ) и глутамикопировиноградной (ГПТ)
Аспарагиновая трансаминаза катализирует обратимый перенос аминогруппы между глутаминовой и щавелевоуксусной кислотами с образованием аспарагиновой и α–кетоглутаровой кислотой.
АСТ обнаружена во всех органах, причем она локализуется как в цитоплазме, так и в митохондриях. Наибольшая ее активность выявляется в кардиомиоцитах и поэтому при их повреждении отмечается выраженная гиперферментемия АСТ, что служит важным диагностическим показателем инфаркта миокарда (так же, как и повышение активности ЛДГ1,2 или креатинфосфокиназы).
АСТ принимает участие в функционировании малат-аспартатного челночного механизма.
Аланиновая трансаминаза (АЛТ) катализирует обратимый перенос аминогруппы между глутаминовой и пировиноградной кислотами с образованием аланина и α-кетоглутарата.
АЛТ локализована в цитоплазме всех клеток. Однако в отличие от АСТ ее наибольшая активность обнаруживается в печени, поэтому при повреждении гепатоцитов в сыворотке крови выявляется значительное повышение активности этого фермента. Процессы переаминирования аминокислот тесно связаны с их дезаминированием.
71. Пути дезаминирования в живых системах. Прямое и непрямое окислительное дезаминирование аминокислот. Последовательность реакций, ферменты, биологическая роль.
Дезаминирование аминокислот – процесс отщепления α-аминогруппы с выделением свободного аммиака
В результате реакции дезаминирования образуется свободный аммиак и безазотистый остаток - кетокислота.
С химической точки зрения, возможны 4 типа дезаминирования аминокислот: окислительное (с образованием кетокислоты), восстановительное (с образованием предельной жирной кислоты), внутримолекулярное (с образованием непредельной кислоты) и гидролитическое (с образованием оксикислоты).
В организме дезаминирование аминокислот осуществляется в основном окислительным путем.
Различают прямое и непрямое окислительное дезаминирование аминокислот.
| Прямое дезаминирование катализируется одним ферментом, в результате образуется NH3 и кетокислота. Прямое окислительное дезаминирование может идти в присутствии кислорода (аэробное) и не нуждаться в кислороде (анаэробное). 1. Аэробное прямое окислительное дезаминирование катализируется оксидазамиD-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. | 
|
| 2. Анаэробное прямое окислительное дезаминирование существует только для глутаминовой кислоты, катализируется только глутаматдегидрогеназой, превращающей глутамат в альфа-кетоглутарат. Фермент глутаматдегидрогеназа имеется в митохондриях всех клеток организма (кроме мышечных) | 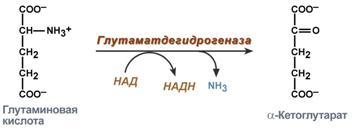
|

| 
|
|
|
Непрямое окислительное дезаминирование (трансдезаминирование)
Непрямое окислительное дезаминирование включает 2 этапа и активно идет во всех клетках организма.
Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты – этот перенос называется трансаминирование.
В качестве кетокислоты-акцептора ("кетокислота 2") в организме обычно используется альфа-кетоглутаровая кислота, которая превращается в глутамат.
В результате трансаминирования свободные аминокислоты теряют NH2-группы и превращаются в соответствующие кетокислоты. Далее их кетоскелет катаболизирует специфическими путями и вовлекается в цикл трикарбоновых кислот и тканевое дыхание, где сгорает до СО2 и Н2О. При необходимости (например, голодание) углеродный скелет глюкогенных аминокислот может использоваться для синтеза глюкозы.
Второй этап состоит в отщеплении аминогруппы от новообразованной аминокислоты
(всегда глутамат) – происходит дезаминирование, которое осуществляется глутаматдегидрогеназой
Учитывая тесную связь обоих этапов, непрямое окислительное дезаминирование называют трансдезаминирование.
Биологическая роль: 1) при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются а-кетоглутарат и аммиак;
при необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты.
|
|

Образование и обезвреживание аммиака. Синтез и распад глутамина. Обезвреживание аммиака в почках и печени. Биосинтез мочевины. Этапы орнитинового цикла. Связь орнитинового цикла с ЦТК.
Аммиак непрерывно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основными источниками аммиака являются следующие реакции:
- внутримолекулярное дезаминирование гистидина, катаболизм некоторых аминокислот (серина, треонина, глицина) – в печени,
- окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
- дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках,
- катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
- жизнедеятельность бактерий толстого кишечника,
- распад пуриновых и пиримидиновых оснований – во всех тканях.
\Синтез глутамина 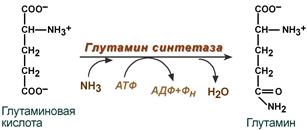
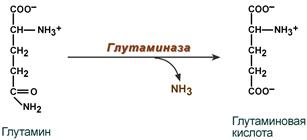
Распад глутамина


Этапы орнитинового цикла:
1) Свободный аммиак вместе с СО2 образует карбамоилфосфат, представляющий собой высокоэнергетическое соединение, мощный ацилирующий агент.
2) Далее карбамоилфосфат реагирует с орнитином, отдавая ему свою карбамильную группу, в результате чего образуются цитрул-лин и свободная фосфорная кислота. Орнитин преобразуется в цитруллин внутри митохондрий. Данная реакция катализируется
орнитин-карбомоилтрансферазой.
3) Второй этап синтеза аргинина протекает в цитоплазме (цитозоле). Второй аминогруппой, вступающей в цикл мочевины, является аминогруппа аспарагиновой кислоты (аспартата). Реакцию катализирует аргининисукцинатсинтетаза.
4) На следующей стадии при расщеплении аргининосукцината образуются аргинин и фумарат. Катализирует фермент аргининсукцинатлиаза.
5) Отщепление гуанидиновой группы от аргинина приводит к образованию мочевины и регенерации орнитина.

Связь орнитинового цикла с ЦТК: Фумарат, образующийся в результате расщепления аргининосукцината, превращается в малат, который затем переносится в митохондрии, включается в ЦТК и дегидрируется с образованием оксалоацетата. Эта реакция сопровождается выделением 3 молекул АТФ, которые и компенсируют затраты энергии на синтез одной молекулы мочевины.
|
|
Обмен фенилаланина и тирозина. Образование фенилпировиноградной, фенилмолочной и фенилуксусной кислот. Использование тирозина для синтеза катехоламинов, тироксина, меланина. Распад тирозина до фумаровой и ацетоуксусной кислот. Наследственные нарушения обмена фенилаланина и тирозина: фенилпировиноградная олигофрения, алкаптонурия, альбинизм.
При любых нарушениях превращения фенилаланина в тирозин развивается фенилкетонурия.
Фенилкетонурия 1 типа является наиболее распространенной аминоацидопатией.
Этиология:Заболевание наследуется аутосомно-рецессивно и вызвано мутацией, которая вызывает снижение активности фермента фенилаланингидроксилазы, обеспечивающей превращение фенилаланина в тирозин. Фермент имеется только в печени, почках, поджелудочной железе.
Патогенез:В патогенезе ФКУ имеют значение многие обстоятельства, в частности:
-значительное накопление в тканях и жидкостях больного организма фенилаланина и его производных (фенилпировиноградная, фенилмолочная (миндальная), фенилуксусная, гиппуровая кислоты, фенилэтиламин, фенилацетилглютамин) и вызванный ими ацидоз,
-прямое токсическое действие указанных веществ на центральную нервную систему, которое заключается в торможении фенилаланином активности ряда ферментов, в том числе пируваткиназы (окисление глюкозы), тирозиназы (синтез меланина), тирозин-гидроксилазы (синтез катехоламинов) и нарушение синтеза моноаминовых нейромедиаторов – тирамина, октопамина,
-нарушение синтеза серотонина, т.к. фенилаланингидроксилаза также вовлечена в гидроксилирование триптофана до 5-гидрокситриптофана, предшественника серотонина,
-конкурентное снижение фенилаланином транспорта в клетки ароматических аминокислот – триптофана и тирозина,
-нарушение синтеза простых и сложных белков в тканях, что вызывает тяжелые повреждения мозга и нарушение функции печени у большинства больных.
Основы лечения: Вовремя начатое лечение (диетотерапия) обеспечивает хороший клинический эффект, нормальную продолжительность жизни.
Единственным методом лечения является диетотерапия – исключение из питания больного высокобелковых продуктов питания с высоким количеством фенилаланина (мясо, рыба, яйцо, молоко, крупы). Вместо натурального белка используют специальные гидролизаты белка, частично или полностью лишенные фенилаланина.
Алкаптонурия
Этиология: Генетическая аутосомно-рецессивная энзимопатия, частота варьирует 1:250 тыс.-1:1 млн. В основе заболевания лежит снижение активности печеночного фермента гомогентизат-оксидазы, в результате в организме накапливается гомогентизиновая кислота.
Клиническая картина:Так как гомогентизат на воздухе окисляется и полимеризуется в меланиноподобное соединение, то наиболее частым и постоянным симптомом является темная моча, на пеленке и нижнем белье остаются темно-коричневые пятна. Другим образом в детском возрасте болезнь не проявляется.
С возрастом гомогентизиновая кислота, накапливается в соединительно-тканных образованиях, склерах и коже, вызывает шиферно-глубокий оттенок ушного и носового хрящей (охроноз), окрашивает одежду, контактирующую с потеющими участками тела (подмышки).
Из-за связывания гомогентизата с коллагеном ухудшается состояние соединительной ткани, что делает хрупкими хрящевые образования. После 30 лет развивается дегенеративный артрит позвоночника и крупных суставов (бедренные, коленные), межпозвонковые пространства сужены, снижается минеральная плотность костей. Может наблюдаться поражение почек и сердца.
Основы лечения: Хотя эффективные способы неизвестны, по аналогии с другими аминокислотными нарушениями рекомендуется с раннего возраста ограничить потребление фенилаланина и тирозина, что должно препятствовать развитию охроноза и суставных нарушений. Назначают большие дозы аскорбиновой кислоты для снижения связывания гомогентизиновой кислоты в соединительной ткани. Предлагается использовать препарат нитизинон, конкурентный ингибитор 4-гидроксифенилпируват-диоксигеназы.
Альбинизм
Этиология: Заболевание обусловлено полным или частичным дефектом синтеза фермента тирозиназы (частота 1:20000), необходимой для синтеза диоксифенилаланина и далее меланинов в пигментных клетках.
Клиническая картина: При полном отсутствии фермента наблюдается тотальная депигментация кожи, волос, глаз, причем окраска одинакова для всех расовых групп и не меняется с возрастом. Кожа не загорает, совершенно отсутствуют невусы, какие-либо пигментные пятна, развиваются фотодерматиты. Сильно выражены нистагм, светобоязнь, дневная слепота (т.к. имеется депигментация сетчатки и ускоренный распад родопсина), красный зрачковый рефлекс.
При частичной недостаточности фермента отмечаются светло-желтые волосы, слабо пигментированные родинки, очень светлая кожа.
Основы лечения: Рекомендуется использовать различные средства защиты от ультрафиолетовых лучей.

74. Декарбоксилирование аминокислот. Образование биогенных аминов: гистамина, триптамина, серотонина, ГАМК, их биологическая роль. Инактивация биогенных аминов.

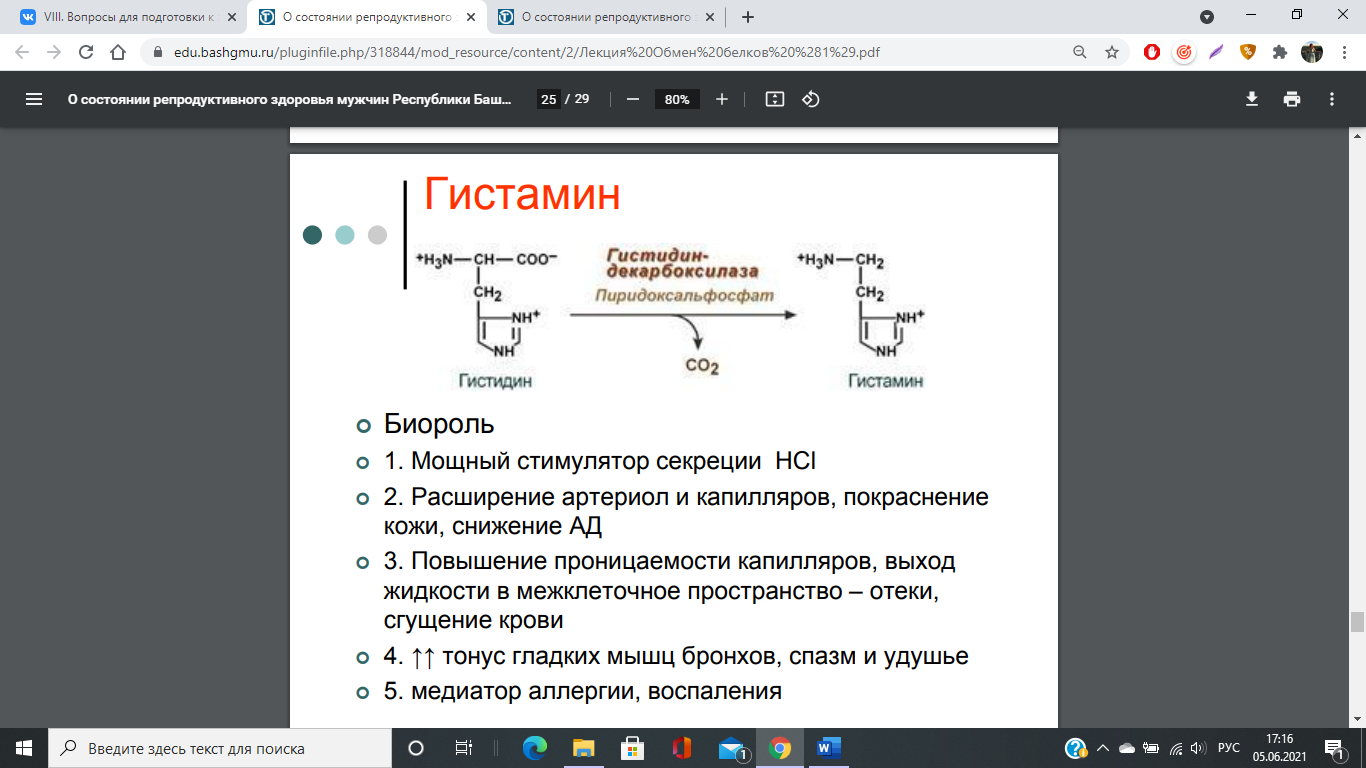
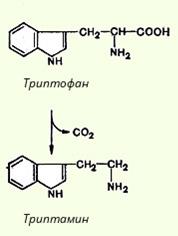
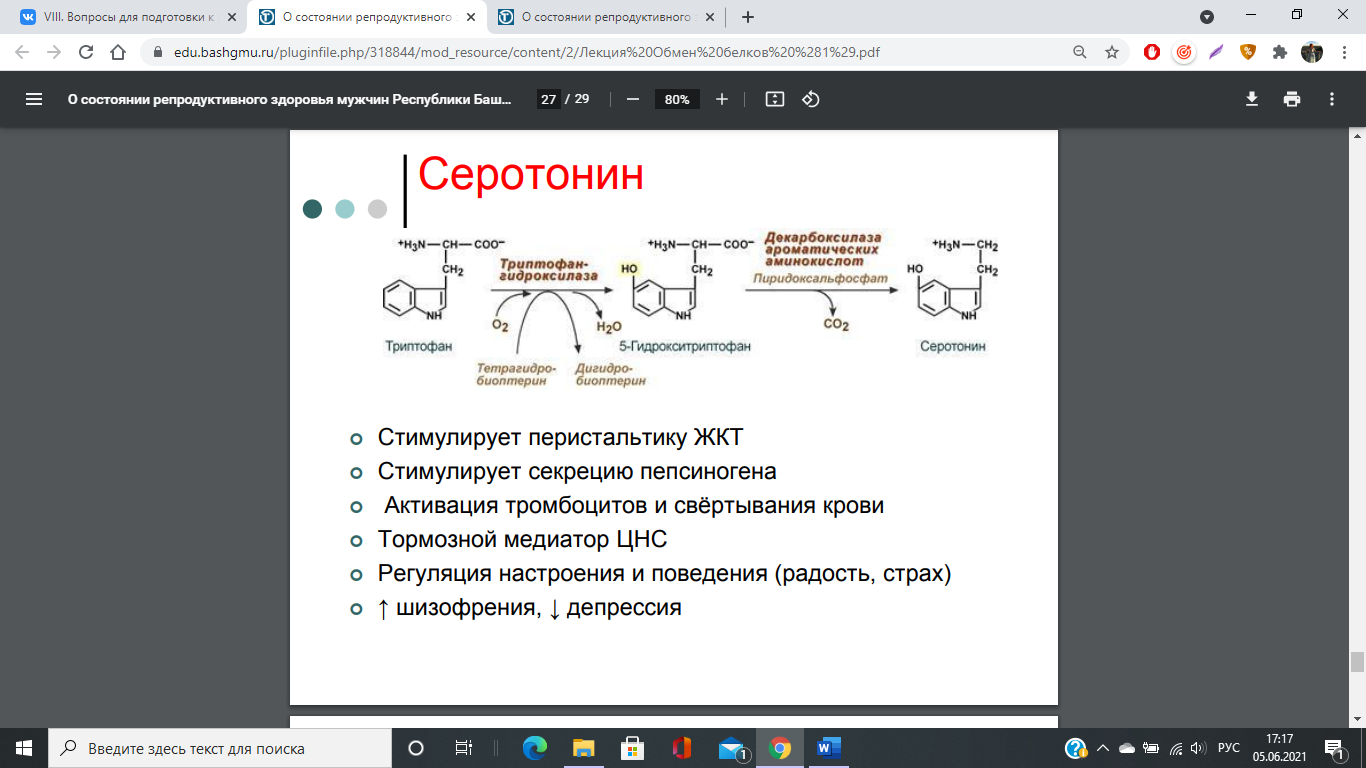
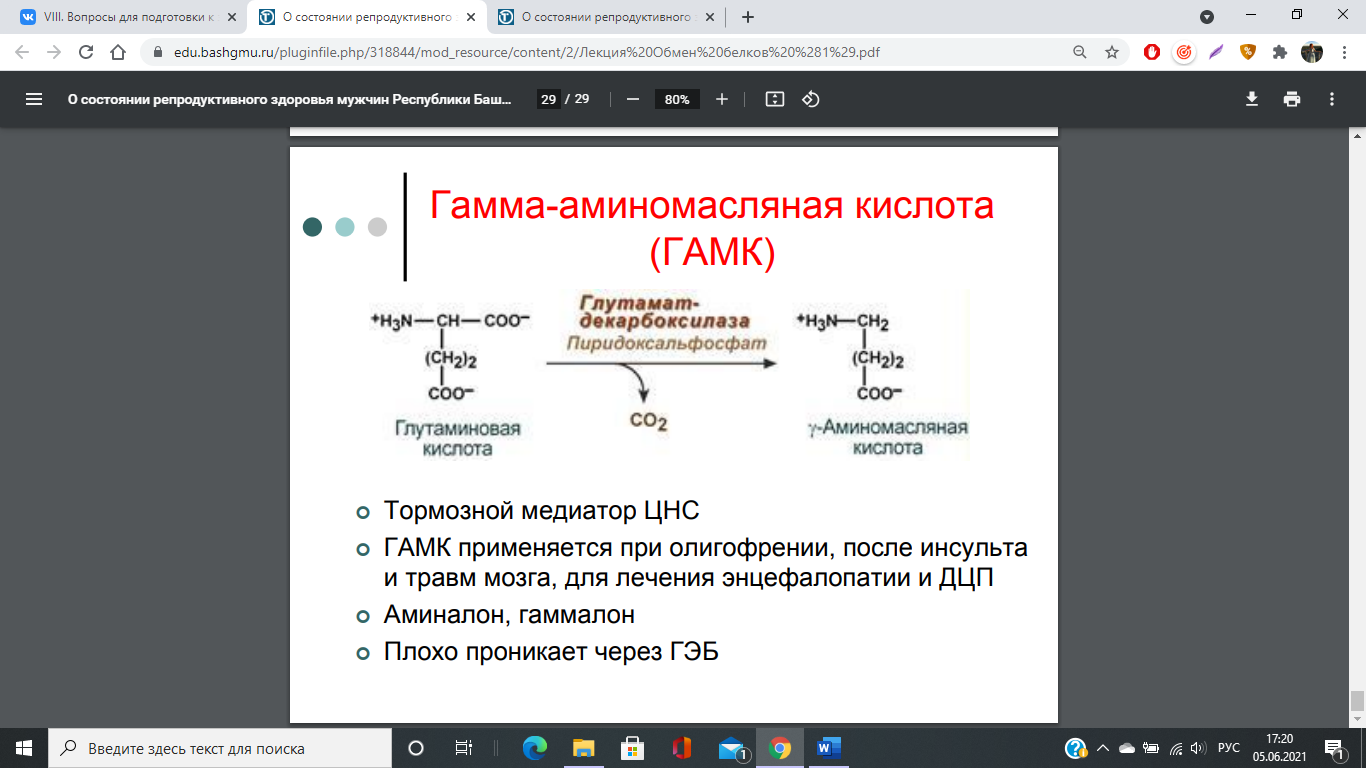

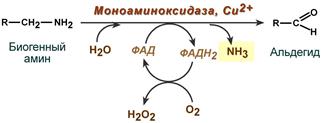
Существуют два способа инактивации биогенных аминов - дезаминирование и метилирование.
Дезаминирование протекает с образованием свободного аммиака и с участием ФАД. Катализирует реакцию моноаминоксидаза, она обнаружена во многих тканях, но наиболее активна в печени, желудке, почках, кишечнике, нервной ткани.
Метилирование биогенного амина происходит при наличии у него гидроксильной группы (дофамин, серотонин). В реакции принимает участие активная форма метионина – S-аденозилметионин (SAM), образуется метилированная форма амина и S-аденозилгомоцистеин (SАГ)
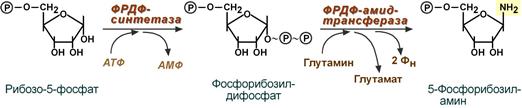
75. Биосинтез пуриновых нуклеотидов: происхождение атомов пуринового кольца, начальная стадия биосинтеза (от рибозо-5-фосфата до 5-фосфорибозиламина). Дополнительные пути синтеза пуриновых нуклеотидов. Катаболизм пуриновых нуклеотидов. Гиперурикемия и подагра.

Синтез 5'-фосфорибозиламина В этих реакциях источниками атомов пуринового кольца являются глицин, аспартат, еще одна молекула глутамина, углекислый газ и производные ТГФК. В целом на синтез пуринового кольца затрачивается энергия 6 молекул АТФ.
Рибозо-5-фосфат является тем якорем, на основе которого синтезируется сложный пуриновый цикл. Первая реакция синтеза пуринов заключается в активации углерода в первом положении рибозо-5-фосфата, это достигается синтезом 5-фосфорибозил-1-дифосфата (ФРДФ).
Вторая реакция – это перенос NH2-группы глутамина на активированный атом С1 рибозо-5-фосфата с образованием 5-фосфорибозиламина. Указанная NH2-группа фосфорибозиламина уже принадлежит будущему пуриновому кольцу и ее азот будет атомом номер 9.
|
|
|

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!