68. Предложите гальванический элемент, с помощью которого возможно определить средний ионный коэффициент активности соли AB (дан конкретный сильный электролит) в водном растворе. Получите выражение для расчета коэффициента активности.
Предложите гальванический элемент, с помощью которого можно определить рН исследуемого раствора. Запишите уравнение Нернста для каждого из электродов электрохической цепи. Получите уравнение для расчета рН раствора.
Составьте гальванический элемент, с помощью которого возможно определить парциальное давление азота в азот-водородной газовой смеси, находящейся под давлением Р. Запишите уравнение Нернста для используемого гальванического элемента, назовите все входящие в него величины.
71. Применение измерений ЭДС для определения констант равновесия окислительно-восстановительных химических реакций. Поясните на конкретном примере.
 72.Индикаторные электроды. Применение измерений ЭДС для определения
72.Индикаторные электроды. Применение измерений ЭДС для определения  раствора. Рассмотрите на конкретном примере. Электроды, обратимые относительно иона вод-да, используются на практике для определения активности этих ионов в растворе (и, след, рН р-ра) потенциометрическим методом, основанном на определении потенциала электрода в р-ре с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного эл-да может использ-ся и водородный электрод, однако чаще применяются хингидронный и стеклянный электроды. Схема стекл. эл-да: 1 – стеклянный шарик (мембрана); 2 – внутренний раствор НС1; 3 – хлорсеребряный электрод; 4 – измеряемый раствор; 5 – металлический проводник. Наиб. часто употребл. стекл. эл-д в виде трубки, оканчив-ся тонкостенным стекл. шариком. Шарик заполняется р-ром НСl с опред. активностью ионов водорода; в р-р погружен вспомогательный эл-д (обычно хлорсеребряный). Потенциал стекл. эл-да с водородной функцией (т.е. обратимого по отношению к иону Н+) выражается уравнением
раствора. Рассмотрите на конкретном примере. Электроды, обратимые относительно иона вод-да, используются на практике для определения активности этих ионов в растворе (и, след, рН р-ра) потенциометрическим методом, основанном на определении потенциала электрода в р-ре с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного эл-да может использ-ся и водородный электрод, однако чаще применяются хингидронный и стеклянный электроды. Схема стекл. эл-да: 1 – стеклянный шарик (мембрана); 2 – внутренний раствор НС1; 3 – хлорсеребряный электрод; 4 – измеряемый раствор; 5 – металлический проводник. Наиб. часто употребл. стекл. эл-д в виде трубки, оканчив-ся тонкостенным стекл. шариком. Шарик заполняется р-ром НСl с опред. активностью ионов водорода; в р-р погружен вспомогательный эл-д (обычно хлорсеребряный). Потенциал стекл. эл-да с водородной функцией (т.е. обратимого по отношению к иону Н+) выражается уравнением  73.Нормальный элемент Вестона. Устройство элемента. Электродные полуреакции, уравнение самопроизвольной реакции, уравнение Нернста. Области его применения. Нормальный элемент Вестона: Ртутно-кадмиевый элемент Pt | Cd(Hg) | CdSO4 | Hg2SO4, Hg | Pt; Уравнения полуреакций: Cd2+ + 2e → Cd(Hg); Hg2SO4 + 2e → 2Hg + SO42-Уравнение реакции: Cd + Hg22+ → Cd2+ + 2Hg Уравнение Нернста:
73.Нормальный элемент Вестона. Устройство элемента. Электродные полуреакции, уравнение самопроизвольной реакции, уравнение Нернста. Области его применения. Нормальный элемент Вестона: Ртутно-кадмиевый элемент Pt | Cd(Hg) | CdSO4 | Hg2SO4, Hg | Pt; Уравнения полуреакций: Cd2+ + 2e → Cd(Hg); Hg2SO4 + 2e → 2Hg + SO42-Уравнение реакции: Cd + Hg22+ → Cd2+ + 2Hg Уравнение Нернста: 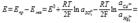
 Используется как источник опорного напряжения при калибровке потенциометров, т. к. обладает устойчивым значением вырабатываемой ЭДС
Используется как источник опорного напряжения при калибровке потенциометров, т. к. обладает устойчивым значением вырабатываемой ЭДС
74.Предложите гальванический элемент, с помощью которого можно определить  и
и  для реакции (дано уравнение). Какие данные необходимо получить для расчета указанных термодинамических функций.
для реакции (дано уравнение). Какие данные необходимо получить для расчета указанных термодинамических функций.
Измерение ЭДС гальванического элемента E и ее изменения с температурой dE/dT позволяет вычислить важнейшие термодинамические величины для химической окислительно-восстановительной реакции, протекающей в элементе.
Из уравнения Гиббса-Гельмгольца
 , ,
| (5)
|
Учитывая выражение (2), получим
 , ,
| (6)
|
Откуда  . .
| (7)
|
| | | | |
Из уравнения  ,
,
учитывая формулу (1)
 . .
| (8)
|
Из уравнения (8) следует, что
 . .
| (9)
|
В гальванических элементах, работа которых не связана с выделением или поглощением газов, изменения объема малы и можно пренебречь разницей между ΔН и ΔU. Тогда уравнение (7) принимает вид:
 . .
| (10)
| Величина д E/ д T называется температурным коэффициентом ЭДС гальванического элемента. Температурный коэффициент д E/ д T м б определен по зависимости ЭДС гальванического эл-та от температуры. Величина д E/ д T может быть +, - и =0 в зависимости от природы гальванического элемента.
|
|
75.Предложите гальванический элемент, с помощью которого можно экспериментально определить термодинамическую константу равновесия реакции: (дано уравнение). Запишите выражение для расчета константы равновесия и назовите все входящие в него величины. Константа равновесия показ. во скок раз скорость прямой р-ции > или < скорости обратной р-ции. Константа равновесия – это отношен. произведения равновесных конц-ций продуктов р-ции, взятых в степени их стехиометрических коэфф. к произведению равновесных конц. исходных в-в, взятых в степени их стехиометрических коэфф. aA + bВ = cC + dD Если гомогенная р-ция идет между в-вами в р-ре, то const равновесия обозначается KС, а если между газами, то KР. 
 , где равновесные концентрации Сi, парциальные давления рi или мольные доли Xi
, где равновесные концентрации Сi, парциальные давления рi или мольные доли Xi
76. Определение рН р-ров сильных и слабых электролитов. Для р-ров слабых кислот конц. ионов водорода [H+] в р-ре рассчитывается по формуле:  где: Кк– const диссоциации слаб кислоты; Ск– концентр. к-ты, моль/дм3. Для р-ров слабых оснований концентр. гидроксильных ионов рассчитывается по формуле:
где: Кк– const диссоциации слаб кислоты; Ск– концентр. к-ты, моль/дм3. Для р-ров слабых оснований концентр. гидроксильных ионов рассчитывается по формуле:  где: Ко– const диссоциации слабого основания; Сосн.– конц. основания, моль/дм3. Для сильных: рОН = – lg[ОН-] или рН = – lg[H+] (тк в разбавленных р-рах практически полностью диссоциирует на ионы, т е равно общей концентрации раствора)
где: Ко– const диссоциации слабого основания; Сосн.– конц. основания, моль/дм3. Для сильных: рОН = – lg[ОН-] или рН = – lg[H+] (тк в разбавленных р-рах практически полностью диссоциирует на ионы, т е равно общей концентрации раствора)
128.Фотохимические реакции. Законы фотохимии. В соответствии с законом Эйнштейна квантовый выход фотохимической реакции должен равняться единице. Почему для некоторых фотореакций он оказывается <1? Основные законы фотохимии: 1. Закон Гроттгуса-Дрепера — эффективным для фотохимического процесса является только то излучение, которое поглощается данным веществом.2. Закон Вант-Гоффа — количество фотохимически преобразованного вещества пропорционально количеству поглощенной энергии, инициирующей реакцию. 3. Закон квантовой активации Штарка-Эйнштейна — на первичной стадии ФХ процесса молекула активируется при поглощении одного кванта ЭМИ. Квантовый выход Ф= N /Nкв Квантовый выход — это отношение числа молекул, превращенных в продукты, к количеству поглощенных квантов излучения. Nкв= E /hν В обычных реакциях, когда в продукты превращаются возбужденные молекулы, Ф < 1. Величина Ф зависит от ряда факторов, таких как давление компонентов, присутствие посторонних веществ, материал сосуда и соотношение площади поперечного сечения в объему.
129.Фотохимические реакции. Механизм активации. Стадии фотохимической реакции. Первичные фотохимические реакции. Фотофизические (дезактивации-онные) процессы. Вторичные (темновые) химические реакции. Квантовый выход фотохимической реакции. Основные законы фотохимии: 1. Закон Гроттгуса-Дрепера — эффективным для фотохимического процесса является только то излучение, которое поглощается данным веществом.
2. Закон Вант-Гоффа — количество фотохимически преобразованного вещества пропорционально количеству поглощенной энергии, инициирующей реакцию. 3. Закон квантовой активации Штарка-Эйнштейна — на первичной стадии ФХ процесса молекула активируется при поглощении одного кванта ЭМИ. Квантовый выход — это отношение числа молекул, превращенных в продукты, к количеству поглощенных квантов излучения. Nкв= E /hν
139.Сенсибилизированные фотохимические реакции. Сенсибилизаторы. Приведите пример фотосенсибилизированной реакции. По механизму ФХР делятся на 3 группы: 1) в результате поглощения излучения молекулы переходят в возбужденное состояние без ее разложения; 2) в результате поглощения излучения происходит образование активных частиц в результате фотодиссоциации; 3) если реагирующая молекула не может поглотить излучение в данной области спектра, в реакционную смесь вводятся вещества, способные к поглощению и которые затем испускают излучение в той области спектра, в которой реагирующие вещества могут его поглощать. Такие процессы называются фотосенсибилизационными. Пример такой реакции: (UO2)2+ → 250-450нм → (UO2)2+* (COOH)2 → (UO2)2+* → CO + CO2 + H2O



 72.Индикаторные электроды. Применение измерений ЭДС для определения
72.Индикаторные электроды. Применение измерений ЭДС для определения  раствора. Рассмотрите на конкретном примере. Электроды, обратимые относительно иона вод-да, используются на практике для определения активности этих ионов в растворе (и, след, рН р-ра) потенциометрическим методом, основанном на определении потенциала электрода в р-ре с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного эл-да может использ-ся и водородный электрод, однако чаще применяются хингидронный и стеклянный электроды. Схема стекл. эл-да: 1 – стеклянный шарик (мембрана); 2 – внутренний раствор НС1; 3 – хлорсеребряный электрод; 4 – измеряемый раствор; 5 – металлический проводник. Наиб. часто употребл. стекл. эл-д в виде трубки, оканчив-ся тонкостенным стекл. шариком. Шарик заполняется р-ром НСl с опред. активностью ионов водорода; в р-р погружен вспомогательный эл-д (обычно хлорсеребряный). Потенциал стекл. эл-да с водородной функцией (т.е. обратимого по отношению к иону Н+) выражается уравнением
раствора. Рассмотрите на конкретном примере. Электроды, обратимые относительно иона вод-да, используются на практике для определения активности этих ионов в растворе (и, след, рН р-ра) потенциометрическим методом, основанном на определении потенциала электрода в р-ре с неизвестным рН и последующим расчетом рН по уравнению Нернста. В качестве индикаторного эл-да может использ-ся и водородный электрод, однако чаще применяются хингидронный и стеклянный электроды. Схема стекл. эл-да: 1 – стеклянный шарик (мембрана); 2 – внутренний раствор НС1; 3 – хлорсеребряный электрод; 4 – измеряемый раствор; 5 – металлический проводник. Наиб. часто употребл. стекл. эл-д в виде трубки, оканчив-ся тонкостенным стекл. шариком. Шарик заполняется р-ром НСl с опред. активностью ионов водорода; в р-р погружен вспомогательный эл-д (обычно хлорсеребряный). Потенциал стекл. эл-да с водородной функцией (т.е. обратимого по отношению к иону Н+) выражается уравнением  73.Нормальный элемент Вестона. Устройство элемента. Электродные полуреакции, уравнение самопроизвольной реакции, уравнение Нернста. Области его применения. Нормальный элемент Вестона: Ртутно-кадмиевый элемент Pt | Cd(Hg) | CdSO4 | Hg2SO4, Hg | Pt; Уравнения полуреакций: Cd2+ + 2e → Cd(Hg); Hg2SO4 + 2e → 2Hg + SO42-Уравнение реакции: Cd + Hg22+ → Cd2+ + 2Hg Уравнение Нернста:
73.Нормальный элемент Вестона. Устройство элемента. Электродные полуреакции, уравнение самопроизвольной реакции, уравнение Нернста. Области его применения. Нормальный элемент Вестона: Ртутно-кадмиевый элемент Pt | Cd(Hg) | CdSO4 | Hg2SO4, Hg | Pt; Уравнения полуреакций: Cd2+ + 2e → Cd(Hg); Hg2SO4 + 2e → 2Hg + SO42-Уравнение реакции: Cd + Hg22+ → Cd2+ + 2Hg Уравнение Нернста: 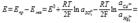
 Используется как источник опорного напряжения при калибровке потенциометров, т. к. обладает устойчивым значением вырабатываемой ЭДС
Используется как источник опорного напряжения при калибровке потенциометров, т. к. обладает устойчивым значением вырабатываемой ЭДС и
и  для реакции (дано уравнение). Какие данные необходимо получить для расчета указанных термодинамических функций.
для реакции (дано уравнение). Какие данные необходимо получить для расчета указанных термодинамических функций. ,
,
 ,
,
 .
.
 ,
, .
.
 .
.
 .
.

 , где равновесные концентрации Сi, парциальные давления рi или мольные доли Xi
, где равновесные концентрации Сi, парциальные давления рi или мольные доли Xi где: Кк– const диссоциации слаб кислоты; Ск– концентр. к-ты, моль/дм3. Для р-ров слабых оснований концентр. гидроксильных ионов рассчитывается по формуле:
где: Кк– const диссоциации слаб кислоты; Ск– концентр. к-ты, моль/дм3. Для р-ров слабых оснований концентр. гидроксильных ионов рассчитывается по формуле:  где: Ко– const диссоциации слабого основания; Сосн.– конц. основания, моль/дм3. Для сильных: рОН = – lg[ОН-] или рН = – lg[H+] (тк в разбавленных р-рах практически полностью диссоциирует на ионы, т е равно общей концентрации раствора)
где: Ко– const диссоциации слабого основания; Сосн.– конц. основания, моль/дм3. Для сильных: рОН = – lg[ОН-] или рН = – lg[H+] (тк в разбавленных р-рах практически полностью диссоциирует на ионы, т е равно общей концентрации раствора)


