

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Интересное:
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Металлы (от лат. metallum – шахта, рудник): группа элементов, обладающая характерными металлическими свойствами.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ.
Металлическая кристаллическая решетка – наличие подвижных электронов
2.Металлический блеск (неметаллы йод и углерод в виде графита)
Наиболее хорошо: алюминий, серебро, палладий и родий.
3. Твёрдое состояние (кроме ртути).Обладают различной твёрдостью:
щелочные металлы режутся ножом, а ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло. ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
3. Пластичность - возможность лёгкой механической обработки.
Самыми пластичными являются золото, серебро и медь, германий и висмут непластичны.

4. Высокая теплопроводность и электропроводимость обусловлена наличием подвижных электронов.
Серебро, медь и алюминий имеют наибольшую электропроводность.
5. Высокая плотность
Металлы делят на: 1) лёгкие (плотность 0,53 ÷ 5 г/см³).Самый лёгкий литий (плотность 0.53 г/см³).
2) тяжёлые (5 ÷ 22,5 г/см³). Самые тяжёлые металлы осмий и иридий (около 22.6 г/см³).
6. Температура плавления
лежит в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам).
В РЕАКЦИЯХ ВСЕГДА ЯВЛЯЮТСЯ ВОССТАНОВИТЕЛЯМИ.
Атомы металлов легко отдают электроны внешнего (а некоторые – и предвнешнего) электронного слоя, превращаясь в положительные ионы
ВОЗМОЖНЫЕ СТЕПЕНИ ОКИСЛЕНИЯ Ме
Низшая 0,+1,+2,+3
Высшая +4,+5,+6,+7,+8
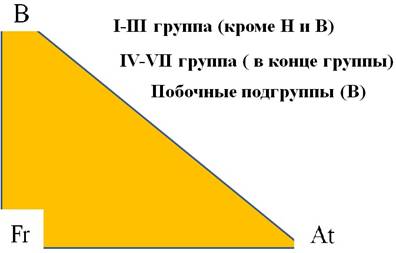
МЕТАЛЛЫ I ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (А) (ЩЕЛОЧНЫЕ МЕТАЛЛЫ).
Литий, натрий, калий, рубидий, цезий, франций
Мягкие металлы, легко режутся ножом.
На срезе белого цвета с блеском, исчезающим на воздух
|
|

МЕТАЛЛЫ II ГРУППЫ ГЛАВНОЙ ПОДГРУППЫ (А)
бериллий, магний, щелочноземельные металлы (кальций, стронций, барий) и радий.

АЛЮМИНИЙ И ЭЛЕМЕНТЫ III-A ГРУППЫ
Алюминий - серебристо-белый легкий металл.
Отличительные особенности алюминия - высокая электропроводимость, теплопроводность, коррозионная стойкость, малая плотность и отличная обрабатываемость давлением в холодном состоянии.

Цинк — элемент побочной подгруппы второй группы (В), четвёртого периода
Хрупкий переходный металл голубовато-белого цвета (тускнеет на воздухе, покрываясь тонким слоем оксида цинка).

Медь -тяжелый розово-красный металл, мягкий и ковкий.

Железу присущи все металлические свойства:
· пластичность
· электро- и теплопроводность
· характерный металлический блеск.
· Металл обладает магнитными свойствами.

НЕМЕТАЛЛЫ
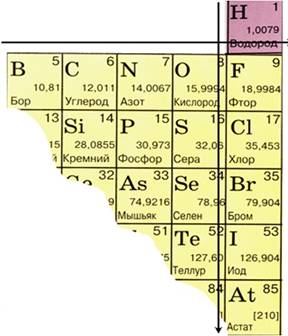
Из 109 химических элементов 22 неметаллы, расположены в правом верхнем углу ПСХЭ, из них 6 – инертные газы (8A).
Элементы с неметаллическими свойствами находятся в IIIA-VIIA - группах Периодической системы:
Особенности атомного строения неметаллов:
1. Небольшой атомный радиус
2. На внешнем уровне 4-8 электронов (исключение водород – 1 электрон, гелий – 2 электрона)
3. Располагаются только в главных подгруппах
4. Характерно высокое значение ЭО
5. Степени окисления от -4 до +8
Химические связь ковалентная неполярная или вещества атомарного строения
АТОМАРНОЕ СОСТОЯНИЕ
Инертные или благородные газы не образуют молекул и существуют в атомарном состоянии (не образуют решеток)
He –гелий, Ne-неон, Ar-аргон, Kr-криптон, Xe-ксенон, Rn-радон
АТОМНЫЕ КРИСТАЛЛИЧЕСКИЕ РЕШЁТКИ: алмаз (С) и кремний (Si)
3. МОЛЕКУЛЯРНАЯ НЕПОЛЯРНАЯ КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА
Многие неметаллы образуют молекулу, состоящую из двух атомов (H2, O2, N2, F2, Cl2, Br2, I2), при этом образуется очень непрочная связь.
При обычной температуре неметаллы могут быть в разном агрегатном состоянии
|
|
1. Газообразные - O2-кислород, H2 - водород, N2- азот, Cl2-хлор, F2-фтор.
2. Жидкие - Br2 -бром
3. Твердые – S –сера, P-фосфор, I2 –йод, C–-алмаз и графит
Многие не проводят электрический ток (кроме графита и кремния).
Не проводят тепло.
В твердом состоянии - хрупкие
Не имеют металлического блеска (кроме иода-I2, графита-C и кремния Si)
Цвет охватывает все цвета спектра: красный-красный фосфор, желтый –сера, зеленый-хлор, фиолетовый –пары иода.
Температура плавления изменяется в огромном интервале: tпл (N2)= -210⁰C, а tпл (Алмаз) =3730⁰С

АЛЛОТРОПИЯ
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями, или модификациями.
КИСЛОРОД
Кислород образует две аллотропные модификации (причина- строение молекулы)
КИСЛОРОД O₂: Газ без цвета и запаха Входит в состав воздуха (21% по объему). Не ядовит!
ОЗОН O3: Газ бледно-фиолетового цвета с резким запахом свежести.
Обладает бактерицидными свойствами, способен удерживать ультрафиолетовые лучи.

СЕРА
Твердое кристаллическое вещество желтого цвета, нерастворима в воде, водой не смачивается (плавает на поверхности), t кип = 445 °С
Возможные валентности: II, IV, VI. Степени окисления: -2, 0, +4, +6
У серы можно выделить три аллотропных модификации: кристаллическая(ромбическая),моноклинная и пластическая.
Переход из кристаллической в пластическую происходит при нагревании до температуры кипения при последующем быстром охлаждении.

АЗОТ
Азот – газ без цвета и запаха, плохо растворим в воде. Азот является основной частью воздуха (79% по объѐму).
ФОСФОР
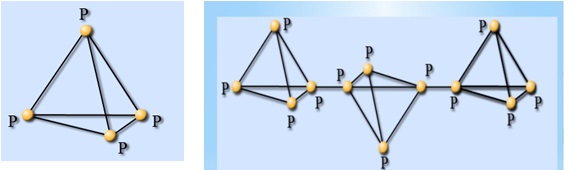
Образует семь аллотропных модификаций, причиной является строение кристаллической решётки.
Фосфор белый P₄(молекулярная кристаллическая решётка)
Мягкое, бесцветное вещество. В темноте светится. Ядовит!
Фосфор красный Pn (атомная кристаллическая решётка) аморфное
полимерное вещество(порошок). в темноте не светится, ядовит

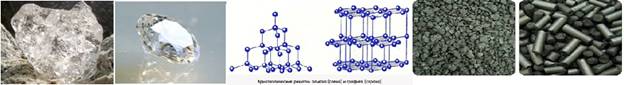
УГЛЕРОД
образует две аллотропные формы (причина – строение кристаллической решётки)
Алмаз: Тетраэдрическая кристаллическая решетка
Бесцветные кристаллы. Самое твердое вещество в природе. tпл=3730ºC
Графит: Кристаллическая решетка напоминает соты
|
|
Слоистое кристаллическое вещество, жирное на ощупь, непрозрачное,серого цвета.
ПРОСТЫЕ И СЛОЖНЫЕ ВЕЩЕСТВА.
Простые вещества состоят из атомов одного ХЭ, сложные вещества - из атомов двух и более ХЭ.
БИНАРНЫЕ СОЕДИНЕНИЯ:
а) галогениды: OF2, KBr, NH4Cl, BrF3
б) хальгогениды: Na2S, ZnS, K2Se, NiSe
в) нитриды: Li3N, Mg3N2, Si3N4
г) карбиды: Al4C3, CaC2, Fe3C
д) силициды: Li4Si, Mg2Si, ThSi2
е) гидриды: LiH, CaH2, SiH4
ж) пероксиды. H2O2, Na2O2, СаO2
з) надпероксиды: HO2, КO2, Ва(O2)2
ОКСИДЫ
бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом.
В соответствии с номенклатурой ИЮПАК (систематической), оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже,
например: Na2O — оксид натрия, Al2O3 — оксид алюминия.
Если элемент имеет переменную степень окисления, то в названии оксида указывается его степень окисления римской цифрой (валентность) в скобках сразу после названия (без пробела).
Например: Cu2О — оксид меди(I), CuO — оксид меди(II), FeO — оксид железа(II), Fe2О3 — оксид железа(III), Cl2O7 — оксид хлора(VII).
Классификация оксидов (по агрегатному состоянию)
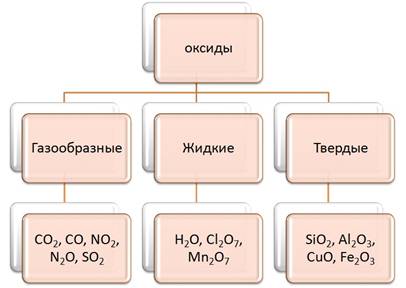
Классификация оксидов по составу

НЕСОЛЕОБРАЗУЮЩИЕ ОКСИДЫ – оксиды неметаллов, не вступающие в реакции солеобразования (отличие от основных, кислотных и амфотерных оксидов),
например: СО, NO, N2O «веселящий газ», SiO, S2O.
СОЛЕОБРАЗУЮЩИМИ называются такие оксиды, которые взаимодействуют с кислотами или основаниями и образуют при этом соль и воду.
СОЛЕОБРАЗУЮЩИЕ ДЕЛЯТСЯ НА основные, кислотные, амфотерные.
ОСНÓВНЫЕ ОКСИДЫ - СООТВЕТСТВУЮТ ОСНОВАНИЯ.
Образованы металлами в низших степенях окисления (+1, +2).Исключение: оксиды бериллия, цинка
КИСЛОТНЫЕ ОКСИДЫ – СООТВЕТСТВУЮТ КИСЛОТЫ.
Образованы металлами и неметаллами любой степени окисления
(валентность V – VI), степень окисления от +5 до +7
АМФОТЕРНЫЕ ОКСИДЫ – соответствуют амфотерные гидроксиды (двойственная природа).
Образованы амфотерными металлами (валентность II – IV): BeO, Cr2O3, ZnO, Al2O3, Fe₂O₃
|
|
КИСЛОТЫ
Металлы (от лат. metallum – шахта, рудник): группа элементов, обладающая характерными металлическими свойствами.

ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ.
Металлическая кристаллическая решетка – наличие подвижных электронов
2.Металлический блеск (неметаллы йод и углерод в виде графита)
Наиболее хорошо: алюминий, серебро, палладий и родий.
3. Твёрдое состояние (кроме ртути).Обладают различной твёрдостью:
щелочные металлы режутся ножом, а ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло. ванадий, вольфрам и хром легко царапают самую твёрдую сталь и стекло.
3. Пластичность - возможность лёгкой механической обработки.
Самыми пластичными являются золото, серебро и медь, германий и висмут непластичны.

4. Высокая теплопроводность и электропроводимость обусловлена наличием подвижных электронов.
Серебро, медь и алюминий имеют наибольшую электропроводность.
5. Высокая плотность
Металлы делят на: 1) лёгкие (плотность 0,53 ÷ 5 г/см³).Самый лёгкий литий (плотность 0.53 г/см³).
2) тяжёлые (5 ÷ 22,5 г/см³). Самые тяжёлые металлы осмий и иридий (около 22.6 г/см³).
6. Температура плавления
лежит в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам).
|
|
|

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!