Для лечения злокачественных опухолей применяют аналог тимина фторурацил. Поступая в организм, он превращается в 2'-дезо-кси-5-фтор-УМФ - мощный механизм-активируемый ингибитор тимидилатсинтазы - фермента, катализирующего образование дезокситимидинмонофосфата (дТМФ). Благодаря присутствию фтора в пятом положении пиримидинового кольца, 2'-дезокси-5-фтор-УМФ не может ни превратиться в дТМФ, ни диссоциировать от фермента. Это приводит к необратимой инактивации тимидилатсинтазы и в конечном итоге к ингибированию синтеза ДНК, необходимого для деления опухолевых клеток.
При обратимом ингибировании ингибитор связывается с ферментом нековалентными связями и легко диссоциирует от последнего. Существует несколько типов обратимого ингибирования: конкурентное, неконкурентное, смешанное и бесконкурентное. Ниже представлены первые два.
При конкурентном ингибировании ингибитор обладает структурным сходством с субстратом и конкурирует с ним за активный центр фермента. Именно поэтому выраженность конкурентного ингибирования будет определяться соотношением концентраций ингибитора и субстрата. Чем выше будет это соотношение, тем больше ингибирование фермента, и наоборот.
Примером конкурентного ингибирования может служить торможение ФАД-зависимого фермента цикла трикарбоновых кислот сукцинатдегидрогеназы (СДГ) малонатом (рис. 5-23). Сукцинатдегидрогеназа катализирует реакцию дегидрирования сукцината, в ходе которой два атома водорода переносятся от субстрата на простетическую группу фермента ФАД.
Структура малоната и субстрата этого фермента отличается всего на одну СН2-группу. Однако фермент не способен катализировать реакцию дегидрирования малоната, который тем не менее может связываться в активном центре сукцинатдегдрогеназы и ингибировать реакцию дегидрирования сукцината.
 Рис. 5-23. Связывание сукцината (а) и малоната (б) в активном центре сукцинатдегидрогеназы
Рис. 5-23. Связывание сукцината (а) и малоната (б) в активном центре сукцинатдегидрогеназы
Кинетически конкурентное ингибирование характеризуется увеличением Км при неизменном значении Vмакс (рис. 5-24).
 Рис. 5-24. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии возрастающих концентраций (I1 I2, I3) конкурентного ингибитора в координатах: а - v от [S]; б - 1/v от 1/[S]
Рис. 5-24. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии возрастающих концентраций (I1 I2, I3) конкурентного ингибитора в координатах: а - v от [S]; б - 1/v от 1/[S]
В случае ферментов с относительной субстратной специфичностью, катализирующих превращение нескольких субстратов, один субстрат может выступать в качестве ингибитора для другого субстрата.
Например, фермент алкогольдегидрогеназа может катализировать реакцию дегидрирования, как этилового спирта, так и метилового (рис. 5-25):
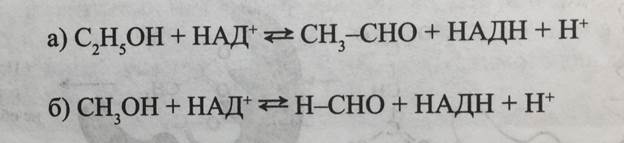 Рис. 5-25. Реакции дегидрирования алкогольдегидрогеназой этилового (а) и метилового спирта (б)
Рис. 5-25. Реакции дегидрирования алкогольдегидрогеназой этилового (а) и метилового спирта (б)
И если оба субстрата будут претендовать на активный центр алкогольдегидрогеназы, предпочтение будет отдано тому из них, концентрация которого будет больше. Иначе говоря, один субстрат будет выступать в качестве конкурентного ингибитора другого.
В записную книжку врача



 Рис. 5-23. Связывание сукцината (а) и малоната (б) в активном центре сукцинатдегидрогеназы
Рис. 5-23. Связывание сукцината (а) и малоната (б) в активном центре сукцинатдегидрогеназы Рис. 5-24. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии возрастающих концентраций (I1 I2, I3) конкурентного ингибитора в координатах: а - v от [S]; б - 1/v от 1/[S]
Рис. 5-24. Зависимость скорости ферментативной реакции от концентрации субстрата в присутствии возрастающих концентраций (I1 I2, I3) конкурентного ингибитора в координатах: а - v от [S]; б - 1/v от 1/[S]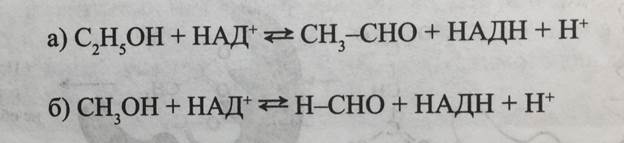 Рис. 5-25. Реакции дегидрирования алкогольдегидрогеназой этилового (а) и метилового спирта (б)
Рис. 5-25. Реакции дегидрирования алкогольдегидрогеназой этилового (а) и метилового спирта (б)


