

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...
Топ:
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Комплексной системы оценки состояния охраны труда на производственном объекте (КСОТ-П): Цели и задачи Комплексной системы оценки состояния охраны труда и определению факторов рисков по охране труда...
Проблема типологии научных революций: Глобальные научные революции и типы научной рациональности...
Интересное:
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Результат расчета (в частности, результат анализа) не может быть точнее, чем исходные данные; наоборот, ошибки всех исходных данных складываются по особым правилам [6, c.86-96, 10, с.137-141]. При этом важен как характер погрешностей (случайные или систематические), так и то, какие именно действия мы производили с исходными данными (приближенными величинами) в ходе расчетов. При умножении и делении приближенных величин складываются их относительные погрешности, а при сложении и вычитании приближенных величин следует учитывать абсолютные погрешности. Однако для простоты можно считать, что точность результата расчета W определяется лишь одним - наименее точным - слагаемым или сомножителем. При поиске такой величины следует сопоставлять либо абсолютные, либо относительные погрешности всех исходных данных: при сложении и вычитании наименее точным слагаемым (x) будет то, у которого самая большая абсолютная погрешность, тогда DW»Dх. При умножении или делении наименее точным сомножителем (x) будет тот, у которого самая большая относительная погрешность. В этом случае DW / W» D x / x.
На практике аналитики руководствуются следующими правилами округления результатов расчета:
при сложении и вычитании в результате расчета оставляют столько десятичных знаков, сколько их было в самом неточном слагаемом (примеры 4-5);
при умножении и делении произведение (частное) должно иметь столько же значащих цифр, сколько их в той из исходных величин, которая приведена с наименьшим числом значащих цифр (пример 6). «Излишне точные» по сравнению с другими сомножителями исходные данные иногда предварительно округляют.
Если в качестве сомножителей используются постоянные коэффициенты, не являющиеся результатом измерения и известные совершенно точно, то количество значащих цифр в таких коэффициентах не учитывают!
|
|
при извлечении корня и возведении в степень относительная погрешность, а значит, и число значащих цифр должны сохраняться. Следовательно 0,92 » 0,8, а не 0,81; 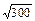 »17,3, но
»17,3, но  »2 и т.д.;
»2 и т.д.;
при логарифмировании и потенцировании в мантиссе должно быть столько значащих цифр, сколько их имеется в логарифмируемом числе, и наоборот (пример 7).
Во всех этих случаях округление результатов расчета до требуемой степени точности ведут по общепринятым правилам. Так, в зависимости от точности исходных данных число 4,6252 можно округлить до 4,63; 4,6 или до 5. При округлении очень больших или, наоборот, очень малых величин принято переходить к выражению числа W в виде произведения с участием сомножителя вида 10n, причем для W>>1 величина целочисленного показателя n положительна, а для W <<1 - отрицательна. Предэкспоненциальный множитель записывают так, чтобы до запятой была только одна значащая цифра, соответственно выбирают значение n. Так, при округлении числа 50822,346 до трех значащих цифр следует записать его в виде 5,08·104, а не 50,8· 103.
Вышеприведенные правила выполняются для каждой операции и в ходе многоступенчатых расчетов. При записи промежуточных результатов рекомендуется оставлять одну значащую цифру сверх точности исходных данных, а округлить до нужной степени только окончательный результат. Если последняя из сохраняемых цифр результата равна 1, 2 или 3, то стоит (особенно при умножении или делении) сохранить на одну цифру больше, чем позволяет точность исходных данных, такую цифру берут в скобки.
Работа с константами. В аналитической химии постоянно используются различные константы равновесий (ПР; Ка; Куст), в частности, для выбора аналитического реагента или подбора условий проведения анализа. Наиболее распространенным источником, в котором приведены константы равновесий, является справочник [8]. В этом и в других справочниках числовые значения некоторых констант не приводятся, а указываются либо их десятичные логарифмы, либо показатели рК = - lgК. Очевидно, значения констант легко вычисляются по логарифмам и показателям: К = 10 lgK = 10 -pK· Судить о точности константы следует не по общему числу значащих цифр в логарифме (показателе), а по числу десятичных знаков в нем (примеры 8-9).
|
|
Выражение констант через их показатели преимуществено применяется для очень малых констант (К << 1). Такие константы принято записывать в виде m· 10-n, где n - целое число. Очевидно, pK = - lgK = n - lgm.. Чем больше рК, тем меньше значение самой константы, в частности, увеличение рК на единицу соответствует падению самой константы на порядок, т.е. в 10 раз. Увеличение рКа соответствует переходу к более слабым кислотам, увеличение рПР - переходу к менее растворимым осадкам и т.д.
Всправочниках приводятся, как правило, значения констант, выраженных через равновесные активности реагентов (термодинамические константы, КТ). Использовать их без поправок можно при выполнении двух условий: а) ионная сила раствора, в котором устанавливается равновесие, близка к нулю, т.е. почти нет ионов; б) в растворе нет посторонних веществ, сдвигающих равновесие реакции, описываемой константой, т.е. не идут побочные реакции. Если не выполняется хотя бы одно из этих условий, расчет с применением КТ - термодинамических констант даст ошибки тем больше, чем больше ионная сила раствора и чем сильнее выражены побочные реакции. Поэтому для достижения точных результатов в расчетах вместо КТ следует использовать КС - концентрационные константы или Кусл - условные константы. Для пересчета констант (введения поправок) применяются известные формулы [10, c.9-14], а входящие в эти формулы значения коэффициентов активности или мольных долей можно найти в справочниках или вычислить самостоятельно для любых реальных условий. Некоторые поправки приведены и в приложениях к настоящему пособию.
Константы и поправки к ним обычно не удается измерить (вычислить) с большой точностью; как правило, в справочниках в предэкспоненциальной части любой константы имеется только две значащих цифры. Но расчеты с применением констант равновесий обычно и не требуют высокой точности, по ходу расчетов все исходные данные и результаты умножения (деления) можно округлить даже до одной значащей цифры.
|
|
Примеры решения типовых задач
1. Из бюретки на 25 мл с ценой деления 0,1 мл отмерили ровно восемь миллилитров раствора. Как правильно записать отмеренный объем: 8 мл; 8,0 мл; 8,00 мл? Как записать тот же объем, если для отмеривания раствора использовали цилиндр с ценой деления 1 мл?
Решение. Запись 8,00 мл, указывающая на абсолютную погрешность порядка 0,01 мл, совершенно неправильна. Так как цена деления бюретки равна 0,1 мл, абсолютная погрешность не может быть меньше. Если считать, что абсолютная погрешность соответствует цене деления, то правильный ответ при измерении объема бюреткой - 8,0 мл. При записи результата как «8 мл» мы, скорее всего, зря потеряем точность измерения, подобное округление не рекомендуется. А вот при измерении того же объема цилиндром эта запись будет совершенно верной.
2. С помощью той же бюретки, что и в предыдущем примере, ведут титрование, надеясь определить концентрацию некоторого вещества с относительной погрешностью в 0,01 %. Возможно ли это?
Решение. Будем считать, что абсолютная погрешность соответствует цене деления бюретки - 0,1 мл. Если будет израсходован весь объем бюретки (25,0 мл), то относительная погрешность окажется равной 0,4%; измерить же объем раствора точнее, т.е. с относительной погрешностью 0,1% (а тем более 0,01%!) при использовании данной бюретки нельзя. Нам не удастся снизить относительную погрешность до требуемой величины и в том случае, если мы будем с помощью этой бюретки отмерять объемы, большие 25 мл, поскольку повторное заполнение бюретки приведет к соответствующему увеличению абсолютной погрешности.
Поскольку нельзя измерить с требуемой точностью объем титранта, не удастся добиться и желаемой точности определения концентрации. Дело в том, что концентрацию находят, умножая объем титранта на другие величины, а при умножении величин относительные погрешности складываются; т.е. относительная погрешность произведения не может быть меньше погрешности сомножителя.
3. Расставьте несколько величин в порядке возрастания точности их измерения: 0,002 м3; 920; 2100; 8100г; 2,10 мл; 2100,0; 2,0·105 мин.
|
|
Решение. Поскольку величины имеют разную размерность, а некоторые из них безразмерны, то мы можем сравнивать их только по относительной погрешности, считая, что все величины записаны правильно. Вместо расчета относительной погрешности можно просто подсчитать число значащих цифр. Для большей наглядности составим таблицу.
| Результат измерения | Абсолютная погрешность | Относительная погрешность, % | Число значащих цифр |
| 0,002 м3 | ³0,001 м3 | ³50 | 1 |
| 920 | ³10 | ³1 | 2 |
| 2100 | ³1 | ³0,05 | 4 |
| 8100 г | ³1 г | ³0,01 | 4 |
| 2,10 мл | ³0,01 мл | ³0,5 | 3 |
| 2100,0 | ³0,1 | ³0,005 | 5 |
| 2,0·105 мин | ³0,1·105 мин | ³0,5 | 2 |
Следовательно, ряд должен быть составлен так: 0,002 м3; 2,0·105 мин; 920; 2,10 мл; 2100; 8100 г; 2100,0.
4. Масса анализируемого вещества определена на технических весах, она равна 25,6 г, а затем отобрали и взвесили на аналитических весах часть этой пробы: 0,2665 г. Вычислить оставшуюся массу пробы.
Решение. С точки зрения арифметики результат вычисления равен 25,3335 г. В этом случае получится, что точность наших знаний о массе пробы резко повысилась за счет арифметической операции, а это невозможно. Правильный результат - 25,3 г - получается путем округления. Тот же результат получится, если от 25,6 г отнять заранее округленную до десятых долей грамма массу отобранной части пробы, т.е. 0,3 г. В результате вычитания десятичных знаков столько же, сколько их в исходных данных, т.е. примерно та же абсолютная погрешность.
5. Масса тигля до прокаливания - 20,6473 г, после - 20,6420 г. Какова масса потерь при прокаливании, с какой относительной погрешностью она определена?
Решение. Масса потерь равна 20,6473 г - 20,6420 г = 0,0053 г, т.е. 5,3 мг. Относительная погрешность результата - около 2%, она гораздо больше, чем у исходных масс, хотя абсолютная погрешность примерно та же - 0,0001 г. Обратите внимание на этот пример: при сложении и вычитании число значащих цифр в результате может уменьшаться (или увеличиваться) по сравнению с исходными данными.
6. Масса жидкости 28,34 г, ее объем- 8,4 мл. Рассчитать плотность.
Решение. Для того чтобы найти плотность, надо разделить массу на объем. В результате деления надо оставить только две значащих цифры, как и в менее точном измерении объема. Отсюда 28,34 г: 8,4 мл = 3,4 г/мл. Нельзя просто переписывать результат, полученный на шкале микрокалькулятора, округление до необходимого количества значащих цифр обязательно!
7. Концентрация ионов водорода в растворе равна 2 М. Чему равен рН этого раствора (без учета коэффициентов активности)?
Решение. Так как рН =- lg[H+], а [Н+]=2, то следует взять логарифм этого числа. По микрокалькулятору он равен 0,30102999, по четырехзначным таблицам - 0,3010, по логарифмической линейке - 0,30. С учетом вышеизложенного правила lg2 надо округлить до одной значащей цифры, следовательно, рН = -0,3.
|
|
8. В справочнике указано значение константы ионизации (кислотной константы) синильной кислоты 5,0· 10-10, чему равен ее показатель?
Решение. По калькулятору логарифм вышеуказанного числа равен -9,3010299; следовательно, показатель равен 9,3010299. Округляем, оставляя две цифры в мантиссе (после запятой): рК = 9,30.
Пользуясь четырехзначными таблицами логарифмов, можно найти показатель несколько иначе: рК = m - lg n = 10 - lg 5,0 (10 - 0,70 = 9, 30. В последнем действии число 10 известно совершенно точно, число значащих цифр или десятичных знаков в подобных величинах вообще не учитывают!
Независимо от способа логарифмирования, в показателе константы после запятой (в мантиссе) оставляют столько значащих цифр, сколько их было в самой константе. Не следует считать, что рКа синильной кислоты составляет 9,3; отбрасывать ноль во втором знаке после запятой было бы грубой потерей точности.
9. Оцените погрешность, с которой в справочнике [8] указано значение константы устойчивости комплексного соединения бария с 8-оксихинолином.
Решение. В справочнике дана не константа, а ее логарифм, равный 2,07. Так как в мантиссе логарифма имелось две значащих цифры, столько же их будет в самой константе. Это соответствует диапазону относительной погрешности от 1 до 10 %.
Можно провести и более точный расчет. По калькулятору сама константа (антилогарифм) равна 117,48976. Но так как в мантиссе логарифма имелось две значащих цифры, значение константы также округляем до двух значащих цифр, тогда К = 1,2· 102. Относительная погрешность этой величины равна единице последнего разряда, деленной на само число (0,1/1,2), что составляет около 8 %.
Контрольные вопросы
1. Что такое абсолютная погрешность, относительная погрешность, в каких единицах они выражаются? Какие цифры называют значащими и как подсчитать их количество в некотором записанном числе - результате измерения?
2. С какой абсолютной и относительной погрешностью вы проводите обычно измерение объема раствора: а) с помощью мерной колбы на 200 мл; б) пипеткой на 5 мл, в) цилиндром на 1 литр? Насколько точно измерение массы анализируемой пробы на аналитических и на технических весах?
3. С какой относительной погрешностью вы знаете массу своего тела и свой рост? Какими факторами, по вашему мнению, определяется абсолютная погрешность этих данных: ценой деления измерительного прибора, его систематической погрешностью, случайными погрешностями в процессе измерения, изменением во времени самих измеряемых величин?
4. Обычно чем больше исходных данных приходится учитывать аналитику при расчете результата анализа, тем при прочих равных условиях хуже точность анализа. Почему?
5. C какой относительной погрешностью, судя по числу значащих цифр, известны молярные массы веществ? Учитывать ли их погрешность при расчете результатов анализа?
6. Сформулируйте известные вам по школьному курсу математики правила округления.
7. Запишите результат деления 1 на 300 с разной точностью – с одной, двумя и т.д. (до шести) значащими цифрами. Используйте запись вида m·10-n.
8. В таблице констант устойчивости комплексных соединений [8, с.328] для комплексов калия и кальция с этидендиаминтетрауксусной кислотой даны значения логарифмов констант, равные соответственно 0,96 и 10,59. Какая константа измерена с большей точностью? Ответ обоснуйте.
6.2. РАСЧЕТ ГЕТЕРОГЕННОГО РАВНОВЕСИЯ “ОСАДОК - РАСТВОР”
Практическое занятие № 2
Теоретические сведения
Расчет растворимости. Растворимость осадка АmВn, распадающегося на ионы
S = m+n 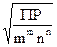 , (3)
, (3) 
где S - молярная концентрация вещества АmВn в насыщенном растворе; ПР - константа, называемая произведением растворимости (термодинамическая, концентрационная или условная, смотря по тому, для каких условий производится расчет). Избыток А или В извне не вводится, в противном случае формула (3) не подходит.
Растворимость осадка тем больше, чем больше ПР. Это положение строго выполняется для осадков с однотипной формулой, но может нарушаться при сравнении осадков различного типа, например АВ и АВ2. Для бинарного осадка АВ растворимость S равна 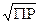 .
.
Произведение растворимости, как и другие константы, может выражаться через активности (ПРт), равновесные концентрации определенных ионов (ПРс) или через общие концентрации (суммарно для всех форм существования данного элемента в растворе). В последнем случае произведение растворимости называют условным и обозначают ПРусл. Перечисленные величины связаны:
ПРт = (а А)m · (а В)n (4)
ПРс = [А]m · [В]n = ПРт / ¦Am ¦Bn (5)
ПРусл = (Са)m · (СВ)n = ПРс / aAmaBn = ПРт / aАmaВn¦Am ¦Bn (6)
Для данного осадка в данном растворителе величина ПРт зависит только от температуры и является табличной величиной; величина ПРс зависит не только от температуры, но и от ионной силы; величина ПРусл зависит от температуры, ионной силы и концентрации посторонних веществ, реагирующих с А или В, а во многих случаях и от рН.
При расчете растворимости осадка в отсутствие посторонних электролитов («в чистой воде») ионную силу раствора упрощенно считают равной 0. В этом случае в формулу (3) подставляют значение ПР непосредственно из справочников (пример 1). Однако при расчете растворимости в присутствии посторонних электролитов такая подстановка приведет к ошибочному результату; действительная растворимость будет превышать вычисленную («солевой эффект») тем больше, чем выше будет ионная сила раствора. Для получения точных результатов надо заранее ввести поправку на ионную силу, т.е. вычислить величину ПРс по формуле (5), как в примере 2.
При расчете растворимости в присутствии веществ, которые могут вступать с А или В в побочные реакции, или при заданной величине рН в формулу (3) следует подставить величину ПРусл, предварительно вычисленную для конкретного раствора (с учетом значения рН, концентраций маскирующих веществ и т.д.) по формуле (6). Величины aА и aВ - мольные доли реакционноспособных форм А и В - рассчитывают самостоятельно (см. следующие разделы данного пособия) или используют справочные таблицы. Коэффициенты активности в формуле (6) обычно считают равными единице, так как влияние ионной силы значительно слабее, чем влияние рН (примеры 3-4) или маскирующих веществ (примеры 5-6)..
Частным случаем расчета растворимости по формуле (3) является вычисление рН насыщенных растворов малорастворимых гидроксидов (пример 7). Это значение определяется концентрацией одного из компонентов осадка (ионов ОН-) в насыщенном растворе Ме(ОН)n, а следовательно, растворимостью данного гидроксида. Из (3) следует[4][л1]:
[OH] = n S =  (7)
(7)
Очевидно, величина рН насыщенных растворов гидроксидов в отсутствие посторонних веществ тем выше, чем более растворимы эти гидроксиды. Малорастворимые же гидроксиды могут дать гораздо меньше ионов ОН-, чем процесс автопротолиза воды. В подобных случаях формула (7) приведет к ошибочным результатам расчета.
При расчете растворимости осадка в присутствии избытка одного из компонентов формула (3) не применима. В этом случае растворимость осадка определяется по концентрации другого компонента осадка в насыщенном растворе (примеры 8-9). Так, растворимость осадка АmВn при известной (избыточной) концентрации вещества В вычисляется по формуле:
 S =
S =  =
= 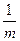
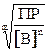 (8)
(8)
В подкоренное выражение в формуле (8) подставляют ПРт, ПРс, ПРусл в зависимости от ионной силы насыщенного раствора и возможности протекания в нем побочных процессов (протолиза, комплексообразования и т.п.). Для наиболее простого осадка АВ растворимость в присутствии известного избытка В и без учета ионной силы равна концентрации А, т.е. S = ПР / [B].
Частным случаем расчетов этого типа является расчет растворимости малорастворимых гидроксидов при заданном значении рН (пример 10).
Солевой эффект. Этим термином называют изменение свойств исследуемой системы в зависимости от ионной силы раствора. Чаще всего аналитику приходится рассматривать солевой эффект в процессах осаждения, в этом случае растворимость осадка возрастает (обычно в несколько раз) в присутствии посторонних инертных электролитов, особенно солей. Солевой эффект тем сильнее, чем выше концентрация присутствующих электролитов и чем выше заряды ионов, входящих в эти электролиты. Введение избытка осадителя или введение постороннего вещества-электролита, вызывающего побочные реакции протолиза или комплексообразования, также увеличивает ионную силу насыщенного раствора. Но в этих случаях солевой эффект мало заметен на фоне других, гораздо более сильных изменений растворимости.
При расчетах, связанных с солевым эффектом, надо уметь вычислять ионную силу раствора по обычной формуле:
I = 0,5·  , (9)
, (9)
где Сi и zi - молярная концентрация и заряд i-ого иона в растворе, а суммирование идет по всем ионам, которые присутствуют в растворе. По вычисленному значению ионной силы находят в справочнике [8] коэффициенты активности ионов, входящих в состав осадка, можно также воспользоваться приложением 1 к данному пособию или рассчитывать коэффициенты по уравнениям Дебая-Хюккеля. Далее эти коэффициенты используют для пересчета табличного значения ПР в реальное (концентрационное) произведение растворимости по формуле (5). Исправленное значение ПР при расчетах растворимости подставляют в формулы (3) или (8).
К действию посторонних электролитов особенно чувствительны осадки, содержащие многозарядные ионы, например фосфат кальция.
Влияние рН на растворимость. На растворимость осадков величина рН влияет в том случае, когда хотя бы один из ионов, входящих в состав осадка, может участвовать в побочной кислотно-основной реакции. Растворимость BaSO4 практически не зависит от рН, поскольку ни сульфаты, ни ионы бария при изменении рН не переходят в другие формы, а растворимость BaCO3 сильно возрастает по мере подкисления раствора за счет связывания карбонат-ионов в гидрокарбонаты и далее в угольную кислоту.
Для расчета растворимости при любом значении рН следует найти тот ион (их может быть и несколько), который входит в состав осадка и при этом участвует в побочной реакции, затем следует определить для данного рН значение a - мольной доли реакционноспособной формы этого иона (см. приложение 5 в настоящем пособии). Если соответствующей поправки там нет, вычислите ее самостоятельно, как описано в теоретическом введении к следующему практическому занятию. Табличное значение ПР осадка пересчитывается в ПРусл путем подстановки указанной поправки в формулу (6). Можно воспользоваться и логарифмическим вариантом формулы (6):
рПРусл = рПРт - m paA - n paB, (6а)
Получив условное произведение растворимости, вычисляют растворимость по формулам (3) или (8).
Влияние рН тем сильнее, чем более прочные частицы (слабые кислоты, устойчивые гидроксокомплексы и т.п.) образуются в ходе побочной кислотно-основной реакции. Нередко растворимость меняется в 10 и даже в 100 раз при изменении рН на единицу. Обычно растворимость солей возрастает по мере перехода от нейтральных к сильнокислым средам, а для некоторых осадков - и в сильнощелочных средах, из-за образования гидроксокомплексов.
Влияние маскирующих веществ. Растворимость очень сильно зависит от присутствия и концентрации тех веществ, которые могут давать прочные комплексные соединения хотя бы с одним из ионов, входящих в состав осадка. При увеличении концентрации таких веществ на 1 порядок (в 10 раз) растворимость может возрасти на несколько порядков, т.е. в 100, 1000 и т.д. раз. Чем прочнее комплексы, которые образуют с ионом осадка маскирующие вещества, и чем больше частиц маскирующего вещества входит в такой комплекс, тем сильнее сдвигается равновесие растворимости, вплоть до того, что осадок может полностью раствориться (или не выпадать при введении осадителя). Для решения соответствующих задач понадобится вначале найти поправку a с учетом природы и концентрации маскирующего вещества (см. приложение 6) или рассчитать ее по формулам ступенчатого комплексообразования. Затем, как и при оценке влияния рН, рассчитывают величину ПРусл по формулам (6) или (6а) и, наконец, рассчитывают растворимость по формулам (3) или (8).
|
|
|

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Двойное оплодотворение у цветковых растений: Оплодотворение - это процесс слияния мужской и женской половых клеток с образованием зиготы...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!