Система оценивания
Система оценивания строится на поэлементном анализе возможного решения участником задачи. Следует обратить внимание, что в материалах представленные решения отражают один из вероятных подходов к решению задачи. Поэтому при проверке работ члены жюри должны учитывать, что участник может прийти к ответу другим путем. При оценивании работ участников максимальный балл ставится за полностью выполненное задание, независимо от способа решения.
В каждом задании баллы выставляются за каждый элемент (шаг) решения. Причем балл за один шаг решения может варьироваться от 0 (решение соответствующего элемента отсутствует или выполнено полностью неверно) до максимально возможного балла за данный шаг. Если есть отдельные верно выполненные части решения элемента, оценка лежит от нуля до максимального балла.
Баллы за правильно выполненные элементы решения суммируются.
Шаги, демонстрирующие умение логически рассуждать, творчески мыслить, проявлять интуицию оцениваются выше, чем те, в которых показаны более простые умения, владение формальными знаниями, выполнение тривиальных расчетов и др.
Школьный этап Всероссийской олимпиады школьников по химии в Иловлинском муниципальном районе в 2015/2016 учебном году
Ответы и решения - 8 класс
1. Названия некоторых химических элементов входят в состав часто употребляемых словосочетаний, многие из которых пришли из литературных произведений. Определи эти элементы и запиши для них: а) символ; б) порядковый номер; в) относительную атомную массу; г) положение в Периодической системе; д) приведите формулы химических соединений, содержащие эти элементы.
1)... солдатик; 2) … леди; 3)... лихорадка; 4) … тучи; 5) … коктейль; 6) … бомба; 7) … лампа; 8) … муки; 9) хозяйка ….. горы; 10) … блондинка
Оловянный (Sn) солдатик (№ 50; 119; 5 период,IVA)
Железная (Fe) леди (№ 26; 56; 4 период,VIIIB)
Золотая (Au) лихорадка (№ 79; 197; 6 период,IB)
Свинцовые (Pb) тучи (№ 82; 207; 6 период,IVA)
Кислородный (О) коктейль (№ 8; 16; 2 период, VIA)
Водородная (Н) бомба (№ 1; 1; 1 период, IA)
Неоновая (Ne) лампа (№ 10; 20; 2 период, VIIIA)
Танталовы (Та) муки (№ 73; 181, 6 период,VВ)
Хозяйка медной (Cu) горы (№ 29; 64; 4 период, IВ)
Платиновая (Pt) блондинка (№ 78; 195; 6 период, VIIIB)
За каждый ответ 0,5 балла.
Итого: 20 баллов (а-г) + дополнительно по 0,5 б за каждое правильно записанное соединение в п. д)
2. Чтобы Золушка не смогла поехать на бал, мачеха придумала ей работу: она смешала соль с мелкими гвоздями, деревянными стружками и речным песком и велела Золушке очистить соль, а гвозди сложить в отдельную коробку. Золушка быстро справилась с заданием и успела поехать на бал. Объясните, как можно быстро выполнить задание мачехи.
| 1.
| Действие магнитом (железные гвозди).
| 1 балл
|
| 2.
| Растворение в воде, фильтрование (деревянные опилки, речной песок)
| 1 балл
|
| 3.
| Выпаривание раствора
| 1 балл
|
|
| Итого
| 3балла
|
3. Юный химик составил список химических явлений, которые можно наблюдать на кухне, однако, он включил в список физические явления. Укажите их.
А) гашение соды уксусом при приготовлении теста; Б) растворение сахара в воде; В) прокисание молока; Г) брожение сока; Д) плавление сливочного масла на горячей сковородке; Е) заваривание чая.
За каждый правильный ответ 1 балл: б), д), е).
Итого: 3 балла.
4. Лесные звери варили клюквенный компот. Клюквенный отвар получился очень кислым, пришлось добавлять сахар. В 4 кг отвара медведь высыпал пакет (1 кг) сахара, барсук - 1 стакан (200 г) сахара, заяц – 5 столовых ложек (по 15 г), белочка и ёжик – по 10 чайных ложек (5 г). Определите массовую долю сахара в полученном компоте.
Баллов
1.Найдена масса раствора: m(раствора) = 4 + 1 + 0,2 + (5∙0,015) + (20∙0,005) = 5,375 кг
(3 балла)
2. Найдена масса сахара: m(сахара) = 1 + 0,2 + (5∙0,015) + (20∙0,005) = 1,375 кг (3 балла)
3) Найдена массовая доля сахара в полученном растворе: W = 1,375/5,375 = 0,2558 или 25,58% (3 балла)
5. Даны формулы оксидов азота: N 2O - оксид азота (I); NO - оксид азота (II); N 2O3 - оксид азота (III); NO2 - оксид азота (IV); N 2O5 - оксид азота (V)
Определите, в каком из этих соединений содержание азота наибольшее. Ответ округлите до десятых.
N 2O: Мr=44; w(N)=63,6% (0,5 + 0,5 =1 балл)
NO: Мr=30; w(N)=46,7% (0,5 + 0,5 =1 балл)
N 2O3: Мr=76; w(N)=36,8% (0,5 + 0,5 =1 балл)
NO2: Мr=46; w(N)=30,4% (0,5 + 0,5 =1 балл)
N 2O5: Мr=108; w(N)=25,9% (0,5 + 0,5 =1 балл)
+ 1 балл за указанное вещество N 2O - оксид азота (I)
Итого: 6 баллов
Ответы и решения - 9 класс
Задача 9-1
Вселенная — это разнообразие в единстве.
Оноре де Бальзак
Бедному А совсем неудобно в своей квартире: сверху его грозиться сжечь Б, справа – отравить ядовитый Д, а живущий слева тихий Е иногда начинает буянить и совсем не ясно, что от него ждать – либо отравит, либо подожжет квартиру. Но когда Е успокаивается, то начинает светиться бледно-зеленым светом и всех радует. Задание: Определите, кто такие А, Б, Д, Е?
Определены элементы А, Б, Д, Е: А – сера, Б – кислород, Д – хлор, Е - фосфор (2 балла)
Задача 9-2
Всё хорошо, что в меру.
Гиппократ
Отрывок из повести Хаггарда “Жемчужина Нила”: “Она вынула из уха одну из тех огромных жемчужин … и …опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев, наблюдали, как жемчужина медленно растворяется в крепком уксусе. Вот от нее не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая уксус, и выпила весь до последней капли”.
Объясните, почему Клеопатра смогла выпить “крепкий уксус”, а также предположите, к каким классам соединений относятся вещества входящие в состав жемчужины и уксуса, запишите уравнение происходящей реакции в сокращенном ионном виде.
Задача 9-3
Найдите соответствие между оксидом и соответствующим гидроксидом:
А. CrO3
Б. CrO
В. Cr2O3
Г. CrO2
1. Cr(OH)2
2. Cr(OH)3
3. H2CrO4
4. H2CrO3
А) А3 Б1 В2 Г4; В) А4 Б1 В2 Г3; С) А3 Б1 В4 Г2; D) А4 Б3 В1 Г2
Ответ: А) (2 балла)
Задача 9-4
Составьте уравнения реакций к цепочке реакций: Fe0 → Fe+2 → Fe+3 → Fe+2 → Fe0 → Fe+
Всего: 5 баллов
Задача 9-5
Какие из ионов не могут находиться в одном растворе? Почему? Ba 2+; H+; CL–; OH–; SO42-.
Ответ подтвердите ионными уравнениями. Запишите не менее двух молекулярных уравнений, соответствующих вашим сокращённым ионным уравнениям.
В одном растворе не могут находиться ионы:
а) Ba2+ + SO42-= BaSO4↓. Это приводит к образованию осадка 1 балл
BaCL2 + H2SO4 = BaSO4↓ + 2 HCL 0,5 балла
Ba(NO3)2 + Na2SO4 = BaSO4↓ + 2 NaNO3 0,5 балла
б) Н+ + ОН - = Н2О 1 балл
HCL + NaOH = NaCL + H2O 0,5 балла
HNO3 + KOH = KNO3 + H2O 0,5 балла
(4 балла)
Задача 9-6
50 г смеси карбонатов бария и натрия растворили в избытке соляной кислоты. Добавление к полученному в результате реакций раствору избытка раствора сульфата натрия приводит к выпадению 46,6 г осадка. Напишите уравнения протекающих реакций и определите массовые доли (в %) карбонатов в смеси.
Уравнения протекающих реакций:
BaCO3 + 2HCl = BaCl2 + CO2 + H2O (1) 1 балл
Na2CO3 + 2HCl = 2NaCl + CO2 + H2O (2) 1 балл
BaCl2 + Na2SO4 = BaSO4 + 2NaCl (3) 1 балл
Всего 7 баллов
Итого: 23 балла
Ответы и решения - 10 класс
1. Рассчитайте массовую долю углерода в молекулах: а) этана; б) этилена; в) ацетилена. Каков характер пламени при горении этих веществ? Составьте уравнения реакций горения данных веществ. (7 баллов)
Решение:
1. Рассчитаны Mr данных веществ: а) 30; б) 28; в)26 (по 0,5 балла - 1,5 б)
2. Рассчитаны массовые доли углерода в данных соединениях: а) 80%; б) 86%; в) 92% (по 0,5 балла - 1,5б.)
3. Объяснена причина: чем выше содержание углерода в соединении, тем пламя больше коптящее. (1 балл)
4. Составлены уравнения реакций горения данных веществ:
· 2C2H6 + 7O2 = 4CO2 + 6H2O (1 балл)
· C2H4 + 3O2 = 2CO2 + 2H2O (1 балл)
· 2C2H2 + 5O2 = 4CO2 + 2H2O (1 балл)
Итого: 7 баллов
2. Запишите уравнения реакций, при помощи которых можно осуществить следующие превращения: (6 баллов)




 CaCO3 CaO CaC2 C2H2 CH2=CHCl (-CH2 - CHCl -)n
CaCO3 CaO CaC2 C2H2 CH2=CHCl (-CH2 - CHCl -)n
Решение
Записаны пять уравнений реакций, по 1 баллу за каждую реакцию, за вторую реакцию - 2 б., т.к. данная реакция не рассматривается в школьном курсе. Всего 6 баллов.


 1. CaCO3 CaO + CO2 (1 балл)
1. CaCO3 CaO + CO2 (1 балл)
2. CaO + 3C = CaC2 + CO (2 балла)
 3. CaC2 + 2H2O C2H2 + Ca(OH)2 (1 балл)
3. CaC2 + 2H2O C2H2 + Ca(OH)2 (1 балл)
 4. C2H2 + HCl CH2=CHCl (1 балл)
4. C2H2 + HCl CH2=CHCl (1 балл)
 5.... + CH2=CHCl + CH2=CHCl +... (-CH2 - CHCl -)n (1 балл)
5.... + CH2=CHCl + CH2=CHCl +... (-CH2 - CHCl -)n (1 балл)
Итого: 6 баллов
3. Составьте формулы и дайте названия по систематической номенклатуре ИЮПАК пяти изомеров С6Н14. (5 баллов)
Решение:
Записаны формулы пяти изомеров (по 0,5 б. за каждый - итого 2,5 б.) и даны названия (по 0,5 б. за каждое - итого 2,5 б.)
Всего: 5 баллов
4. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
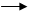 HI + H2SO4 I2 + H2S + H2O
HI + H2SO4 I2 + H2S + H2O
Определите окислитель и восстановитель. (3 балла)
Решение:
 1. Составлен электронный баланс
1. Составлен электронный баланс
 1 S+6 + 8e S-2
1 S+6 + 8e S-2
 4 2I-1 - 2e I20 (1 балл)
4 2I-1 - 2e I20 (1 балл)
2. Расставлены коэффициенты в уравнении реакции:
 8HI + H2SO4 4I2 + H2S + 4H2O
8HI + H2SO4 4I2 + H2S + 4H2O
3. Указано, что сера в степени окисления +6 является окислителем, а йод в степени окисления -1 - восстановителем.
5. Учащимся для проведения опыта были выданы кристаллы соли белого цвета, которые при стоянии на воздухе изменяют окраску на голубую. Известно, что при разложении выданной соли путем нагревания образуется оксид металла чёрного цвета и ядовитый газ бурого цвета. Добавление к раствору выданной соли раствора гидроксида калия привело к образованию студенистого осадка голубого цвета.
Запишите химическую формулу и название выданной соли. Составьте два молекулярных уравнения реакций, соответствующих опытам, проведённым учащимися в процессе исследовании соли. Для второй реакции запишите полные и сокращённые ионные уравнения. (5 баллов)
Решение
1. Cu(NO3)2 - нитрат меди (II) - 1 балл
2. Составлены два уравнения реакции:
t0
 2 Cu(NO3)2 2CuO + 4NO2 + O2 - 1 балл
2 Cu(NO3)2 2CuO + 4NO2 + O2 - 1 балл
Cu(NO3)2 + 2KOH = Cu(OH)2 + 2KNO3 - 1 балл
3. Записаны полные и сокращённые ионные уравнения для второй реакции- по1 баллу (2 б.)
Итого: 5 баллов
6. В лаборатории устанавливали состав газообразного органического соединения. Для анализа был взят образец объемом 448 мл (н.у.) и массой 1,16 г. Продукты сгорания этого образца полностью поглотились при последовательном пропускании их через трубку с оксидом фосфора(V) и концентрированным раствором гидроксида калия. Масса трубок увеличилась соответственно на 1,8 г и 3,52 г.
А. Какие выводы исследователи могут сделать на основании анализа результатов исследования?
Б. Какое соединение изучали в лаборатории? Выводы подтвердите соответствующими расчетами.
В. Напишите уравнения всех химических реакций, упомянутых в задаче.
Г. Имеет ли искомое соединение изомеры? Если имеет, то напишите их структурные формулы и назовите по систематической номенклатуре.
Решение
А. На основании анализа результатов исследования можно предположить:
- Соединение органическое, следовательно, в его составе есть углерод, а в продуктах горения есть углекислый газ, поглощаемый в эксперименте щелочью. Масса углекислого газа будет равна приросту массы склянки со щелочью.
- Вторым продуктом реакции горения является вода, так как происходит увеличение массы трубки с оксидом фосфора(V), активно поглощающего воду. Масса воды будет равна приросту массы трубки с оксидом фосфора(V).
- В итоге можно сказать, что в состав искомого соединения входят углерод, водород и, возможно, кислород. Последнее можно доказать с помощью расчетов.
Балла
Б. уравнение реакции горения искомого соединения в общем виде:
448 мл (н.у.); 1,16 г 3,52 г 1,8 г
 CxHy(Oz) + O2 CO2 + H2O
CxHy(Oz) + O2 CO2 + H2O
n(CxHy(Oz)) = 0,448 / 22,4 = 0,02 моль
М(CxHy(Oz)) = 1,16: 0,02 = 58 г/моль
n(CO2) = 3,52 /44 = 0,08 моль
n(H2O) = 1,8 / 18 = 0,10 моль
Расчет количества вещества и массы углерода, водорода, (кислорода) в исходном веществе
n(C) = n(CO2) = 0,08 моль; m(C) = 0,08 × 12 = 0,96 г
n(Н) = n(H2O) × 2 = 0,2 моль; m(Н) = 0,2 × 1 = 0,20 г
m(C) + m(Н) = 0,96 г + 0,20 г = 1,16 г
m(CxHy(Oz)) по условию задачи равна 1,16 г, следовательно, кислорода в исходном соединении нет. Его формулу можно представить так - CxHy
Его формулу можно представить так - CxHy
Нахождение простейшей формулы этого вещества
x: y = n(C): n(Н) = 0,08: 0,20 = 1: 2,5
М(CH2,5) = 14,5 г/моль
M(CxHy) /M(CH2,5) =58/14,5 = 4
Истинная формула искомого соединения C4H10
Балла
В. Уравнение реакции горения бутана
C4H10 + 6,5 O2 = 4 CO2 + 5 H2O
Уравнение реакции взаимодействия углекислого газа со щелочью
2 NaOH + CO2 = Na2CO3 + H2O
Уравнения реакции взаимодействия воды с оксидом фосфора(V)
P2O5 + H2O = 2 HPO3 метафосфорная кислота
P2O5 + 2 H2O = 2 H3PO4 ортофосфорная кислота
P2O5 + 3 H2O = H4P2O7 пирофосфорная кислота
В зависимости от условий образуются разные фосфорные кислоты.
Балла
Г. Бутан имеет два изомера (н-бутан и метилпропан).
Балл
Всего: 10 баллов
Ответы и решения - 11 класс
Задача 1. Для ухода за кожей рук рекомендуют использовать эмульсионные кремы на основе вазелинового масла, в которых содержится до 14% пчелиного воска, около 35% воды, 1% тетрабората натрия Nа2B4O7 и другие вещества. Для приготовления такого крема используют кристаллогидрат тетрабората натрия. Рассчитайте массу декагидрата тетрабората натрия, который требуется для приготовления 60 г такого крема.
Решение
М(Na2B4O7)=202 г/моль 2 балла
М(Na2B4O7*10H2O)=382 г/моль 2 балла
Масса тетрабората натрия в 60 г крема
m(Na2B4O7)= 0,01 * 60 г = 0,6 г 2 балла
m(соли)/M(соли) = m(кристаллогидрата)/M(кристаллогидрата)
0,6:202=x:382 2 балла
х=1,13 г 2 балла
Всего 10 баллов
Задача 2. Восстановите левую или правую часть уравнений следующих химических реакций
1) … → MnBr2 + Br2 + 2H2O
2) … → 2CaCO3↓ + 2H2O
3) … → 4Fe(OH)3↓ + 4Na2SO4
4) CuS + 4H2O2 → …
5) 6HNO3 + P2O5 → …
Решение
1) MnO2 + 4HBr = MnBr2 + Br2 + 2H2O
2) Ca(OH)2 + Ca(HCO3)2 = 2 CaCO3↓ + 2H2O
3) 4FeSO4 + 8NaOH + O2 + 2H2O = 4Fe(OH)3↓ + 4Na2SO4
4) CuS + 4H2O2 = CuSO4 + 4H2O
5) 6HNO3 + P2O5 = 3N2O5 + 2H3PO4
Всего: 10 баллов
Задача 3. В лаборатории устанавливали состав газообразного органического соединения. Для анализа был взят образец объемом 448 мл (н.у.) и массой 1,16 г. Продукты сгорания этого образца полностью поглотились при последовательном пропускании их через трубку с оксидом фосфора(V) и концентрированным раствором гидроксида калия. Масса трубок увеличилась соответственно на 1,8 г и 3,52 г.
А. Какие выводы исследователи могут сделать на основании анализа результатов исследования?
Б. Какое соединение изучали в лаборатории? Выводы подтвердите соответствующими расчетами.
В. Напишите уравнения всех химических реакций, упомянутых в задаче.
Г. Имеет ли искомое соединение изомеры? Если имеет, то напишите их структурные формулы и назовите по систематической номенклатуре.
Решение
А. На основании анализа результатов исследования можно предположить:
- Соединение органическое, следовательно, в его составе есть углерод, а в продуктах горения есть углекислый газ, поглощаемый в эксперименте щелочью. Масса углекислого газа будет равна приросту массы склянки со щелочью.
- Вторым продуктом реакции горения является вода, так как происходит увеличение массы трубки с оксидом фосфора(V), активно поглощающего воду. Масса воды будет равна приросту массы трубки с оксидом фосфора(V).
- В итоге можно сказать, что в состав искомого соединения входят углерод, водород и, возможно, кислород. Последнее можно доказать с помощью расчетов.
Балла
Б. уравнение реакции горения искомого соединения в общем виде:
448 мл (н.у.); 1,16 г 3,52 г 1,8 г
 CxHy(Oz) + O2 CO2 + H2O
CxHy(Oz) + O2 CO2 + H2O
n(CxHy(Oz)) = 0,448 / 22,4 = 0,02 моль
М(CxHy(Oz)) = 1,16: 0,02 = 58 г/моль
n(CO2) = 3,52 /44 = 0,08 моль
n(H2O) = 1,8 / 18 = 0,10 моль
Расчет количества вещества и массы углерода, водорода, (кислорода) в исходном веществе
n(C) = n(CO2) = 0,08 моль; m(C) = 0,08 × 12 = 0,96 г
n(Н) = n(H2O) × 2 = 0,2 моль; m(Н) = 0,2 × 1 = 0,20 г
m(C) + m(Н) = 0,96 г + 0,20 г = 1,16 г
m(CxHy(Oz)) по условию задачи равна 1,16 г, следовательно, кислорода в исходном соединении нет. Его формулу можно представить так - CxHy
Его формулу можно представить так - CxHy
Нахождение простейшей формулы этого вещества
x: y = n(C): n(Н) = 0,08: 0,20 = 1: 2,5
М(CH2,5) = 14,5 г/моль
M(CxHy) /M(CH2,5) =58/14,5 = 4
Истинная формула искомого соединения C4H10
Балла
В. Уравнение реакции горения бутана
C4H10 + 6,5 O2 = 4 CO2 + 5 H2O
Уравнение реакции взаимодействия углекислого газа со щелочью
2 NaOH + CO2 = Na2CO3 + H2O
Уравнения реакции взаимодействия воды с оксидом фосфора(V)
P2O5 + H2O = 2 HPO3 метафосфорная кислота
P2O5 + 2 H2O = 2 H3PO4 ортофосфорная кислота
P2O5 + 3 H2O = H4P2O7 пирофосфорная кислота
В зависимости от условий образуются разные фосфорные кислоты.
Балла
Г. Бутан имеет два изомера (н-бутан и метилпропан).
Балл
Всего: 10 баллов
Задача 4. Избыток сернистого ангидрида пропустили через раствор перманганата калия. Образовался раствор серной кислоты с концентрацией 4,9 %. Определите концентрацию исходного раствора перманганата.
Решение
Уравнение реакции:
5SO2 + 2KMnO4 + 2H2O = 2MnSO4 + K2SO4 + 2H2SO4 2 балла
ω(KMnO4) = m(KMnO4)/[mр-ра(H2SO4) – m(SO2)]
Пусть mр-ра(H2SO4) = 100 г, тогда
а) m(H2SO4) = 4,9 г; v (H2SO4) = 4,9/98 = 0,05 моль 2 балла
б) по уравнению реакции v (SO2): v (KMnO4): v (H2SO4) = 5:2:2
следовательно, прореагировало 0,02 моль KMnO4 и 0,05 моль SO2 2 балла
в) m(KMnO4) = 0,02·151 = 3,02 г; m(SO2) = 0,05·64 = 3,2 г 2 балла
ω(KMnO4) = 3,02/(100-3,2) = 0,0312 или 3,12 % 2 балла
Итого 10 баллов
Задача 5. В представленной схеме превращений вещество А относится к гомологическому ряду бензола и является монозамещенным производным. Массовая доля углерода в этом углеводороде равна 90,57 %, а его молярная масса не превышает 110 г/моль.
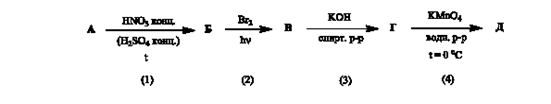
А. Установите структурную формулу вещества А.
Б. Напишите уравнения химических реакций в соответствии со схемой.
В. Назовите вещества А-Е.
Решение
А. Установление формулы вещества А.
Допустим, что масса вещества А равна 100 г. Тогда m(C)= 90,57 г, а m(Н)=9,43 г.
x: y = n(C): n(H) = (90,57/12): (9,43/1) = 7,5475: 9,43 = 1: 1,25
Так как искомое соединение относится к гомологическому ряду бензола, х ≥ 7
Если х =7, то у =8,75, такое соединение не существует.
При х =8, у =10, что соответствует формуле С8Н10. М(С8Н10)=106 г/моль.
Формуле С8Н10 соответствуют 4 соединения: этилбензол или о-, (м-), (п)- ксилолы. Но к условиям заданной цепочки превращений подходит только этилбензол.
Балла
Б.
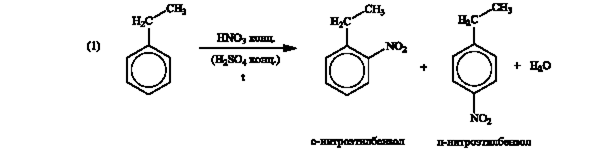
Далее целесообразно продолжать «цепочку» только с одним изомером нитроэтилбензола.
Всего: 10 баллов
Система оценивания
Система оценивания строится на поэлементном анализе возможного решения участником задачи. Следует обратить внимание, что в материалах представленные решения отражают один из вероятных подходов к решению задачи. Поэтому при проверке работ члены жюри должны учитывать, что участник может прийти к ответу другим путем. При оценивании работ участников максимальный балл ставится за полностью выполненное задание, независимо от способа решения.
В каждом задании баллы выставляются за каждый элемент (шаг) решения. Причем балл за один шаг решения может варьироваться от 0 (решение соответствующего элемента отсутствует или выполнено полностью неверно) до максимально возможного балла за данный шаг. Если есть отдельные верно выполненные части решения элемента, оценка лежит от нуля до максимального балла.
Баллы за правильно выполненные элементы решения суммируются.
Шаги, демонстрирующие умение логически рассуждать, творчески мыслить, проявлять интуицию оцениваются выше, чем те, в которых показаны более простые умения, владение формальными знаниями, выполнение тривиальных расчетов и др.
Школьный этап Всероссийской олимпиады школьников по химии в Иловлинском муниципальном районе в 2015/2016 учебном году
Ответы и решения - 8 класс
1. Названия некоторых химических элементов входят в состав часто употребляемых словосочетаний, многие из которых пришли из литературных произведений. Определи эти элементы и запиши для них: а) символ; б) порядковый номер; в) относительную атомную массу; г) положение в Периодической системе; д) приведите формулы химических соединений, содержащие эти элементы.
1)... солдатик; 2) … леди; 3)... лихорадка; 4) … тучи; 5) … коктейль; 6) … бомба; 7) … лампа; 8) … муки; 9) хозяйка ….. горы; 10) … блондинка
Оловянный (Sn) солдатик (№ 50; 119; 5 период,IVA)
Железная (Fe) леди (№ 26; 56; 4 период,VIIIB)
Золотая (Au) лихорадка (№ 79; 197; 6 период,IB)
Свинцовые (Pb) тучи (№ 82; 207; 6 период,IVA)
Кислородный (О) коктейль (№ 8; 16; 2 период, VIA)
Водородная (Н) бомба (№ 1; 1; 1 период, IA)
Неоновая (Ne) лампа (№ 10; 20; 2 период, VIIIA)
Танталовы (Та) муки (№ 73; 181, 6 период,VВ)
Хозяйка медной (Cu) горы (№ 29; 64; 4 период, IВ)
Платиновая (Pt) блондинка (№ 78; 195; 6 период, VIIIB)
За каждый ответ 0,5 балла.
Итого: 20 баллов (а-г) + дополнительно по 0,5 б за каждое правильно записанное соединение в п. д)
2. Чтобы Золушка не смогла поехать на бал, мачеха придумала ей работу: она смешала соль с мелкими гвоздями, деревянными стружками и речным песком и велела Золушке очистить соль, а гвозди сложить в отдельную коробку. Золушка быстро справилась с заданием и успела поехать на бал. Объясните, как можно быстро выполнить задание мачехи.
| 1.
| Действие магнитом (железные гвозди).
| 1 балл
|
| 2.
| Растворение в воде, фильтрование (деревянные опилки, речной песок)
| 1 балл
|
| 3.
| Выпаривание раствора
| 1 балл
|
|
| Итого
| 3балла
|
3. Юный химик составил список химических явлений, которые можно наблюдать на кухне, однако, он включил в список физические явления. Укажите их.
А) гашение соды уксусом при приготовлении теста; Б) растворение сахара в воде; В) прокисание молока; Г) брожение сока; Д) плавление сливочного масла на горячей сковородке; Е) заваривание чая.
За каждый правильный ответ 1 балл: б), д), е).
Итого: 3 балла.
4. Лесные звери варили клюквенный компот. Клюквенный отвар получился очень кислым, пришлось добавлять сахар. В 4 кг отвара медведь высыпал пакет (1 кг) сахара, барсук - 1 стакан (200 г) сахара, заяц – 5 столовых ложек (по 15 г), белочка и ёжик – по 10 чайных ложек (5 г). Определите массовую долю сахара в полученном компоте.
Баллов
1.Найдена масса раствора: m(раствора) = 4 + 1 + 0,2 + (5∙0,015) + (20∙0,005) = 5,375 кг
(3 балла)
2. Найдена масса сахара: m(сахара) = 1 + 0,2 + (5∙0,015) + (20∙0,005) = 1,375 кг (3 балла)
3) Найдена массовая доля сахара в полученном растворе: W = 1,375/5,375 = 0,2558 или 25,58% (3 балла)
5. Даны формулы оксидов азота: N 2O - оксид азота (I); NO - оксид азота (II); N 2O3 - оксид азота (III); NO2 - оксид азота (IV); N 2O5 - оксид азота (V)
Определите, в каком из этих соединений содержание азота наибольшее. Ответ округлите до десятых.
N 2O: Мr=44; w(N)=63,6% (0,5 + 0,5 =1 балл)
NO: Мr=30; w(N)=46,7% (0,5 + 0,5 =1 балл)
N 2O3: Мr=76; w(N)=36,8% (0,5 + 0,5 =1 балл)
NO2: Мr=46; w(N)=30,4% (0,5 + 0,5 =1 балл)
N 2O5: Мr=108; w(N)=25,9% (0,5 + 0,5 =1 балл)
+ 1 балл за указанное вещество N 2O - оксид азота (I)
Итого: 6 баллов
Ответы и решения - 9 класс
Задача 9-1
Вселенная — это разнообразие в единстве.
Оноре де Бальзак
Бедному А совсем неудобно в своей квартире: сверху его грозиться сжечь Б, справа – отравить ядовитый Д, а живущий слева тихий Е иногда начинает буянить и совсем не ясно, что от него ждать – либо отравит, либо подожжет квартиру. Но когда Е успокаивается, то начинает светиться бледно-зеленым светом и всех радует. Задание: Определите, кто такие А, Б, Д, Е?
Определены элементы А, Б, Д, Е: А – сера, Б – кислород, Д – хлор, Е - фосфор (2 балла)
Задача 9-2
Всё хорошо, что в меру.
Гиппократ
Отрывок из повести Хаггарда “Жемчужина Нила”: “Она вынула из уха одну из тех огромных жемчужин … и …опустила жемчужину в уксус. Наступило молчание, потрясенные гости, замерев, наблюдали, как жемчужина медленно растворяется в крепком уксусе. Вот от нее не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая уксус, и выпила весь до последней капли”.
Объясните, почему Клеопатра смогла выпить “крепкий уксус”, а также предположите, к каким классам соединений относятся вещества входящие в состав жемчужины и уксуса, запишите уравнение происходящей реакции в сокращенном ионном виде.
Произошла химическая реакция – образовались другие вещества 1 балл







 CaCO3 CaO CaC2 C2H2 CH2=CHCl (-CH2 - CHCl -)n
CaCO3 CaO CaC2 C2H2 CH2=CHCl (-CH2 - CHCl -)n

 1. CaCO3 CaO + CO2 (1 балл)
1. CaCO3 CaO + CO2 (1 балл) 3. CaC2 + 2H2O C2H2 + Ca(OH)2 (1 балл)
3. CaC2 + 2H2O C2H2 + Ca(OH)2 (1 балл) 4. C2H2 + HCl CH2=CHCl (1 балл)
4. C2H2 + HCl CH2=CHCl (1 балл) 5.... + CH2=CHCl + CH2=CHCl +... (-CH2 - CHCl -)n (1 балл)
5.... + CH2=CHCl + CH2=CHCl +... (-CH2 - CHCl -)n (1 балл) HI + H2SO4 I2 + H2S + H2O
HI + H2SO4 I2 + H2S + H2O 1. Составлен электронный баланс
1. Составлен электронный баланс 1 S+6 + 8e S-2
1 S+6 + 8e S-2 4 2I-1 - 2e I20 (1 балл)
4 2I-1 - 2e I20 (1 балл) 8HI + H2SO4 4I2 + H2S + 4H2O
8HI + H2SO4 4I2 + H2S + 4H2O 2 Cu(NO3)2 2CuO + 4NO2 + O2 - 1 балл
2 Cu(NO3)2 2CuO + 4NO2 + O2 - 1 балл CxHy(Oz) + O2 CO2 + H2O
CxHy(Oz) + O2 CO2 + H2O 





