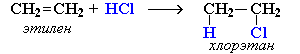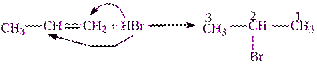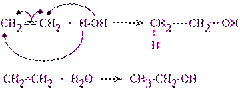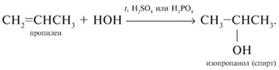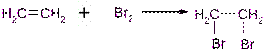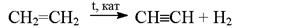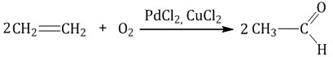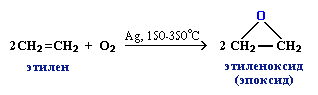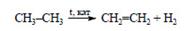Углеводороды.
Непредельные (ненасыщенные, алифатические, ациклические, этиленовые) углеводороды. Алкены. Олефины.
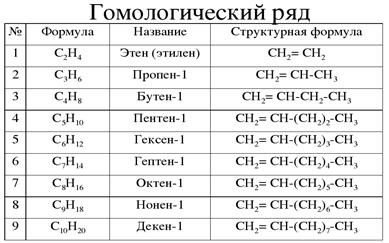
Общая формула: CnH2n, где n - количество атомов углерода в цепи, больше 2.
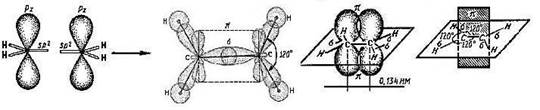
Строение: все атомы углерода в sp2 – гибридизации, связи ковалентные
σ-связи (сигма-связи) и π-связь (пи-связь), одна двойная связь. Плоскость π-связи перпендикулярна плоскости σ-связей. П лоско-треугольное строение молекул.
Изомерия:
I. Структурная изомерия:
1) Межклассовая (циклоалканы изомерны соответсвующим алкенам)
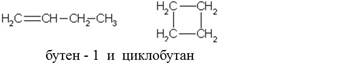
2) Углеродного скелета (начиная с бутена).
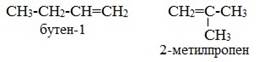
Изомерия положения кратной связи

II. Пространственная – геометрическая (цис-транс изомерия)
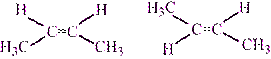
Цис — транс -изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя. Например, в молекуле
бутена-1 C H2= C H-CH2- CH 3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис — транс -изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3— C H= C H-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис — и транс -изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис — транс -изомерия
Не характерна.
Физические свойства: при обычных условиях С1-С4 – газы, С5-С15 – жидкости, начиная с С16 – твердые вещества. Алкены практически нерастворимы в воде, но хорошо растворимы в органических растворителях.
Радикалы являются составной частью ряда молекул:
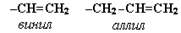
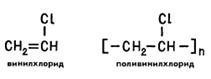
Тривиальные названия - этен (этилен), пропен (пропилен), бутен (бутилен), пентен (амилен).
Химические свойства
Алкены химически более активны, чем алканы, и самым реакционно-способным центром в молекуле алкена является π-связь (разрыв двойной связи).
Для алкенов характерны реакции присоединения по ионному механизму.
I. Реакции присоединения
1)  Гидрогалогенирование (HCl HBr HI)
Гидрогалогенирование (HCl HBr HI)
легкость присоединения возрастает
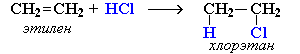
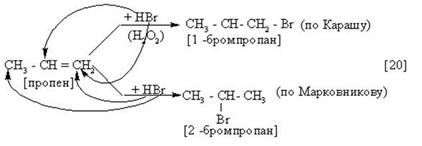
Пропен и последующие алкены реагируют с галогенводородами по правилу Марковникова.
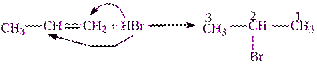

2) Гидратация (+Н 2 О) – ЕГЭ!
Условия: нагревание, серная (H2SO4)или фосфорная кислота (H3PO4)
t, H2SO4
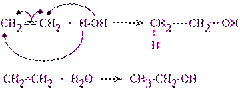
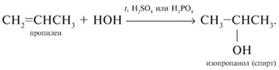
| Правило Марковникова:
атом водорода присоединяется к более гидрированному, а атом галогена – к менее гидрированному атому углерода при двойной связи.
| |

Отклонения от правила Марковникова:
1) В присутствии пероксидов (Н2О2)
Кто заметил ошибку в формуле 1-бромпропана?
2) Для производных алкенов, имеющих электроотрицательные атомы (электроакцепторные группы)
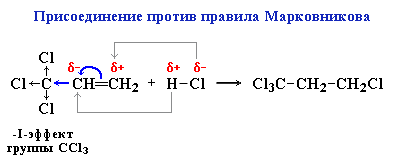
3,3,3-трихлорпропен-1
(трифторметильная группа, нитро-, карбоксильная группа и т.д.)
3) Галогенирование (+Н al) – ЕГЭ!
!*Обесцвечивание раствора брома – качественная реакция на пи-связь.
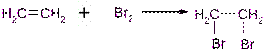
этен 1,2-дибромэтан
4) Гидрирование (+Н 2) и дегидрирование (-Н 2) – ЕГЭ!

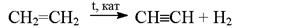
5) Реакция Полимеризации (А.М. Бутлеров)
Полимеризация - процесс последовательного соединения мономеров друг с другом, не сопровождающийся выделением побочного продукта.
Каталитическое окисление
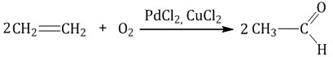
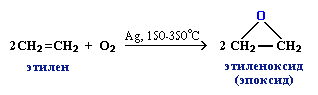
эпоксиэтан
Способы получения
В природе встречаются редко из-за высокой химической активности. Получают из алканов.
Термический крекинг алканов
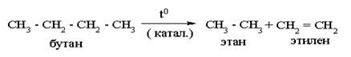
2) Дегидрирование алканов – ЕГЭ!
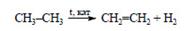
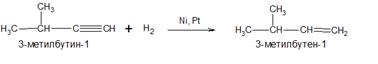
3) Гидрирование алкинов или алкадиенов
Углеводороды.
Непредельные (ненасыщенные, алифатические, ациклические, этиленовые) углеводороды. Алкены. Олефины.
Общая формула: CnH2n, где n - количество атомов углерода в цепи, больше 2.
Строение: все атомы углерода в sp2 – гибридизации, связи ковалентные
σ-связи (сигма-связи) и π-связь (пи-связь), одна двойная связь. Плоскость π-связи перпендикулярна плоскости σ-связей. П лоско-треугольное строение молекул.

Изомерия:
I. Структурная изомерия:
1) Межклассовая (циклоалканы изомерны соответсвующим алкенам)

2) Углеродного скелета (начиная с бутена).
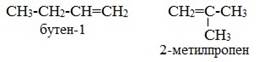





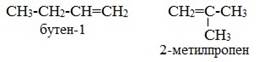

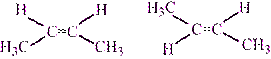

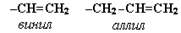
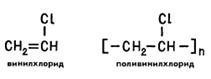
 Гидрогалогенирование (HCl HBr HI)
Гидрогалогенирование (HCl HBr HI)