

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...
Топ:
Выпускная квалификационная работа: Основная часть ВКР, как правило, состоит из двух-трех глав, каждая из которых, в свою очередь...
Основы обеспечения единства измерений: Обеспечение единства измерений - деятельность метрологических служб, направленная на достижение...
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Интересное:
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Учебное пособие
для студентов
Иркутск
ИГМУ
2018
УДК 544.72
ББК 24.58
С76
Рекомендовано ФМС ФГБОУ ВО ИГМУ Минздрава России
в качестве учебного-методического пособия для студентов, обучающихся по образовательной программе высшего образования – программе специалитета по специальности Лечебное дело, Педиатрия, Стоматология при изучении дисциплины «Химия»
Авторы:
Л.М. Станевич – канд. хим. наук, доцент кафедры химии и биохимии ФГБОУ ВО ИГМУ Минздрава России
Т.М. Анурьева – канд. биол. наук, старший преподаватель кафедры химии и биохимии ФГБОУ ВО ИГМУ Минздрава России
Рецензенты:
И.П. Сыроватский – канд. фарм. наук, доцент кафедры фармацевтической и токсикологической химии ФГБОУ ВО ИГМУ Минздрава России
В. В. Тыжигирова – канд. фарм. наук, доцент кафедры фармацевтической и токсикологической химии ФГБОУ ВО ИГМУ Минздрава России
Станевич, Л.М.
С76 Поверхностные явления: учебное пособие для студентов / Л.М. Станевич, Т.М. Анурьева; ФГБОУ ВО ИГМУ Минздрава России, Кафедра химии и биохимии. – Иркутск: ИГМУ, 2018. – 38 с.
Учебное пособие охватывает раздел химии, касающийся поверхностных явлений, происходящих на неподвижных и подвижных границах раздела фаз. В пособии отражены сведения по химии поверхностных явлений. Пособие иллюстрировано рисунками, выполненными авторами пособия и заимствованными из других источников.
Пособие соответствует рабочей программе учебной дисциплины «Химия» и предназначено для студентов, обучающихся по программе специалитета по специальности Лечебное дело, Педиатрия, Стоматология
УДК 544.72
ББК 24.58
|
|
© Станевич Л.М., Анурьева Т.М., 2018
© ФГБОУ ВО ИГМУ Минздрава России, 2018
ОГЛАВЛЕНИЕ
|
СОКРАЩЕНИЯ
ПАВ – поверхностно-активные вещества
ПИВ – поверхностно-инактивные вещества
ПНВ – поверхностно-неактивные вещества
ТХС – хроматография в тонком слое
ГЖХ – газожидкостная хроматография
ВВЕДЕНИЕ
Применение адсорбионных процессов в медицине
Адсорбционная терапия применяется для удаления токсинов и вредных веществ из пищеварительного тракта. Такие адсорбенты, как гидроксид алюминия, оксид магния, фосфат алюминия, входят в состав препаратов альмагель, фосфалюгель и др. Активированный уголь применяется как адсорбент газов (при метеоризме), токсинов (при пищевых токсикоинфекциях), алкалоидов и тяжелых металлов (при отравлениях).
Моделирование естественных механизмов детоксикации в различных сорбционных устройствах с использованием углеродных сорбентов, иммуносорбентов, ионообменных смол называется гемосорбцией. Она используется для удаления из крови различных токсичных веществ с достаточно крупными молекулами, вирусов, бактерий.
Гемосорбция показана при острых отравлениях барбитуратами, седативными средствами, фосфорорганическими пестицидами, некоторыми алкалоидами (хинин, пахикарпин). Разработана методика гемосорбции с наложенным электрическим потенциалом, что обеспечивает ускорение процесса.
|
|
Учет устанавливающихся адсорбционных равновесий необходим при введении в организм различных протезов. На любых объектах при соприкосновении с биологическими жидкостями организма возникают адсорбционные слои белков или других ПАВ. Отрицательные последствия этого явления возможны при использовании недостаточно биологически совместимых материалов, из которых изготавливают протезы, контактные линзы, детали аппаратов искусственного кровообращения и т.д.
ПАВ в ряде случаев вводят в лекарственные препараты для улучшения всасывания лекарственных веществ.
Иониты используют для консервирования крови. Аниониты применяют в качестве антацидных средств, катиониты – для предупреждения и лечения отеков, связанных с декомпенсацией сердечной деятельности, для предотвращения ацидоза.
Рис. 1. Схема действия межмолекулярных сил внутри жидкости и на ее поверхности
Поскольку плотность газа меньше плотности жидкости, то равнодействующая всех сил притяжения будет направлена внутрь жидкости перпендикулярно ее поверхности. Таким образом, поверхностные молекулы жидкости всегда находятся под действием силы, стремящейся втянуть их внутрь, т.е. поверхность жидкости всегда стремится сократиться. Этим объясняется шарообразная форма капли.
Поверхностными явлениями называют процессы, происходящие на границе раздела фаз и обусловленные особенностями состава и строения поверхностного слоя.
Всякая поверхность характеризуется запасом энергии, называемой поверхностной энергией. В эту энергию превращается работа, затрачиваемая на образование поверхности раздела. Поверхностная энергия Гиббса Gs зависит от величины поверхностного натяжения и площади поверхности S:
Gs = σ · S
Поверхностное натяжение есть величина, измеряемая энергией Гиббса, приходящейся на единицу площади поверхностного слоя:

Поверхностное натяжение измеряется в ньютонах на метр (н/м). Чистые жидкости характеризуются определенными значениями поверхностного натяжения. У полярных жидкостей оно обычно значительно, у неполярных – мало. Для воды σ = 7,3 · 10 -2 н/м.
Поверхностное натяжение жидкостей определяется различными методами. Наиболее распространенные из них – методы капиллярного поднятия, отрыва кольца, сталагмометрический и наибольшего давления пузырьков газа (метод Ребиндера).
|
|
Из термодинамики известно, что всякая система стремится обладать минимальным запасом энергии. Уменьшения свободной поверхностной энергии можно достичь двумя путями: за счет уменьшения либо поверхности раздела фаз, либо поверхностного натяжения.
Адсорбция
Адсорбция из растворов
Адсорбция растворённых веществ твёрдыми адсорбентами является более сложным процессом, чем адсорбция газов твёрдыми телами, так как она осложнена рядом факторов:
1) присутствием третьего компонента – растворителя, молекулы которого могут конкурировать с молекулами адсорбента за места на поверхности адсорбента;
2) взаимодействием между молекулами адсорбата и растворителя;
3) электростатическим взаимодействием между поверхностью адсорбента и молекулами адсорбата, если он является электролитом.
Явление адсорбции из растворов твердыми телами было открыто и изучено в 1785г. русским химиком и фармацевтом Т. Е. Ловицем. Различают два вида адсорбции из раствора на твёрдых адсорбентах: молекулярную, т.е. адсорбцию неэлектролитов или слабых электролитов, когда адсорбируются молекулы адсорбтива, и ионную адсорбцию сильных электролитов, когда избирательно адсорбируются один из ионов электролита.
Молекулярная адсорбция
Неэлектролиты и слабые электролиты на поверхности адсорбента адсорбируются из растворов в виде молекул. Такой процесс называется молекулярной адсорбцией.
Большое влияние на адсорбцию молекул растворённого вещества оказывает природа растворителя и адсорбента, температура, удельная поверхность адсорбента. Твердые поверхности можно разделить на гидрофильные, если они хорошо смачиваются водой, и гидрофобные, если они не смачиваются. Из наиболее широко применяемых на практике гидрофильной поверхностью обладают силикагели, глины; гидрофобной – угли, графит, тальк, парафин и другие.
Советский физико-химик П. А. Ребиндер сформулировал правило выравнивания полярности фаз, согласно которому растворённое вещество тем лучше адсорбируется, чем больше разность полярностей между ним и растворителем:
|
|
ε адсорбента ˂ ε адсорбтива ˂ ε растворителя
Отсюда вытекает, что:
- на полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителей; на полярных адсорбентах – неполярные адсорбаты из полярный растворителей;
- чем лучше в данном растворителе растворяется данный адсорбат, тем он хуже адсорбируется; чем хуже растворяется – тем лучше из него адсорбируется.
При этом на границе раздела адсорбент – среда дифильные молекулы будут адсорбироваться таким образом, чтобы полярная часть молекулы была обращена к полярной фазе, а неполярная – к неполярной (рис. 10).
| Бензол (неполярный растворитель) |
| Вода (полярный растворитель) |
| Силикагель (полярный адсорбент) |
| Активированный уголь (неполярный адсорбент) |
Рис. 10. Ориентирование молекул ПАВ на границе твёрдое тело – раствор
В системах неполярный растворитель - малополярный адсорбент адсорбция ПАВ подчиняется правилу Дюкло – Траубе. При адсорбции ПАВ из неполярных растворителей полярными адсорбентами выполняется обращённое правило Дюкло – Траубе: с ростом длинны углеводородного радикала адсорбция уменьшается.
Механизмы молекулярной адсорбции лежат в основе одного из самых современных методов лечения – гемосорбции, т.е. очистки крови от токсичных веществ с помощью различных адсорбентов. В медицинской практике этот метод применяется при почечной недостаточности, при сильных отравлениях снотворными, фосфорорганическими соединениями.
Ионная адсорбция
Ионной адсорбцией называют процесс, в котором адсорбент и раствор обмениваются между собой в эквивалентном количестве одноимённо заряженными ионами.
RM1 + M2+ RM2 + M1+ или
RA1 + A2- RA2 + A1-, где
RA1, RM1 – адсорбенты, содержащие катионы М1 или анионы А1 и способные к обмену соответственно с катионами М2 и анионами А2 в растворе, получившем название ионитов.
Иониты обладают сетчатой структурой. В сетке закреплены группы атомов R, несущих положительный или отрицательный заряд. Этот заряд компенсируется так называемы противоионами (M+ или А-). Фиксированные ионы вместе с подвижными противоионами (R-M+ или R+M-) называют ионогенными или функциональными группировками ионита.
По типу ионогенных групп иониты делят на катиониты R-M+ и аниониты R+A-. По степени ионизации (при помещении в воду) ионогенных групп иониты делят на сильно- и слабокислотные катиониты и сильно- и слабоосновные аниониты.
|
|
Сильнокислотные катиониты в качестве ионогенных групп содержат остатки серной, фосфорной и других кислот. Слабокислотные – карбоксильные, сульфгидрильные и другие группы. Ионогенные группы сильных анионитов представляют собой обычно группы аммониевых или сульфониевых оснований, а слабоосновные – аминогруппы различной степени замещения пиридиновые основания.
Ионообменные реакции можно представить следующими уравнениями:
| SO3…Н SO3 R + Ca2+ R Ca + 2H+ SO3…Н SO3 катионит RH |
| NH3…OН NH3 R + SO4 R SO4 + 2OH- NH3…OН NH3 анионит ROH |
| 2- |
Ионный обмен – обратимый процесс, что даёт возможность регенерировать использованные иониты. Для характеристики ионитов важно знать поглощающую способность ионита, которую характеризуют обменной ёмкостью: обменная ёмкость измеряется количеством ионов, поглощённых 1г сухого ионита из раствора в равновесных условиях.
О важной роли ионного обмена в биологических системах известно давно. Различные ткани растительных и животных организмов обладают катионообменными свойствами в физиологическом интервале рН. За катионообменные свойства биологических структур ответственны в основном карбоксильные и фосфатные группы, за анионообменные – аминогруппы беков.
Установлено, что ионный обмен играет важную роль в переносе различных веществ через биологические мембраны. Так, многие белки – переносчики при определённых состояниях, проявляют различную селективность к ионам Na+, К+, Са2+, Cl- и др.
В настоящее время в медицинской практике широко применяются катионообменные смолы для декальцинирования крови с целью её консервирования. Жидкие ионообменные смолы на основе поливинилового спирта и поливинилпирролидона являются эффективными пролонгаторами некоторых лекарственных соединений (пролонгация – сохранение в течение длительного времени определённой концентрации лекарственных веществ в жидких средах организма). Пролонгирование лекарственных соединений необходимо в том случае, когда они слишком быстро разрушаются в организме, как, например, большинство антибиотиков. В основе действия пролонгаторов лежит присоединение лекарственного вещества к матрице полимера по ионообменному механизму.
Широкое применение находят иониты в фармацевтической и биологической промышленности. Это получение и очистка лекарств и биологически активных веществ: витаминов, антибиотиков, аминокислот, белков, токсинов, ферментов и т.д.
Хроматография
Среди методов разделения и очистки органических соединений ведущее место занимает хроматография – метод, впервые предложенный в начале века русским ученым М.С. Цветом.
Хроматографическим методом называется физико-химический метод разделения смесей, при котором компоненты разделяемой смеси распределены между двумя фазами, одной из которых является неподвижный слой с большой поверхностью контакта, а другая фаза представляет собой поток, фильтрующийся через неподвижный слой.
Многообразие видоизменений и вариантов хроматографического метода вызывает необходимость их систематизации или классификации. В настоящее время общепринятыми являются следующие классификации:
1) по агрегатному состоянию фаз
2) по методике проведения эксперимента.
По агрегатному состоянию фаз:
· жидкостная хроматография, в данном методе подвижная фаза представляет жидкость, а неподвижной может быть твердое вещество или другая жидкость, которая не смещивается или частично смешивается с первой (жидкостно-твердофазная, жидкостно-жидкостная, жидкостно-гелевая);
· газовая хроматография, подвижной фазой является газ, а неподвижной может быть твердое вещество или нелетучая жидкость (газо-твердофазная, газо-жидкостная).
По методике проведения эксперимента различают три вида хроматографии:
· проявительную или элюентную;
· фронтальную;
· вытеснительную.
Хроматографический метод основан на различном распределении веществ между подвижной (поток жидкости или газ) и неподвижной (твердой или жидкой) фазами.
В зависимости от характера фаз, с помощью которых производится разделение, различают газовую, газожидкостную и жидкостную хроматографию. По типу взаимодействия разделяемых веществ с фазами хроматография делится на адсорбционную, распределительную, ионообменную, гель-хроматографию и электрофорез.
Хроматографический процесс может осуществляться в колонках, в тонком слое на бумаге.
По механизму, лежащему в основе метода различают:
1) Адсорбционная хроматография основана на различии в относительном сродстве компонентов разделяемой смеси к твердым адсорбентам (неподвижная фаза), в качестве которых используются порошкообразные вещества – оксид алюминия, силикагель, крахмал, цеолиты, активированный уголь и т. п. Наиболее распространены колоночный и тонкослойный варианты адсорбционной хроматографии.
В колонку, обычно представляющую собой заполненную адсорбентом стеклянную трубку, вносят раствор смеси веществ. При прохождении через колонку осуществляется разделение компонентов смеси веществ. С помощью подаваемой в колонку подвижной фазы – растворителя, называемого элюентом, - адсорбированные вещества в виде зон перемещаются (вымываются) с различными скоростями (жидкостная адсорбционная хроматография). В результате из колонки выходят фракции (элюаты) разделенных веществ (рис. 11).
| Зоны разделения веществ |
| Хроматографическая колонка |
| Пористая пластинка |
| Элюат |
| Адсорбент |
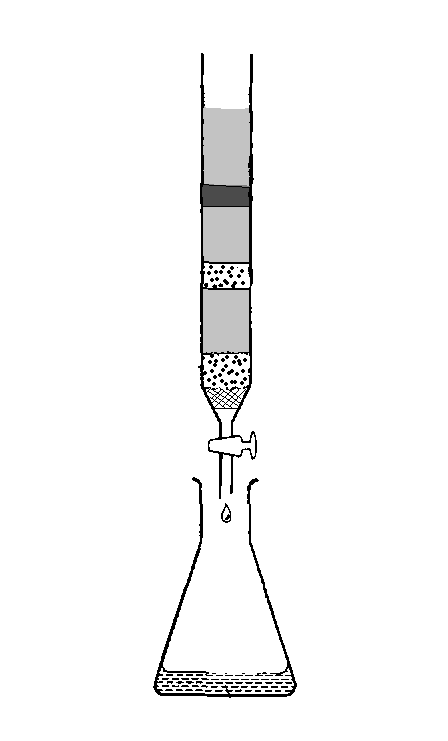
Рис. 11. Хроматография на колонке
11Колоночная хроматография [Электронный ресурс] // Химический портал [Сайт]. – Режим доступа: http://www.himikatus.ru/art/ch-act/0326.php.
Хроматография в тонком слое (ТСХ) – один из наиболее быстрых способов разделения органических смесей. На тонкий слой сорбента на подложке (стеклянной или алюминиевой пластинке) в виде нескольких точек или зон наносят раствор разделяемых веществ. В хроматографической камере при подъеме подвижной фазы по пластинке снизу вверх происходит разделение веществ. Бесцветные вещества обнаруживают путем обработки пластинки различными химическими реагентами, образующими при взаимодействии с ними окрашенные пятна. При использовании готовых пластинок «Силуфол» с люминесцентным индикатором ряд веществ (пятен) можно обнаружить при облучении УФ-светом. Положение пятна на хроматограмме характеризуется величиной Rf, являющейся отношением расстояния l, пройденного веществом к расстоянию L, пройденному растворителем (рис. 12).

Рис. 12. Хроматография в тонком слое сорбента
12Молекулярно-адсорбционная хроматография [Электронный ресурс] // Студопедия [Сайт]. – Режим доступа: https://studopedia.ru/14_39876_molekulyarno-adsorbtsionnaya-hromatografiya.html.
2) Распределительная хроматография основана на разделении веществ за счет различия в коэффициентах распределения между двумя или более несмешивающимися жидкими фазами или неподвижной жидкой и газовой фазами. Неподвижной фазой служит твердый носитель, пропитанный специальной жидкостью, подвижной – растворитель (жидкостная распределительная хроматография) или газ (газожидкостная хроматография, ГЖХ). Распределительная хроматография проводится обычно на бумаге или колонках.
В хроматографии на бумаге носителем неподвижной водной фазы служит специальная хроматографическая бумага. Как и в ТСХ, раствор смеси разделяемых веществ наносится на стартовую линию полоски бумаги, помещаемой в хроматографическую камеру. Подвижная фаза поднимается по бумаге вверх - восходящая хроматография (рис. 13 а) или стекает вниз – нисходящая хроматография (рис. 13 б). При этом происходит распределение компонентов смеси между фазами. В зависимости от значения коэффициентов распределения вещества движутся с различной скоростью, разделяясь на бумаге на отдельные пятна, отличающиеся величиной Rf. Впервые хроматография на бумаге была предложена для качественного и количественного определения аминокислот и пептидов, полученных при гидролизе белка. До настоящего времени этот способ пригоден для разделения природных веществ - углеводов, липидов, нуклеотидов и др.
Колоночная хроматография с применением жидкой подвижной фазы (как правило, смеси органических растворителей) широко используются в обычной лабораторной практике (жидкостная распределительная хроматография).
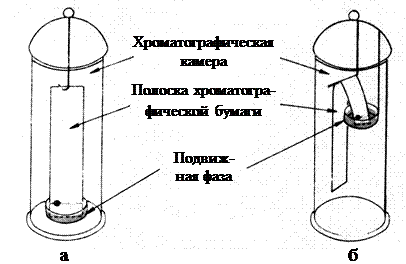
Рис. 13. Распределительная хроматография на бумаге
13Распределительная хроматография [Электронный ресурс] // Студопедия [Сайт]. – Режим доступа: https://studopedia.ru/14_39878_raspredelitelnaya-hromatografiya.html.
Высокоэффективное разделение веществ достигается при использовании газовой подвижной фазы. ГЖХ – универсальный метод разделения смесей разнообразных веществ, испаряющихся без разложения. Для увеличения летучести многие природные соединения превращают в производные: α – аминокислоты в метиловые или этиловые эфиры, моносахариды в их триметилсилиловые эфиры и др.
ГЖХ проводится на приборах, называемых хроматографами. Разделенные вещества фиксируются в виде пиков на хроматограмме (рис.14). Положение каждого пика определяется временем, в течение которого вещество проходит колонку до момента выхода (время удерживания), или объем прошедшего газа-носителя (удерживаемый объем). Количественное определение компонентов в смеси может быть с высокой точностью осуществлено путем измерения относительных площадей соответствующих пиков.
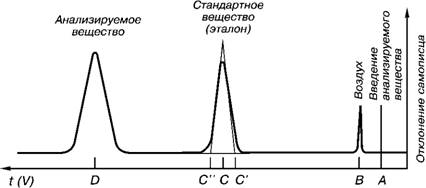
Рис. 14. Газожидкостная хроматография
14Газожидкостная хроматография [Электронный ресурс] / Ю. Я. Харитонов, Д. Н. Джабаров, В. Ю. Григорьева // Аналитическая химия. – Москва: ГЭОТАР-Медиа, 2012. – Раздел 3. – Режим доступа: https://books.google.ru/books?hl=ru&lr=&id=3XiNxb1FpsIC&oi
3) Ионообменная хроматографиявключает обратимый обмен ионов, содержащихся в растворе разделяемой смеси, на ионы полимерных смол, называемых ионитами (катиониты, аниониты) и используемых в качестве подвижной фазы. Катиониты – это вещества кислотного характера, содержащие карбоксильные и сульфогруппы, протоны которых обмениваются на катионы. Аниониты – содержат в своем составе группы основного характера, например аминогруппу различной степени замещения.
В отличие от ранее рассмотренных видов хроматографии ионообменная хроматография основана на химическом взаимодействии активных групп неподвижной фазы с ионами соединяемых соединений. Она используется для разделения смесей белков и аминокислот, которые в водном растворе находятся в виде ионов. Ионообменная хроматография положена в основу действия специальных приборов – автоматических аминокислотных анализаторов.
4) Хемосорбционная хроматография включает в себя несколько вариантов хроматографических процессов, общим для них является различие в термодинамических константах того или иного вида химического равновесия: констант растворимости (осадочная хроматография), констант нестойкости комплексных соединений (адсорбционно-комплексообразовательная хроматография), констант реакций с переносом электрона (редокс-хроматография).
К хемосорбционной хроматографии относится и биоспецифическая (афинная) хроматография, основанная на специфичности взаимодействия, лежащего в основе биологической функции фермента. Стационарная фаза содержит либо фермент, либо субстрат, в результате чего из анализируемой смеси с высокой степенью специфичности будет «вылавливаться» партнер соответствующей фермент- субстратной реакции
5) Молекулярно-ситовая хроматография (гель-фильтрация) позволяет анализировать смеси, содержащие вещества со значительно различающимся размером молекул. В качестве стационарной фазы используют пористые тела – молекулярные сита, которые являются проницаемыми для молекул только определенного размера. Крупные молекулы, не попадая в поры, перемещаются вдоль стационарной фазы быстрее, чем мелкие. Молекулярно-ситовая хроматография чрезвычайно широко применяется в биохимии для разделения смесей биополимеров (например, белков) на фракции.
Хроматографические методы находятся в стадии развития и постоянного обновления, совершенствуется аппаратура для их проведения. Например, за счет применения высокого давления, колонок малого сечения и мелкодисперсных сорбентов жидкостная распределительная хроматография стала высокоскоростным процессом, осуществляемым с помощью современных жидкостных хроматографов.
Хроматографию широко применяют в медико-биологических исследованиях и в клинической практике.
Анализ крови на присутствие в ней алкоголя, наркотиков, летучих веществ, вызывающих токсикоманию, проводится с помощью хроматографии за считанные минуты. Хроматография является незаменимым методом для допинг-контроля (обнаружение стимулирующих веществ в организме спортсменов). С помощью хроматографии в биологических жидкостях можно выявить микрокомпоненты (не определяемые другими методами), которые появляются при наличии той или иной патологии. Значение хроматографии как каждого диагностического метода постоянно возрастает.
ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
1. Поверхностная энергия и поверхностное натяжение. Поверхностно-активные, -неактивные, -инактивные вещества. Изотермы поверхностного натяжения. Правило Траубе.
2. Сорбция и ее виды. Адсорбция: единицы измерения, зависимость от различных факторов. Изотерма адсорбции.
3. Адсорбционные процессы на подвижных границах раздела фаз. Уравнение Гиббса. Принцип независимости поверхностного действия. Ориентация молекул ПАВ в поверхностном слое.
4. Адсорбционные процессы на неподвижных границах раздела фаз. Адсорбция газов на твердых телах. Уравнение Фрейндлиха.
5. Теория мономолекулярной адсорбции Ленгмюра. Уравнение Ленгмюра. Изотерма полимолекулярной адсорбции.
6. Адсорбция из растворов неэлектролитов. Правило выравнивания полярностей Ребиндера. Гидрофильные и гидрофобные адсорбенты.
7. Адсорбция из растворов электролитов: эквивалентная, избирательная. Ионообменная. Правила избирательной адсорбции.
8. Хроматография: определение метода.
9. Классификация методов хроматографического анализа по агрегатному состоянию подвижной фазы и механизму разделения.
Ситуационные задачи
Задача 1.
Сравните поверхностную активность пропионовой и масляной кислот в водных растворах в данном интервале концентраций, если известно:
| Кислота | с, моль/л | s, Н/м |
| пропионовая | 0,0312 0,0625 | 69,5×10-3 67,7×10-3 |
| масляная | 0,0312 0,0625 | 65,8×10-3 60,4×10-3 |
Правило Дюкло-Траубе выполняется в заданном интервале концентраций?
Задача 2
Почему капля жидкости имеет форму шара?
Задача 3
К каким группам можно отнести указанные соединения по способности их изменять поверхностное натяжение воды: хлороводородная кислота, липиды, сахароза, гидроксид натрия, амины, жирные кислоты?
Задача 4
Напишите уравнение реакции, которая лежит в основе декальцинирования донорской крови, устранения жесткости воды.
Задача 5
К каким группам можно отнести указанные соединения по способности их изменять поверхностное натяжение воды: хлороводородная кислота, липиды, сахароза, гидроксид натрия, амины, жирные кислоты?
Задача 6
Какой из адсорбентов: активированный уголь или силикагель следует выбрать при изучении адсорбции уксусной кислоты из водного раствора?
Задача 7
На основании правила Ребиндера решите, что будет лучше адсорбироваться на поверхности активированного угля из водного раствора: уксусная кислота или этиленгликоль ε(СН3СOOH)=6, ε(H2O)=80, ε(C)=1, ε(C2H4(OH)2)=38.
ТЕСТОВЫЕ ЗАДАНИЯ
1. Укажите поверхностно-активное вещество по отношению к воде
1) HNO3;
2) NaOH;
3) С6 Н12 О6;
4) С17 Н33СООН
2. Изотерма поверхностного натяжения показывает зависимость:
1) величины адсорбции от температуры;
2) величины поверхностного натяжения от температуры;
3) величины поверхностного натяжения от концентрации;
4) величины адсорбции от концентрации
3. Количественно величину адсорбцию на подвижных границах раздела фаз описывают уравнения:
1) Гиббса;
2) Фрейндлиха;
3) Лэнгмюра;
4) Ребиндера
4.Молекула поверхностно – активного вещества является:
1) гидрофобной;
2) гидрофильной;
3) дифильной;
4) неполярной
5. Изотерма адсорбции показывает зависимость:
1) величины адсорбции от температуры;
2) величины поверхностного натяжения от температуры;
3) величины поверхностного натяжения от концентрации;
4) величины адсорбции от концентрации
6. Поверхностная активность в гомологическом ряду:
1) возрастает;
2) не изменяется;
3) уменьшается;
4) зависит от температуры
7. Гемосорбция – это:
1) выделение эритроцитов;
2) отделение эритроцитов от плазмы;
3) очистка крови от токсинов;
4) замораживание эритроцитов
8. Какой вид адсорбции из растворов имеет место в случае, когда адсорбент избирательно поглощает из раствора только ион определенного знака:
1) молекулярная;
2) эквивалентная;
3) ионообменная;
4) избирательная
9. В основе экспериментальных и теоретических работ по созданию моделей биологических мембран лежит:
1) правило Пескова - Фаянса;
2) правило Дюкло - Траубе;
3) принцип независимости поверхностного действия;
4) теория полимолекулярной адсорбции БЭТ
10. К полярным адсорбентам относятся:
1) активированный уголь;
2) силикагель;
3) сажа;
4) парафин
11. АДСОРБЦИЯ ОТНОСИТСЯ К ЧИСЛУ
1) электрокинетических явлений;
2) поверхностных явлений;
3) оптических явлений;
4) молекулярно-кинетических явлений
12. ПРОЦЕСС АДСОРБЦИИ ПРОТЕКАЕТ:
1) самопроизвольно;
2) не самопроизвольно;
3) необратимо;
4) эндотермически
13. ПО ОТНОШЕНИЮ К ВОДЕ ПОВЕРХНОСТНО-АКТИВНЫМ ВЕЩЕСТВОМ ЯВЛЯЕТСЯ
1) HCl;
2) NaOH;
3) C12H22O11;
4) C15H31COOH
14.ПРИ АДСОРБЦИИ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ ИЗ ВОДЫ В КАЧЕСТВЕ АДСОРБЕНТА СЛЕДУЕТ ИСПОЛЬЗОВАТЬ
1) силикагель;
2) оксид алюминия;
3) активированный уголь;
4) глину
15.ПРИ АДСОРБЦИИ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ ИЗ БЕНЗОЛА В КАЧЕСТВЕ АДСОРБЕНТА СЛЕДУЕТ ИСПОЛЬЗОВАТЬ
1) силикагель;
2) парафин;
3) активированный уголь;
4) графит
16. НА ПОВЕРХНОСТИ Са3(РО3)2 ИЗ РАСТВОРА ИЗБИРАТЕЛЬНО АДСОРБИРУЮТЯ ИОНЫ
1) Na+;
2) Ca2+;
3) Fe3+;
4) Sn4+
ОТВЕТЫ НА ТЕСТОВЫЕ ЗАДАНИЯ
| 1-4 | 6-1 |
| 2-3 | 7-3 |
| 3-1 | 8-4 |
| 4-3 | 9-3 |
| 5-4 | 10-2 |
Рекомендуемая литература
Основная
1. Общая химия. Биофизическая химия. Химия биогенных элементов: учебник для вузов / Ю. А. Ершов и др. – М.: Высшая школа, 1993. – 560 с.
2. Глинка, Н. Л. Общая химия: учебник для вузов / В. А. Попкова, В. А. Бабкова. – 18-е изд., перераб. и доп. – М.: Юрайт, 2011. – 886 с.
3. Ленский, А. С. Биофизическая и бионеорганическая химия: учебник / А. С. Ленский, И. Ю. Белавин, С. Ю. Быликин. – М.: Медицинское информационное агентство, 2008. – 408 с.
4. Попков, В. А. Общая химия: учебник / В. А. Попков, С. А. Пузаков. – М.: ГЭОТАР – Медиа, 2010. – 976 с.
Дополнительная
1. Рубина, Х. М. Практикум по физической и коллоидной химии / Х. М. Рубина, М. А. Добринская, Л. А. Романчук. – М.: Высшая школа, 1972. – 152 с.
2. Садовничая, Л. П. Биофизическая химия: учебное пособие для мед.ин-тов / Л. П. Садовничая, В. Г. Хухрянский, А. Я. Цыганенко. – Киев: Вища школа, 1986. – 270 с.
3. Хмельницкий, Р. А. Физическая и коллоидная химия / Р. А. Хмельничкий. – М.: Высшая школа, 1988. – 400 с.
Учебное издание
Станевич Любовь Михайловна
Анурьева Татьяна Матвеевна
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Учебно-методическое пособие для студентов
к лабораторно-практическому занятию
ПОВЕРХНОСТНЫЕ ЯВЛЕНИЯ
Учебное пособие
для студентов
Иркутск
ИГМУ
2018
УДК 544.72
ББК 24.58
С76
Рекомендовано ФМС ФГБОУ ВО ИГМУ Минздрава России
в качестве учебного-методического пособия для студентов, обучающихся по образовательной программе высшего образования – программе специалитета по специальности Лечебное дело, Педиатрия, Стоматология при изучении дисциплины «Химия»
Авторы:
Л.М. Станевич – канд. хим. наук, доцент кафедры химии и биохимии ФГБОУ ВО ИГМУ Минздрава России
Т.М. Анурьева – канд. биол. наук, старший преподаватель кафедры химии и биохимии ФГБОУ ВО ИГМУ Минздрава России
Рецензенты:
И.П. Сыроватский – канд. фарм. наук, доцент кафедры фармацевтической и токсикологической химии ФГБОУ ВО ИГМУ Минздрава России
В. В. Тыжигирова – канд. фарм. наук, доцент кафедры фармацевтической и токсикологической химии ФГБОУ ВО ИГМУ Минздрава России
Станевич, Л.М.
С76 Поверхностные явления: учебное пособие для студентов / Л.М. Станевич, Т.М. Анурьева; ФГБОУ ВО ИГМУ Минздрава России, Кафедра химии и биохимии. – Иркутск: ИГМУ, 2018. – 38 с.
Учебное пособие охватывает раздел химии, касающийся поверхностных явлений, происходящих на неподвижных и подвижных границах раздела фаз. В пособии отражены сведения по химии поверхностных явлений. Пособие иллюстрировано рисунками, выполненными авторами пособия и заимствованными из других источников.
Пособие соответствует рабочей программе учебной дисциплины «Химия» и предназначено для студентов, обучающихся по программе специалитета по специальности Лечебное дело, Педиатрия, Стоматология
УДК 544.72
ББК 24.58
© Станевич Л.М., Анурьева Т.М., 2018
© ФГБОУ ВО ИГМУ Минздрава России, 2018
ОГЛАВЛЕНИЕ
|
|
|
|

Историки об Елизавете Петровне: Елизавета попала между двумя встречными культурными течениями, воспитывалась среди новых европейских веяний и преданий...

Архитектура электронного правительства: Единая архитектура – это методологический подход при создании системы управления государства, который строится...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!