

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Интересное:
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Что нужно делать при лейкемии: Прежде всего, необходимо выяснить, не страдаете ли вы каким-либо душевным недугом...
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Неорганическая химия
Рабочая тетрадь
Методическое пособие
для самостоятельной работы студентов

Тюмень
2020
| Рассмотрено цикловой комиссией Протокол № от «____»__________20 г. Председатель Цикловой комиссии | Утверждаю: Заместитель директора по учебной работе ______________ «___» ________ 20 г. |
Рассмотрено на методическом совете ГАПОУ ТО «ТКПСТ»
С О Д Е Р Ж А Н И Е
Пояснительная записка ………………………………………………….. 4
Предмет химии. Вещества.
1. Простые и сложные вещества. Физические свойства веществ…….. 5
2. Периодическая система химических элементов Д.И.Менделеева…………………………………………………………. 9
3. Химические формулы. Относительные атомная и молекулярная массы…………………………………………………………………… 13
Атомы химических элементов
4. Строение атома. Изотопы. Строение электронных оболочек атомов..17
5. Периодическая система химических элементов Д.И.Менделеева
в свете представлений о строении атома…………………………… 22
Химическая связь
6. Основные типы химических связей. ………………………………… 23
Соединения химических элементов
7. Степень окисления химических элементов……………………………28
8. Первоначальные сведения об основных классах неорганических соединений………………………………………………………………32
Изменения, происходящие с веществами
9. Химические реакции ………………………………………………….. 41
10. Чистые вещества и смеси……………………………………………… 47
11. Теория электролитической диссоциации………………………………50
12. Кислоты………………………………………………………………… 53
13. Основания……………………………………………………………… 60
|
|
14. Соли…………………………………………………………………… 69
Литература ………………………………………………………………. 74
Пояснительная записка
Данная рабочая тетрадь представляет собой учебное пособие по химии для студентов 1 курса. Она предназначена для организации самостоятельной работы обучающихся на разных этапах урока: и при изучении нового материала, и для закрепления полученных знаний.
Рабочая тетрадь охватывает несколько частей (базового и повышенного уровня):
Часть А включает в себя задания, связанные с воспроизведением теоретического учебного материала. Как правило, это определения, схемы классификации. Этот материал должен выполнить и усвоить каждый ученик. Такая работа повышает словарный запас учащихся, улучшает их грамотность, способствует более осмысленному использованию новых слов при объяснении учебного материала. Не все термины, которые необходимо записать учащимся, даются в учебнике. Некоторые из них они должны найти в справочнике, словаре или энциклопедии во внеурочное время, в библиотеке.
Часть Б включает в себя задания трех уровней. Первый уровень включает в себя задания, направленные на воспроизведение знаний. Второй уровень – это задания, связанные с применением знаний в сходной ситуации. И наконец, третий – задания, при выполнении которых ученик должен применить знания в новой, нестандартной ситуации. Такое построение связано с тем, что именно при выполнении заданий нарастающей степени трудности, а также различных видов учебных работ с переходом от действий воспроизводящего характера к действиям продуктивным, самостоятельным, предусматривающим применение ранее приобретенных знаний, происходит развитие умений, закрепление полученных знаний.
Часть В – задания тестового типа. Они позволяют осуществлять планомерную подготовку обучающихся по темам курса «Химия».
ПРЕДМЕТ ХИМИИ. ВЕЩЕСТВА.
Простые и сложные вещества.
|
|
Физические свойства веществ
ЧАСТЬ А
1. Запишите определения.
Химия – ……………………………………………………………...
………………………………………………………………………….
…………………………………………………………………………..
Вещество – …………………………………………………………..
…………………………………………………………………………..
Химический элемент – …………………………………………......
…………………………………………………………………………..
Свойства веществ – …………………………………………..........
…………………………………………………………………………..
2. Заполните схему (схема 1).
Схема 1

ЧАСТЬ Б
3. Заполните таблицу (табл. 1).
Таблица 1
Физические свойства веществ
| Вещество | Агрегатное состояние | Цвет | Запах | Твердость | Растворимость в воде |
| Поваренная соль | |||||
| Питьевая сода | |||||
| Вода | |||||
| Кислород | |||||
| Железо |
4. Из приведенного ниже перечня названий веществ и тел выпишите в два столбика: в первый – названия веществ, во второй – физических тел.
Медная монета, стекло, железо, поваренная соль, кусочек сахара, ножницы, ваза, вода, капля росы, железная ложка, булавка, снежинка, железный гвоздь, мел.
| Вещество | Физическое тело |
5. Заполните таблицу (табл. 2). Для этого в правой части таблицы напишите названия веществ, из которых могут быть изготовлены приведенные физические тела.
Таблица 2
| Физические тела | Вещества | ||
| Линейка | |||
| Ложка | |||
| Стакан | |||
6. Заполните таблицу (табл. 3). Для этого в правой части таблицы напишите названия физических тел, которые могут состоять из указанных в левой части веществ.
Таблица 3
| Вещества | Физические тела | ||
| Графит | |||
| Алюминий | |||
| Серебро | |||
7. Найдите выигрышный путь (по типу «крестики-нолики») в предложенных ниже квадратах, если он составляет: а) вещество; б) физическое тело.
| а) | б) | ||||
| Фарфоровая ваза | Медный колокол | Ложка | Глюкоза | Медная проволока | Древесная стружка |
| Железный гвоздь | Золото | Кусочек сахара | Сахар | Кусочек мела | Медный колокол |
| Уксусная кислота | Поваренная соль | Сера | Химическая колба | Водород | Кремний |
8. Путь к вершине пирамиды (схема 2) – вещество.
|
|
Схема 2
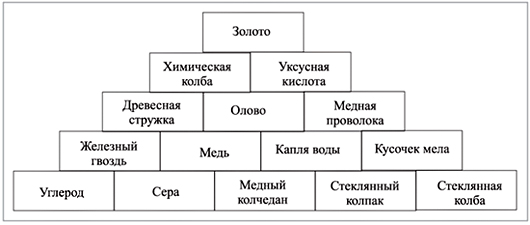
9. Определите, физическим телом или веществом являются перечисленные в правой части таблицы (табл. 4) объекты. Из букв, соответствующих правильным ответам, вы получите название одного из классов простых веществ.
Таблица 4
| Название объекта | Физическое тело | Вещество |
| Капля воды | Н | Щ |
| Сахар | Ф | Е |
| Медный колокол | М | Г |
| Химическая колба | Е | Д |
| Золото | Ц | Т |
| Древесная стружка | А | Ж |
| Уксусная кислота | Х | Л |
| Вода | Ъ | Л |
| Кусочек мела | Ы | Б |
Ответ. ………………………………………………………………..
10. Из перечисленных ниже веществ выпишите отдельно простые и сложные вещества.
Ацетилен (C2H2), глюкоза (С6Н12О6), магний (Mg), озон (О3), бор (В), негашеная известь (СаО), питьевая сода (NaHCO3), водород (Н2), соляная кислота (HCl), сера (S).
| Простые вещества | ………………………………………………………………… |
| Сложные вещества | ………………………………………………………………… |
ЧАСТЬ В. Задания для самоконтроля
Обведите кружком правильные ответы (их может быть больше одного).
1. Химия – это наука:
а) о явлениях, происходящих в природе;
б) о телах и их свойствах;
в) о веществах, их свойствах и взаимных превращениях этих веществ друг в друга;
г) о явлениях, происходящих в мире физических тел.
2. Выберите из приведенных ниже названий
вариант I – вещества;
вариант II – физические тела:
а) стакан; б) стекло;
в) линейка; г) вода.
3. К физическим свойствам из перечисленных ниже понятий
вариант I – не относится;
вариант II – относится:
а) запах; б) цвет;
в) растворимость в воде; г) выпуклость.
4. О железе говорится как
вариант I – о химическом элементе;
вариант II – о простом веществе:
а) твердый;
б) входит в состав некоторых солей;
в) притягивается магнитом;
г) входит в состав гемоглобина крови человека.
2. Периодическая система химических элементов Д.И.Менделеева
ЧАСТЬ А
1. Периодическая система химических элементов Д.И.Менделеева состоит из ……… периодов и ………групп.
2. Периоды – это …………………………………………………….
………………………………………………………………………….
3. Группы – это ……………………………………………………...
………………………………………………………………………….
|
|
4. Периоды состоят из ……………………………………………,
а группы – из ………………………………………………………….
5. Периоды делятся на ……………. и ……………., а группы – на ……………. и ……………..
6. В чем отличие малых и больших периодов?
…………………………………………………………………………..
………………………………………………………………………….
7. В чем отличие главных и побочных подгрупп?
…………………………………………………………………………..
………………………………………………………………………….
ЧАСТЬ Б
8. Заполните таблицу (табл. 5).
Таблица 5
| Поряд- ковый номер | Символ химического элемента | Русское название | Произ- ношение | Номер периода | Номер ряда | Группа | Под- группа |
| 7 | N | Азот | Эн | 2-й | 2-й | V | Главная |
| 1 | |||||||
| Мg | |||||||
| Кислород | |||||||
| Силициум | |||||||
| 29 | |||||||
| He | |||||||
| С | |||||||
| 16 | |||||||
| Эс | |||||||
| Цинк | |||||||
| Hg | |||||||
| Ba | |||||||
| 14 | |||||||
| Фосфор | |||||||
| Хлор | |||||||
| Cu | |||||||
| Серебро | |||||||
| Калий | |||||||
| Кальций | |||||||
| Феррум | |||||||
| 23 |
9. Из таблицы 5 выпишите знаки (символы) элементов металлов и неметаллов.
| Металлы | Неметаллы |
10. Запишите знаки элементов:
2-го периода ………………………………………………………..
Iа подгруппы ……………………………………………………….
Iв подгруппы ……………………………………………………….
11. Кроссворд «Названия химических элементов». Впишите в кроссворд названия химических элементов и разгадайте зашифрованное ключевое слово.
По горизонтали: 1. Химический элемент с порядковым номером 46. 2. Элемент, расположенный во II группе главной подгруппы, во 2-м периоде. 3. Элемент, простое вещество которого необходимо для дыхания. 4. Металл, расположенный во 2-м периоде. 5. Элемент, произношение которого «пэ». 6. Элемент VIII группы главной подгруппы.
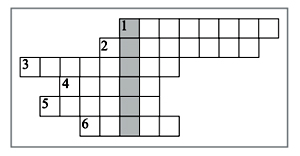
12. Найдите выигрышный путь (по типу «крестики-нолики»), если он составляет: а) элементы II группы; б) элементы 3-го периода.
а)
| Магний | Сурьма | Калий |
| Цинк | Калий | Золото |
| Бериллий | Бор | Углерод |
б)
| Натрий | Азот | Бор |
| Галлий | Алюминий | Фосфор |
| Скандий | Кислород | Кремний |
| Часть B. Задания для самоконтроля |
Обведите кружком правильный ответ.
|
|
1. Число периодов и групп в периодической системе химических элементов Д.И.Менделеева:
а) 10 и 7; б) 8 и 10; в) 7 и 8; г) 7 и 7.
2. Число рядов в периодической системе химических элементов Д.И.Менделеева:
а) 7; б) 8; в) 10; г) 12.
3. Число элементов в VII группе, в главной и побочной подгруппах соответственно:
а) 9 и 5; б) 5 и 4; в) 4 и 7; г) 3 и 5.
4. Число элементов во 2-м и 4-м периодах соответственно:
а) 2 и 7; б) 8 и 18; в) 18 и 32; г) 8 и 32.
Установите соответствие
| 5. Э л е м е н т 1) Углерод. 2) Аргон. 3) Скандий. 4) Бром. | Положение в периодической системе химических элементов Д.И.Менделеева а) 2-й период, 2 ряд, IV группа, главная подгруппа. б) 4-й период, 5 ряд, VII группа, главная подгруппа. в) 3-й период, 3 ряд, VIII группа, главная подгруппа. г) 4-й период, 4 ряд, III группа, побочная подгруппа. д) 3-й период, 3 ряд, VIII группа, побочная подгруппа. |
Ответ.
| 1 | 2 | 3 | 4 |
| 6. Ряд элементов 1) H, Li, Na, K, Rb, Cs, Fr. 2) Cu, Ag, Au. 3) Li, Be, B, C, N, O, F, Ne. 4) He, Ne, Ar, Kr, Xe, Rn. | Положение в периодической системе химических элементов Д.И.Менделеева а) I группа, главная подгруппа. б) I группа, побочная подгруппа. в) 2-й период, 2-й ряд. г) VII группа, побочная подгруппа. д) VIII группа, главная подгруппа. |
Ответ.
| 1 | 2 | 3 | 4 |
ЧАСТЬ А
1. Запишите определения:
химическая формула – ………………………………………………………………………..
……………………………………………………………………………………………………
относительная атомная масса – ……………………………………………………………….
……………………………………………………………………………………………………
относительная молекулярная масса – ……………………………………………………….
……………………………………………………………………………………………………
2. Заполните пропуски в следующих предложениях.
Химические формулы отражают …………. состав и состав. ………….…………. состав показывает
……………………………………………………………….……………………………………
…………………………………………………………………………………………………...
................ состав показывает …………………………………………………………………….
……………………………………………………………………………………………………
Например, формула H2SO4 означает ……………………………………………………………
……………………………………………………………………………………………………
……………………………………………………………………………………………………
ЧАСТЬ Б
У р о в е н ь 1
1. Дайте характеристику следующим веществам, руководствуясь планом (приведенным ниже).
Углекислый газ CO2
1) Формула вещества: ………………………………………...………….......................
2) Качественный состав: ………………………………………...…………....................
3) Количественный состав: ………………………………………...………….................
4) Тип вещества по составу: ………………………………………...………..................
5) Mr = ………………………………………...………..................................................
6) Соотношение масс элементов в веществе: ……………………………………….....
7) Массовые доли каждого элемента в данном веществе:...................................
Метан СН4
1) Формула вещества: ………………………………………...………….......................
2) Качественный состав: ………………………………………...…………....................
3) Количественный состав: ………………………………………...………….................
4) Тип вещества по составу: ………………………………………...…………...............
5) Mr = ………………………………………...…………...............................................
6) Соотношение масс элементов в веществе: ……………………………………….....
7) Массовые доли каждого элемента в данном веществе: ………………................
Сода Na2CO3
1) Формула вещества: ………………………………………...…………........................
2) Качественный состав: ………………………………………...………….....................
3) Количественный состав: ………………………………………...………….................
4) Тип вещества по составу: ………………………………………...………..................
5) Mr = ………………………………………...…………...............................................
6) Соотношение масс элементов в веществе: ……………………………..................
7) Массовые доли каждого элемента в данном веществе:………………….............
Гашеная известь Са(ОН)2
1) Формула вещества: ………………………………………...………........….................
2) Качественный состав: ………………………………………...………….......................
3) Количественный состав: ………………………………………...……….…..................
4) Тип вещества по составу: ………………………………………...………….................
5) Mr = ………………………………………...………….................................................
6) Соотношение масс элементов в веществе: ……………………………....................
7) Массовые доли каждого элемента в данном веществе: …………………...............
У р о в е н ь 2
Сахароза С12Н22О11
1) Формула вещества: ………………………………………...………….........................
2) Качественный состав: ………………………………………...…………......................
3) Количественный состав: ………………………………………...……….…..................
4) Тип вещества по составу: ………………………………………...………….................
5) Mr = ………………………………………...………….................................................
6) Соотношение масс элементов в веществе: ………………………………................
7) Массовые доли каждого элемента в данном веществе: ……………………..........
ЧАСТЬ В. Задания для самоконтроля
Обведите кружком правильный ответ.
1. Формула вещества, в состав молекулы которой входит
в а р и а н т I – один атом калия, один атом азота, три атома кислорода;
в а р и а н т II – один атом калия, один атом азота, два атома кислорода:
а) Сa(NO3)2; б) KNO2; в) KNO3; г) K3N.
2. Приведенные записи
в а р и а н т I – 4О и 4О2;
в а р и а н т II – 3N2 и 3N
означают:
а) 4 молекулы и 4 атома кислорода;
б) 4 атома и 4 молекулы кислорода;
в) 3 атома и 3 молекулы азота;
г) 3 молекулы и 3 атома азота.
3. В строке приведены формулы
в а р и а н т I – простых веществ;
в а р и а н т II – сложных веществ:
а) H2, H2O, O2, NO;
б) N2, Cu, O3, O2;
в) Cu2O, CuO, N2, Al;
г) NH3, C2H2, CO2, CaO.
4. Ряд веществ, в которых относительная атомная масса
в а р и а н т I – увеличивается;
в а р и а н т II – уменьшается:
а) S, Si, Al, Na;
б) Be, C, O, Ne;
в) S, Cl, N, Ar;
г) Na, Li, B, H.
5. Атом
в а р и а н т I – кремния;
в а р и а н т II – серы
тяжелее атома водорода в:
а) 14 раз; б) 28 раз; в) 32 раза; г) 16 раз.
6. Относительная молекулярная масса
в а р и а н т I – этана С2Н6;
в а р и а н т II – этилена С2Н4
равна:
а) 18; б) 32; в) 28; г) 30.
АТОМЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
ЧАСТЬ А
1. Какие частицы входят в состав атома? Укажите их характеристики (заряд, массу)
……………………………………….........................................………….........................
2. Дайте определение:
изотопы – ………………………………………...…………..............................................;
орбиталь – ………………………………………...………….............................................
ЧАСТЬ Б
У р о в е н ь 1
3. Заполните таблицу (табл. 6).
Таблица 6
| Порядковый номер | Знак элемента | Заряд ядра | Число протонов | Число нейтронов | Число электронов | Относительная атомная масса |
| 8 | О | +8 | 8 | 16 – 8 = 8 | 8 | 16 |
| F | ||||||
| 11 | ||||||
| Ar | ||||||
| 19 |
4. Определите число элементарных частиц для атомов элементов № 7, 23, 4, 25 по образцу:

…………………………………………..……………………...............
5. Запишите план, которым следует руководствоваться при составлении схем электронного строения атома.
…………………………………………..…………………………………
…………………………………………..…………………………………
…………………………………………..…………………………………
…………………………………………..…………………………………
…………………………………………..………………………………...
6. Составьте схемы электронного строения атомов первых двадцати химических элементов. Подчеркните внешний энергетический уровень и определите число электронов на нем.
| № 1 | № 8 | № 15 |
| № 2 | № 9 | № 16 |
| № 3 | № 10 | № 17 |
| № 4 | № 11 | № 18 |
| № 5 | № 12 | № 19 |
| № 6 | № 13 | №20 |
| № 7 | № 14 |
У р о в е н ь 2
7. Запишите электронные и электронно-графические формулы атомов первых двадцати химических элементов.
| № 1 | № 2 |
| № 3 | № 4 |
| № 5 | № 6 |
| № 7 | № 8 |
| № 9 | № 10 |
| № 11 | № 12 |
| № 13 | № 14 |
| № 15 | № 16 |
| № 17 | № 18 |
| № 19 | № 20 |
ЧАСТЬ В
Обведите кружком правильный ответ.
1. Число энергетических уровней и число электронов на внешнем энергетическом уровне в атоме
в а р и а н т I – бора;
в а р и а н т II – алюминия:
а) 2 и 2; б) 2 и 3; в) 3 и 2; г) 3 и 3.
Дополните предложения.
2. Заряд ядра, число протонов в ядре и число электронов в атоме.................................
3. Порядковый номер химического элемента показывает.................................
4. Число энергетических уровней в атоме равно.................................
5. Заряд ядра атома
в а р и а н т I – лития равен...................................;
в а р и а н т II – аргона равен.................................
6. Число электронов на внешнем энергетическом уровне в атомах элементов главных подгрупп равно........................................................
7. Уровень, на котором находится максимально допустимое число электронов, называется.................................
8. Разновидность атомов одного и того же химического элемента с одинаковым зарядом ядра, но с разной относительной атомной массой называется.................................
9. 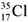 и
и 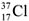 – это.................................
– это.................................
10. Ядро атома
в а р и а н т I – 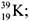
в а р и а н т II – 
содержит: ………. p и ……. n.
11. В атоме
в а р и а н т I – азота;
в а р и а н т II – фтора:
…… энергетических уровней и..... электронов на внешнем уровне.
Обведите кружком правильный ответ.
12. Выявите
в а р и а н т I – сходство;
в а р и а н т II – различие
в составе атомов изотопов.
а) разное число нейтронов;
б) одинаковое число протонов и электронов;
в) одинаковое число нейтронов;
г) разное число протонов.
13. Распределение электронов по уровням
в а р и а н т I – 2, 8, 4;
в а р и а н т II – 2, 2
соответствует атому:
а) бора; б) бериллия; в) углерода; г) кремния.
14. Максимальное число электронов на внешнем уровне
в а р и а н т I – 5;
в а р и а н т II – 8
содержат атомы элементов:
а) F и Cl; б) N и Р; в) Ne и Ar; г) Р и S.
15. Химический элемент 3-го периода образует оксид
в а р и а н т I – Э2О5;
в а р и а н т II – ЭО2.
Распределение электронов в атоме этого элемента:
а) 2, 8, 3; б) 2, 8, 4; в) 2, 8, 5; г) 2, 8, 6.
16. Химический элемент расположен
в а р и а н т I – во 2-м периоде IIIа группе;
в а р и а н т II – во 2-м периоде Vа группе.
Распределение электронов в атоме этого элемента:
а) 2, 8, 3; б) 2, 3; в) 2, 5; г) 2, 6.
17. Распределение электронов в атоме элемента:
в а р и а н т I – 2, 8, 7;
в а р и а н т II – 2, 8, 5.
Формулы высшего оксида и летучего водородного соединения для этого элемента соответственно:
а) ЭО3 и Н2Э; б) Э2О7 и НЭ; в) ЭО2 и Н4Э; г) Э2О5 и Н3Э.
18. Число протонов
в а р и а н т I – наименьшее;
в а р и а н т II – наибольшее
содержится в ядре атома:
а) гелия; б) хлора; в) натрия; г) водорода.
Установите соответствие.
| 19. Конфигурация внешнего уровня 1) 3 s 2. 2) 2 s 22 p 4. 3) 2 s 1. 4) 3 s 23 p 3. | Атом элемента а) Литий. б) Магний. в) Кислород. г) Фосфор. |
Ответ.
| 1 | 2 | 3 | 4 |
| 20. Формула высшего оксида 1) Э2О. 2) ЭО3. 3) Э2О3. 4) ЭО2. | Конфигурация внешнего уровня а) ns 2 np 4. б) ns 2 np 1. в) ns 1. г) ns 2 np 2. |
Ответ.
| 1 | 2 | 3 | 4 |
5. Периодическая система химических элементов Д.И.Менделеева
в свете представлений о строении атома
Подведение итогов
1. Дайте формулировку периодического закона Д.И.Менделеева 1869 г.:
.................................................................................................................
.................................................................................................................
................................................................................................................
Современная формулировка:
.................................................................................................................
.................................................................................................................
................................................................................................................
2. В пределах периодов с увеличением порядкового номера:
а) число электронов на внешнем уровне атомов элементов..........................................
б) число энергетических уровней...................................................................................
в) радиус атома.............................................................................................................
г) металлические свойства.............................................................................................
д) неметаллические свойства.........................................................................................
3. В пределах главных подгрупп:
а) число электронов на внешнем уровне атомов элементов.............................................
б) число энергетических уровней....................................................................................
в) радиус атома...............................................................................................................
г) металлические свойства...............................................................................................
д) неметаллические свойства............................................................................................
4. Число электронов на внешнем энергетическом уровне атомов элементов:
а) в периодах...................................................................................................................
б) в главных подгруппах....................................................................................................
5. Напишите, что общего в строении атомов элементов:
а) углерода и азота............................................................................................................
б) углерода и кремния.......................................................................................................
ХИМИЧЕСКАЯ СВЯЗЬ
ЧАСТЬ А
1. Запишите определения.
Ионы – ………………………………………...…………....................................
Катионы – ………………………………………...…………................................
Анионы – ………………………………………...………….................................
Ионная связь – ………………………………………...…………........................
Ковалентная связь – ………………………………………...…………................
Ковалентная неполярная связь – ………………………………........................
Длина связи – ………………………………………...…………...........................
Энергия связи – ………………………………………...…………........................
Ковалентная полярная связь – ………………………………………...................
Электроотрицательность – ………………………………………...…....................
Металлическая связь – ………………………………………...…………..............
2. Используя материал учебника, кратко сформулируйте алгоритмы для записи схем образования следующих видов химических связей. Каждый алгоритм подкрепите примерами.
Ионная связь
…………………………………………………………………………………………………………
Ковалентная неполярная связь
…………………………………………………………………………………………………………
Ковалентная полярная связь
………………………………………………………………………………………………………...
3. Сравните различные виды химических связей. Для этого заполните таблицу (табл. 7).
Таблица 7
| Признаки для сравнения | Типы химических связей | |||
| Ионная связь | Ковалентная | Металлическая | ||
| неполярная | полярная | |||
| Природа химических элементов, участвующих в образовании связи. | ||||
| Способ образования связи | ||||
| Пример | ||||
ЧАСТЬ Б
У р о в е н ь 1
4. Среди перечисленных ниже формул веществ выпишите отдельно те, в молекулах которых связь: а) ковалентная неполярная; б) ковалентная полярная; в) ионная.
NH3, Cl2, CaCl2, O2, H2, CH4, KF, F2, OF2, N2, H2S, H2O, Na2O.
а) ……………………………………………………………………
б) ……………………………………………………………………
в) ……………………………………………………………………
5. Напишите схемы образования ионной связи для веществ, формулы которых приведены в задании 4.
……………………………………………..………….……….…….
6. Напишите схемы образования ковалентной неполярной связи для веществ, формулы которых приведены в задании 4.
…………………………………………………...…….…………….
7. Напишите схемы образования ковалентной полярной связи для веществ, формулы которых приведены в задании 4.
…………………………………………...…………….…………….
8. Изобразите схемы превращения атомов в ионы для следующих элементов: а) магний, б) натрий, в) фтор, г) сера, д) литий.
а) ……………………………………………………………………
б) ……………………………………………………………………
в) ……………………………………………………………………
г) ……………………………………………………………………
д) …………………………………………………………………….
У р о в е н ь 2
9. Из каждой строки выберите и выпишите формулы веществ, которые являются лишними. Объясните свой выбор.
а) KCl, NaCl, HF; б) H2O, NaF, LiCl; в) Mg, N2, Cl2;
г) H2S, Cl3N, Li3N, H2O, NH3; д) I2, HCl, PH3, Cl2, O2.
а) ……………………………………………………………………
б) ……………………………………………………………………
в) ……………………………………………………………………
г) ……………………………………………………………………
д) ……………………………………………………………………
10. Путь к вершине химической пирамиды (схема 3) – ионная химическая связь в соединениях.
Схема 3
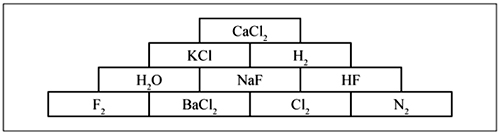
11. Поиграйте в «крестики-нолики». Найдите выигрышный путь, который составляют вещества с ионной связью. Напишите схемы образования связи в этих веществах.
| Na2S | CH4 | Br2 |
| PH3 | KCl | NH3 |
| O2 | H2O | MgO |
…………………………………………………………………….
12. Поиграйте в «крестики-нолики». Найдите выигрышный путь, который составляют вещества с металлической связью.
| Si | Zn | NO |
| S | Au | P |
| NaCl | Cu | H2O |
…………………………………………………………………….
13. Поиграйте в «крестики-нолики». Найдите выигрышный путь, который составляют вещества с ковалентной полярной связью. Напишите схему образования данной химической связи в общем виде.
| NaCl | Si | KI |
| HCl | HF | HI |
| Na | O2 | Cu |
…………………………………………………………………….
14. Поиграйте в «крестики-нолики». Найдите выигрышный путь, который составляют вещества с ковалентной неполярной связью. Напишите схемы образования связи в этих веществах.
| Cl2 | HI | KCl |
| HCl | O2 | Au |
| Na | Cu | N2 |
…………………………………………………………………….
У р о в е н ь 3
15.

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Автоматическое растормаживание колес: Тормозные устройства колес предназначены для уменьшения длины пробега и улучшения маневрирования ВС при...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!