При погружении в воду электродов и подводе к ним достаточного напряжения начинается процесс переноса электрического тока движущимися к электродам ионами в электролите, которым является вода, и электронами во внешней цепи. Под действием электрического поля, положительно заряженные ионы мигрируют к катоду, а отрицательно заряженные ионы - к аноду. На электродах происходит переход электронов. Катод отдает электроны в раствор и в приэлектродном пространстве происходят процессы восстановления. В прианодном пространстве протекают процессы переноса электронов от реагирующих частиц к электроду - окисление.[17]
Устройства, в которых проводят те или иные процессы электрохимического воздействия на водные растворы, имеют общее название - электролизеры. В зависимости от природы процессов, протекающих в таких аппаратах и обеспечивающих извлечение или обезвреживание загрязняющих компонентов, они подразделяются на анодное окисление и катодное восстановление, электрокоагуляцию, электрофлотацию, электродиализ.
Электрохимические методы позволяют извлекать из воды ценные продукты при относительно простой автоматизированной технологической схеме очистки, без использования химических реагентов. Процесс можно проводить периодически и непрерывно. Недостатки методов - большой расход электроэнергии и металла, загрязнение поверхности электродов, что требуют их очистки.
В процессе электрохимической очистки токсичные вещества могут превращаться в нетоксичные или малотоксичные соединения, переходить в газообразное состояние, выпадать в осадок, флотироваться в виде пены, осаждаться на катодах (металлические осадки).
Методом электролиза можно удалять из сточных вод соли, кислоты и щелочи с одновременной их регенерацией. Электрохимические методы очистки сточных вод различных производств (от цианидов, роданидов, нитросоединений, аминов, спиртов, альдегидов, сульфидов, меркаптанов, красителей и др.) основаны на анодном окислении указанных веществ. Катодное извлечение металлической меди применяют на предприятиях цветной металлургии, металлообработки, химической промышленности.
При электролизе сточных вод на катоде выделяется газообразный водород и разряжаются растворенные в воде ионы металлов. На аноде из веществ, не подвергающихся электролитическому растворению, выделяются кислород и галогены, окисляется некоторые присутствующие в сточных водах ионы и молекулы с образованием других ионов и молекул.
Аноды из железа, алюминия к некоторых других металлов под действием постоянного электрического тока растворяются с образованием нерастворимых в воде оксигидратов или основных солей соответствующих металлов, способных к коагуляции.
Эффект очистки электрохимическими методами зависит от исходных свойств сточной воды (рН, температуры, общего содержания солей), а также от применяемых материалов для электродов и расстояния между ними, плотности тока, расхода электроэнергии, наличии диафрагм и их материала, а также интенсивности массообмена (перемешивания) в процессе электролиза.
Применение электрохимических методов целесообразно при относительно высокой электропроводности сточных вод, обусловленной наличием в них неорганических кислот, щелочей или солей (при минимальной концентрации солей, равной 0,5 г/л).
Общая принципиальная схема электролизера представлена на рисунке 2.

Рис. 2 - Схема электролизера: 1 - внешняя цепь; 2 - емкость; 3 - анод; 4 - катод; 5 - источник питания
Метод очистки сточных вод в электролизере с растворимыми электродами называется электрокоагуляцией. Для изготовления анодов используют железо (сталь), алюминий, магний, часто и катоды выполняют из такого же материала, что позволяет повысить ресурс работы аппарата, периодически изменяя полярность электродов (реверс тока). В качестве анода предложено использовать вертикально расположенные перфорированные кассеты из полимерного материала (полипропилена), загруженные отходами металла, например, металлической стружкой, которые добавляют в кассеты по мере ее расходования. Такой анод называют насыпным. Процессы, протекающие в электрокоагуляторах на электродах и в объеме раствора, определяются природой материала электродов, рН раствора и примесей, содержащихся в воде. При наложении электрического поля металлический анод растворяется, на нем выделяются пузырьки кислорода:
Me → Men+ + nе, (1)
Н2O → O2↑ + 4H+ + 2е, (6)
на катоде происходит преимущественно разряд молекул воды и выделение водорода:
Н2O+ 2е → H2↑ + 2ОH- (7)
Выделяющиеся на электродах пузырьки газа флотируют примеси и одновременно с электрокоагуляцией идет процесс электрофлотации.
Перешедшие в воду катионы металла, железа или алюминия, встречаясь с гидроксильными группами, образуют гидроксиды металлов в виде хлопьев, наступает интенсивная коагуляция. Одновременное образование хлопьев коагулянтов и пузырьков газа определяет совместное протекание процессов коагуляции и флотации, поэтому такие установки называются электрокоагуляционно-флотационными. При небольших объемах сточных вод (10-15 м3/ч) установки могут быть однокамерными, при больших - двухкамерными или многокамерными. На процессы электрокоагуляции и электрофлотации оказывает также влияние расстояние между электродами, скорость движения воды между электродами, ее температура и состав, напряжение и плотность тока. С повышением концентрации взвешенных веществ более 100 мг/л эффективность электрокоагуляции снижается. С уменьшением расстояния между электродами уменьшается расход энергии на анодное растворение металла. Степень использования металла электродов составляет 50-90 % и зависит от конструкции коагулятора, материала анода и состава очищаемой воды.
Теоретический расход электроэнергии и плотность тока зависят от материала электродов. Расстояние между электродами не более 20 мм, скорость движения воды между электродами от 0,03 до 0,5 м/с.
Электрокоагулятор обычно представляет собой корпус прямоугольной или цилиндрической формы, в который помещают электродную систему - ряд электродов. Обрабатываемая вода протекает между электродами. Электроды обычно располагаются вертикалью, бывают плоскими и цилиндрическими. С внешней стороны к корпусу крепят две токоподводящие медные шины, которые соединяют с электродами.
Как правило, электрокоагулятор служит только для образования гидроксидов металлов и агрегации частиц; процесс разделения фаз происходит в отстойниках, гидроциклонах и др. Однако есть аппараты, в которых эти процессы совмещены и протекают в одной камере. Электрофлотаторы разделяют по направлению движения воды и флотирующихся газов на прямо- и противоточные, по расположению электродов - на горизонтальные и вертикальные.
Метод электрокоагуляции может быть применен для обработки сточных вод, содержащих эмульгированные частицы масел, жиров и нефтепродуктов, хроматы, фосфаты, некоторые полимеры, тяжелые металлы и др. Реакция среды при этом должна быть нейтральной или слабощелочной. Эффективность очистки от масел 54-68 %, от жиров 92-99 %. На рисунке 3 приведена технологическая схема установки очистки сточных вод электрокоагуляцией, когда часть скоагулированных примесей флотируется, другая осаждается; осветленная вода используется в оборотной системе водоснабжения.
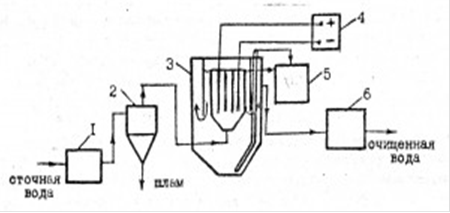
Рис. 3 - Электрокоагуляционная установка для очистки сточных вод от нефтепродуктов: 1-фильтр; 2-гидроциклон; 3-электрокоагулятор-отстойник; 4-источник тока; 5-сборник; 6-фильтр
Электрохимическое окисление и восстановление
Анодное окисление и катодное восстановление составляют основу процесса электролиза, происходящего в электролизере. Электрохимическую обработку целесообразно применять при очистке концентрированных органических и неорганических загрязнений и небольших расходах сточных вод. При этом из воды могут быть удалены цианиды, роданида, амины, спирты, альдегиды, нитросоединения, сульфиды, меркаптаны, ионы тяжелых металлов РЬ2+, Sn2+, Нg2+, Cr2+, Сu2+, As2+ и др. В процессах электрохимического окисления вещества, находящиеся в сточной воде, полностью распадаются с образованием CO2, NH3 и воды или образуют простые и нетоксичные вещества, которые можно удалить другими методами. При электрохимическом восстановлении на катоде могут быть рекуперированы металлы.[17]
В качестве анодов используют различные электролитически нерастворимые материалы: графит, магнетит, диоксиды свинца, марганца и рутения, которые наносятся на титановую основу. В качестве катодов обычно применяют легированную сталь, сплавы вольфрама с железом или никелем, цинк, свинец. На аноде протекает реакция электрохимического окисления, на катоде идет реакция восстановления. Кроме основных процессов электроокисления и восстановления, одновременно могут протекать электрофлотация, электрофорез, электрокоагуляция.
Чтобы предотвратить смешение продуктов электролиза, особенно газов, которые могут образовывать взрывоопасные смеси (водорода и кислорода), применяют керамические, полиэтиленовые, асбестовые и стеклянные диафрагмы, разделяющие катодное и анодное пространство.
Процесс анодного окисления осуществляется в электрлитических ваннах, разделенных на несколько отсеков, в которых обрабатываемые воды перемешиваются сжатым воздухом. При электролизе щелочных вод, содержащих цианиды, на аноде происходит окисление цианид-ионов с образованием цианат-ионов и дальнейшим их электрохимическим окислением до конечных продуктов:
СN- + 2OH- - 2е →CNO- + Н2О (8)+ 2Н2О → NH4+ + CO32- (9)+ 4ОН- - 6е →2 СО2+ N2 +2Н2О (10)
В целях повышения электропроводности сточных вод, снижения расхода электроэнергии и интенсификации процесса окисления в сточные воды добавляют минеральные соли.
При этом металлы осаждаются на катоде и могут быть рекуперированы. Реакция восстановления хрома протекает следующим образом:
Сr2О7 +14 Н+ + 12e → 2Сr + 7Н2О (11)
Частицы металла отрываются от катода под действием сил тяжести и оседают в нижнюю часть аппарата.
На процесс электролиза влияет анодная плотность тока, межэлектродное пространство (3 см для анодного окисления), скорость движения воды, рН, конструкция электродов. Различают плоские и объемные электроды. Последние имеют преимущество при проведении процессов извлечения металлов из сильно разбавленных по ионам металла растворов. Объемные электроды бывают пластинчатыми, объемно-пористыми и псевдоожиженными. В электродах первых двух типов раствор проходит через каналы электродов из блока пластин или камеры, заполненной электропроводным материалом. Электроды третьего типа представляют собой подвижные слои электропроводного дисперсного материала (графита, металла), контактирующие с расположенными в объеме слоя токосборниками.[18]
Эффект очистки рассмотренными методами составляет 80-100 %. Локальные установки по электрохимическому окислений и восстановлению применяются на предприятиях машиностроительной, приборостроительной, химической, нефтехимической, целлюлозно-бумажной и других отраслей промышленности.








