В настоящее время электромагнитные колебания изучены в очень широкой области спектра, энергия квантов меняется от 0 до GeV (109 eV). На рис.1 приведена часть спектра в области от 10-9 до 106 eV, что соответствует длинам волн l = 103-10-12 m или частотам n = 105-1020 (s-1 = Hz).
1) Глаз видит лишь очень узкую область спектра 380-760 nm (3,26-1,63 eV).
l ‑ это расстояние между соседними пиками волн, а частота
n характеризует число пиков волн, которые проходят через фиксированное место за 1 s. Фотон, квант электромагнитной волны, переносит энергию
h n, ее обычно выражают в [eV]. Фотону с длиной волны
l = 1239,8 nm соответствует энергия
h n = 1 eV [
n = c/ l ].
2) Область l = 380-190 nm (h n = 3,25-6,5 eV) обычно называют ультрафиолетовой (УФ) областью спектра.
3) При больших h n воздух уже не пропускает свет и область l = 180-31 nm (h n = 6,8-40 eV) называют областью вакуумного ультрафиолета (ВУФ). Изучение такой энергии может распространяться только в вакууме.
4) При h n > 40 eV приходится изменять конструкцию спектральных проборов, т.к. при падении света с такими короткими l практически нет отражения света при нормальном падении (прибор с так называемым скользящим падением). Область 40 eV ‑ 20 keV – это область мягкого рентгеновского излучения (soft Х-ray), а еще большие h n > 20 keV соответствуют широко используемым медиками рентгеновским лучам, испускаемым при торможении электронов в твердом теле или при возбуждении электронов внутренних оболочек тяжелых атомов.
5) Область 105-107 eV (~1019-1021 Hz) - соответствует g-излучению, возникающему при переходах в ядрах атомов в результате различных ядерных реакций. (В противоположной к g-излучению области спектра находятся радиоволны, обусловленные колебаниями свободных зарядов).
Очень важно иметь источники излучения, охватывающие как можно более широкую область спектра электромагнитных волн. В последние 30 лет очень широко используется синхротронное излучение, которое простирается от далекой ИК области (1 meV) до рентгеновской области спектра (105 eV). История открытия синхротронного излучения достаточно интересна. В середине ХХ века активно строили различные конструкции ускорителей электронов, позитронов, протонов и старались максимально ускорить частицы (т.е. достичь высоких энергий). Но оказалось, что разгон частиц до скоростей близких к скорости света не привел к росту энергии частиц. Релятивистские частицы испускали сильное излучение и таким образом теряли энергию. С этим излучением специалисты в физике больших энергий боролись, но оказалось, что его можно использовать для других целей. Ускорение частиц обычно происходит в вакуумированных металлических установках и "вредного" для ускорения частиц излучения долго просто не видели. Но один из любознательных инженеров просверлил отверстие в стенке установки и вакуумно плотно закрыл его кварцевым окошком. Вот через это окошко он и увидел сильнейшее свечение во всей видимой области спектра, а затем свечение зарегистрировали и в ИК, УФ и ВУФ областях спектра. Как я уже сказал, сейчас строят специальные ускорители электронов (или позитронов), которые являются идеальными источниками излучения со сплошным спектром в необычайно широком диапазоне.
Коротковолновое излучение (большие h n) используется для изучения топографии клеток живых организмов, бактерий (их размер на 2 порядка меньше), вирусов (еще на 1 порядок меньше), вплоть до отдельных молекул. Кстати, в недалеком прошлом ученые были заняты микроэлектроникой, в которой размеры элементов электрических устройств на твердом теле достигали 1 mm = 10-6 m, а сейчас стоит проблема разработки электрических устройств с элементами ~ 100-10 nm, т.е. переходим к эре наноэлектроники. Фундаментальная наука уже давно интересуется и процессами, развивающимися в областях 3-0,3 nm.
 Теперь вернемся к теме этого раздела – спектрам поглощения твердотельных материалов, широко используемых в качестве оптических (люминесцентных) детекторов и дозиметров радиации. Поглощение определяется законом Бугера, который в упрощенном виде можно записать:
Теперь вернемся к теме этого раздела – спектрам поглощения твердотельных материалов, широко используемых в качестве оптических (люминесцентных) детекторов и дозиметров радиации. Поглощение определяется законом Бугера, который в упрощенном виде можно записать:
I = I 0 e-kd, или I = I 0 10-kd/2,3 (2)
где k – коэффициент поглощения (причем k = k (l), а d – толщина слоя). При малых оптических плотностях (k d –оптическая плотность), когда k d << 1, выражение упрощается I = I 0(1 ‑ k d).
 При измерении спектра поглощения диэлектрических кристаллов в широкой области в идеальном случае имеем дело с величинами k от 0 до 107 cm-1. На рис.2 схематически изображен спектр типичного бинарного (т.е. M+X-) ионного кристалла, построенного из положительных ионов (например, K+) – катионов и отрицательных ионов (например, F-) – анионов. По оси абсцисс отложена энергия поглощаемых фотонов (энергию принято выражать в электрон-вольтах), а по оси ординат – коэффициента k из закона Бугера (3). Отличительной чертой типичного диэлектрика (изолятора) является широкая область (от десятка meV до почти 10 eV), где поглощение практически отсутствует – фотоны с такой энергией беспрепятственно проходят сквозь кристалл и соответствующую область спектра называют областью прозрачности кристалла.
При измерении спектра поглощения диэлектрических кристаллов в широкой области в идеальном случае имеем дело с величинами k от 0 до 107 cm-1. На рис.2 схематически изображен спектр типичного бинарного (т.е. M+X-) ионного кристалла, построенного из положительных ионов (например, K+) – катионов и отрицательных ионов (например, F-) – анионов. По оси абсцисс отложена энергия поглощаемых фотонов (энергию принято выражать в электрон-вольтах), а по оси ординат – коэффициента k из закона Бугера (3). Отличительной чертой типичного диэлектрика (изолятора) является широкая область (от десятка meV до почти 10 eV), где поглощение практически отсутствует – фотоны с такой энергией беспрепятственно проходят сквозь кристалл и соответствующую область спектра называют областью прозрачности кристалла.
В области энергий фотонов больших чем 10 eV коэффициент поглощения резко возрастает и достигает величин 106 cm-1. Это означает, что падающий на кристалл фотон поглощается в тонком слое d» 10-6 cm (согласно ф-ле Бугера на этой глубине поток I ослабляется в e -раз). Эта область больших значений k называется фундаментальным поглощением (или собственным). В бинарных ионных кристаллах фундаментальное поглощение связано с возбуждением и ионизацией электронов на внешних электронных оболочках анионов и катионов. Для ионов F- эти процессы начинаются около 10 eV, для ионов K+ ‑ около 20 eV. При больших h n (в рентгеновской области спектра) осуществляется возбуждение и ионизация внутренних (т.е. более близких к ядру) электронных оболочек анионов и катионов.
Поглощение в области малых h n связано с возбуждением фотонами оптических и акустических колебаний ионов. В этой области спектра величины k значительно меньше. Дело в том, что соотношение между величинами k в случае возбуждения легких электронов или при возбуждении колебаний тяжелых ионов определяется соотношением ~ m / M (где m - масса электрона, а M – иона).
Отметим, что если кристалл не идеален и часть ионов заменена примесными анионами или катионами, то это находит свое отражение в спектре поглощения диэлектрика. Так если K+ заменен примесным Tl+ ионом, который более тяжелый, то в области прозрачности появится новая полоса поглощения, соответствующая возбуждению внешних электронов этих примесных Tl+ ионов. При введении в кристалл легких примесных ионов (например, H-, которые замещают F-) появляется новая полоса поглощения в области возбуждения колебаний ионов (колебания H- осуществляются с несколько большей частотой n, чем F- ионы основного вещества).
Итак, как вы видите, в типичном ионном кристалле – диэлектрике величина k изменяется от 0 до 106-107 cm-1. Обычные стандартные спектрофотометры, которые используются для измерения спектров поглощения, связанных с созданием электронных возбуждений, легко измеряют величины k d £ 4. Толщина монокристаллов, используемых для этой цели, обычно d ³ 0,1 mm. На таких объектах хорошо промеряется поглощение, связанное с примесными электронными возбуждениями, и начало фундаментального поглощения. Однако в области, где k ³ 106 cm-1 приходится работать с очень тонкими слоями материала (d ~ 1 mm), получаемые методом сублимации на прозрачную подложку. Другой вариант: измеряют спектр отражения электромагнитных волн от поверхности диэлектрика. Величина R = I R / I o легко измеряема (отношение интенсивности отраженного света к интенсивности падающего света). А затем полученные данные R = R(h n) обрабатывают по разработанным методикам и вычисляют спектр поглощения (о дисперсионных соотношениях Крамерса-Кронига, используемых для этой цели мы поговорим несколько позже).
Структура кристаллов
Геометрически правильная форма кристаллов, образующихся в природных и лабораторных условиях, еще в 17 веке натолкнула ученых на мысль, что кристаллы образуются посредством регулярного повторения в пространстве одного и того же структурного элемента. Сейчас мы знаем, что такими элементарными кирпичиками являются атомы и группы атомов. Кристаллы состоят из атомных рядов, периодически повторяющихся в пространстве и образующих кристаллическую решетку.
Итак, идеальный кристалл можно построить путем бесконечного закономерного повторения в пространстве одинаковых структурных единиц. В наиболее простых кристаллах, например, кристаллах меди, серебра, золота, кристаллах щелочных металлов структурная единица состоит из одного атома, а в кристаллах более сложных веществ структурная единица может содержать несколько атомов или молекул. В кристаллах неорганических веществ структурная единица может содержать до 100 атомов или молекул, а в белковых кристаллах – до 104. Кристалл может состоять из атомов нескольких химических элементов (NaCl) или содержать связанные группы одинаковых атомов (например, кристалл H2).
Идеальный кристалл определим как тело, состоящее из атомов, расположенных в пространственной решетке так, что можно ввести три вектора основных трансляций  . При рассмотрении этой атомной решетки из произвольной точки
. При рассмотрении этой атомной решетки из произвольной точки  решетка имеет тот же вид, что и при рассмотрении из точки
решетка имеет тот же вид, что и при рассмотрении из точки  :
:
 , (3)
, (3)
где n1, n2 и n3 – произвольные числа. Совокупность точек  , определяемая соотношением (3) при разных значениях n 1, n 2 и n 3, определяет кристаллическую решетку – регулярное периодическое расположение точек в пространстве. Кристаллическая решетка является математической абстракцией и реальная кристаллическая структура образуется лишь тогда, когда с каждой точкой решетки однозначно связана некоторая группа атомов – так называемый базис. Таким образом, логично написать, что решетка + базис = кристаллическая структура ( см. рис.3 ).
, определяемая соотношением (3) при разных значениях n 1, n 2 и n 3, определяет кристаллическую решетку – регулярное периодическое расположение точек в пространстве. Кристаллическая решетка является математической абстракцией и реальная кристаллическая структура образуется лишь тогда, когда с каждой точкой решетки однозначно связана некоторая группа атомов – так называемый базис. Таким образом, логично написать, что решетка + базис = кристаллическая структура ( см. рис.3 ).
 Операцию перемещения кристалла параллельно самому себе, описываемую вектором
Операцию перемещения кристалла параллельно самому себе, описываемую вектором  , называют трансляцией. Вектор трансляций кристаллической решетки связывает любые две точки решетки.
, называют трансляцией. Вектор трансляций кристаллической решетки связывает любые две точки решетки.
Отметим, что кристаллическая решетка называется примитивной, а вектора  – векторами примитивной трансляции, если две любые точки
– векторами примитивной трансляции, если две любые точки  и
и  , при наблюдении из которых атомное расположение имеет одинаковый вид, всегда удовлетворяют соотношение (3) при соответствующем выборе целых чисел n1, n2 и n3. Периодически повторяющаяся в пространстве элементарная часть кристаллической решетки в виде параллелепипеда называют элементарной ячейкой. Посредством соответствующих операций трансляций с помощью элементарной ячейки можно заполнить все пространство кристаллической структуры.
, при наблюдении из которых атомное расположение имеет одинаковый вид, всегда удовлетворяют соотношение (3) при соответствующем выборе целых чисел n1, n2 и n3. Периодически повторяющаяся в пространстве элементарная часть кристаллической решетки в виде параллелепипеда называют элементарной ячейкой. Посредством соответствующих операций трансляций с помощью элементарной ячейки можно заполнить все пространство кристаллической структуры.
 Формы кристаллов чрезвычайно разнообразны, их изучением занимается наука кристаллография. Важнейшим геометрическим свойством кристаллов, кристаллических решеток и их элементарных ячеек является симметрия по отношению к определенным направлениям (осям) и плоскостям. Число возможных видов симметрии ограничено. В середине 19 века французский кристаллограф Бравэ математическим путем показал, что в зависимости от соотношения величины и взаимной ориентации ребер элементарной кристаллической ячейки может существовать 14 типов кристаллических решеток (так называемые решетки Бравэ). Решетки Бравэ можно разделить на 7 групп (сингоний), причемв некоторых сингониях
Формы кристаллов чрезвычайно разнообразны, их изучением занимается наука кристаллография. Важнейшим геометрическим свойством кристаллов, кристаллических решеток и их элементарных ячеек является симметрия по отношению к определенным направлениям (осям) и плоскостям. Число возможных видов симметрии ограничено. В середине 19 века французский кристаллограф Бравэ математическим путем показал, что в зависимости от соотношения величины и взаимной ориентации ребер элементарной кристаллической ячейки может существовать 14 типов кристаллических решеток (так называемые решетки Бравэ). Решетки Бравэ можно разделить на 7 групп (сингоний), причемв некоторых сингониях
может быть несколько элементарных ячеек: примитивная (P), объемноцентрированная (I), гранецентрированная (F) и базоцентрированная (C) [см. рис.4].
Сингонии: 1) триклинная (P), 2) моноклинная (P,C), 3) ромбическая (P,C,I,F), 4) тетрагональная (P), 5) кубическая (P,I,F), 6) тригональная (P, но обычно обозначают R) и 7) гексагональная (P). Эти сингонии показаны на рис.4. Дальнейшее развитие кристаллографии показало, что с использованием различных сочетаний операций симметрии можно математически вывести 230 пространственных групп – это 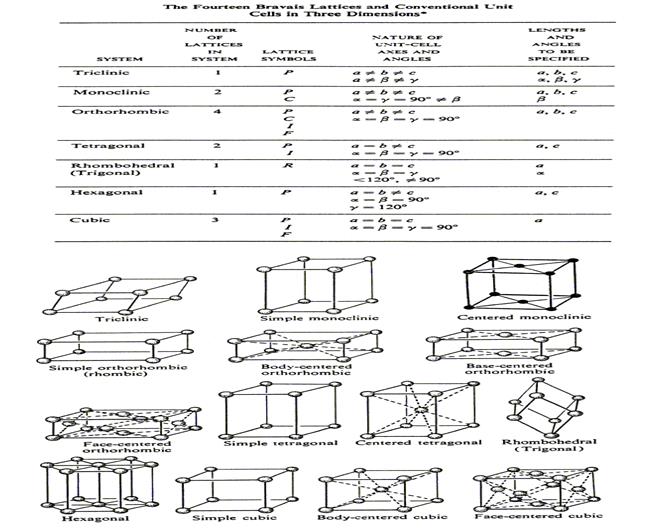 дает строгая теория структуры кристаллов.
дает строгая теория структуры кристаллов.
На следующем рис.5 приведены кристаллические структуры NaCl и CsCl – это кубические кристаллы, причем решетка Бравэ NaCl – гранецентрированная, а CsCl – простая кубическая. Важным параметром, характеризующим решетку, является
координационное число, определяемое как число атомов, являющихся ближайшими соседями данного атома. В NaCl координационное число 6, в CsCl – 8 (причем ближайшие соседи – ионы другого сорта).

Забегая вперед, скажу, что теория строения кристаллов, образованных из упорядоченного коллектива взаимодействующих атомов, основана на принципах квантовой механики, термодинамики и статистической физики, физике твердого тела. Однако результат сложных взаимодействий оказывается геометрически удивительно прост – возникает трехмерно-периодическая структура, в элементарной ячейке которой атомы имеют фиксированные положения равновесия, находясь на определенном расстоянии друг от друга. Даже само по себе рассмотрение этой геометрии, безотносительно к физическим причинам, дает многое для понимания закономерностей атомного строения кристаллов. В геометрической модели кристалла рассматривается расположение структурных единиц кристалла, расстояния между ними, их взаимная координация (окружение), углы между наиболее заполненными атомными плоскостями. Атомы, расположенные в невозбужденном состоянии, можно примерно моделировать сферами, а молекулы – системами более сложной формы (тетраэдры, октаэдры и т.д.) и рассматривать упаковки этих сфер или более сложных структурных единиц. Геометрическая модель кристалла – это предельное упрощение физической модели, когда рассматривается расположение положений равновесия (узлов) сферических атомов или более сложных молекулярных единиц.
Математическую абстракцию – кристаллическую решетку – мы коротко рассмотрели. Теперь сделаем следующий шаг: положения равновесия (математические точки) заполним реальными атомами, ионами, молекулами, молекулярными ионами и т.д. – чтобы реальная структура кристаллов разных типов стала для вас понятной в первом приближении, и вы могли ее в будущем конкретизировать в зависимости от потребностей своей научной и технической работы.
Но сначала я хочу вам коротко напомнить некоторые положения квантовой механики на базе простейшей системы – атома водорода. Атом водорода – это система "положительное ядро (протон) + отрицательный электрон". С точки зрения квантовой механики электрон обладает как корпускулярными, так и волновыми свойствами. Возможны только те энергетические состояния в водороде, при которых при движении электрона вокруг ядра образуются стоячие электронные волны (это условие устойчивости орбиты), описываемые волновой функцией Y (пси). Грубо говоря, ½ Y ½2 – описывает распределение электронной плотности вокруг ядра.
В 1926 г. австрийский физик Эрвин Шредингер предложил уравнение, связывающее энергию системы с ее волновым движением. Ур-е Шредингера обычно записывают:  (4).
(4).
 – оператор Гамильтона, представляет в общем виде кинетическую и потенциальную энергии системы; E – числовые значения энергии для любого значения Y.
– оператор Гамильтона, представляет в общем виде кинетическую и потенциальную энергии системы; E – числовые значения энергии для любого значения Y.
Волновые функции Y, для которых ур-е (4) имеет решение, называют собственными волновыми функциями, а значения энергии, вычисленные из таких решений, собственными значениями. Ур-е Шредингера - сложное дифференциальное ур-е, но для атома водорода его можно решить точно. Решение, т.е. волновая ф-я, состоит из нескольких сомножителей: радиальная и угловая части Y и постоянная нормировки (вероятность нахождения электрона где-либо в пространстве = 1).
Радиальная часть Y, дает вероятность нахождения е - на расстоянии r от ядра. С ней связаны 2 квантовых числа:
1. n – главное квантовое число, определяет среднее расстояние электрона от ядра и его энергию.
2. l – орбитальное квантовое число, характеризует момент количества движения электрона вокруг ядра. l = 0, 1, 2,……, n -1.
С угловой частью волновой функции связано:
3. m l – магнитное квантовое число. Оказывается, что электронная орбита не может занимать произвольное положение к выделенному направлению магнитного поля:
m = ‑ l, ‑ l + 1,...., ‑1, 0, +1,...., l ‑ 1, l (т.е. 2 l + 1 значений).
4. Существует и четвертое квантовое число – спин – характеризует вращение электрона вокруг собственной оси (т.е. дополнительный момент количества движения), s = ±1/2.
Итак, электрон в атоме характеризуется 4 квантовыми числами n, l, m l и s: Y = Y (n, l, m l, s). Для обозначения состояния электрона обычно: n – пишется цифрой; l – обозначается буквой (l = 0, 1, 2, 3..® s, p, d, f …). Из рис.6 видно, что электронное облако для s- состояния (l = 0) имеет сферическую форму, а в случае p и d состояний форма облака более сложная.
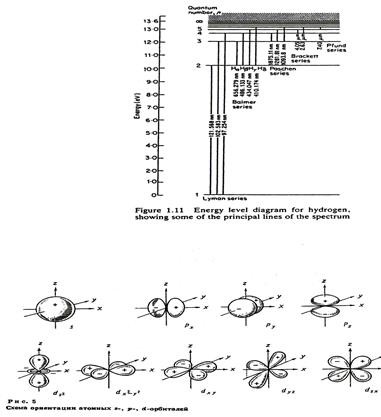 Энергия электрона в атоме водорода зависит лишь от n, но в многоэлектронных атомах энергия зависит и от l. По принципу Паули в атоме не может быть двух электронов, у которых все 4 квантовых числа одинаковы. Если n, l и m l у двух электронов совпадают, то должны отличаться их спины. Именно принцип Паули определяет строение периодической системы элементов, которые Менделеев располагал по возрастающей массе. Теперь ясно, что свойства элемента определяются строением электронной оболочки атома. Отметим, что число электронов, имеющих одинаковые значения n и l (но разные m lи s) записывают в виде показателя степени (т.е. 1 s, 1 s 2, 2 s 1 и т.д.). Причем оболочки заполняются как s 2 (l = 0); p 6 (l = 1); d 10 (l = 2); f 14 (l = 3). Посмотрим на периодическую систему Менделеева: первый элемент H – 1 s, затем He – 1 s 2, Li – 1 s 22 s, Be - 1 s 22 s 2, B – 1 s 22 s 2 p,.... На рис.7 указаны только конфигурации внешних оболочек электронов – именно они определяют в первую очередь основные функции и химические свойства элементов. Важно отметить, что элементы с полностью заполненной внешней оболочкой (например He, Ne, Ar, Kr, Xe, Rn – радон,...) имеют близкую к сферической функцию распределения электронной плотности вокруг ядра (вспомните рис.6) и их можно моделировать шариками.
Энергия электрона в атоме водорода зависит лишь от n, но в многоэлектронных атомах энергия зависит и от l. По принципу Паули в атоме не может быть двух электронов, у которых все 4 квантовых числа одинаковы. Если n, l и m l у двух электронов совпадают, то должны отличаться их спины. Именно принцип Паули определяет строение периодической системы элементов, которые Менделеев располагал по возрастающей массе. Теперь ясно, что свойства элемента определяются строением электронной оболочки атома. Отметим, что число электронов, имеющих одинаковые значения n и l (но разные m lи s) записывают в виде показателя степени (т.е. 1 s, 1 s 2, 2 s 1 и т.д.). Причем оболочки заполняются как s 2 (l = 0); p 6 (l = 1); d 10 (l = 2); f 14 (l = 3). Посмотрим на периодическую систему Менделеева: первый элемент H – 1 s, затем He – 1 s 2, Li – 1 s 22 s, Be - 1 s 22 s 2, B – 1 s 22 s 2 p,.... На рис.7 указаны только конфигурации внешних оболочек электронов – именно они определяют в первую очередь основные функции и химические свойства элементов. Важно отметить, что элементы с полностью заполненной внешней оболочкой (например He, Ne, Ar, Kr, Xe, Rn – радон,...) имеют близкую к сферической функцию распределения электронной плотности вокруг ядра (вспомните рис.6) и их можно моделировать шариками.
Сейчас мы и займемся рассмотрением плотнейших упаковок шаров. Пусть сначала имеем дело с равновеликими шарами одного сорта. С первого взгляда может показаться, что шары одного сорта могут укладываться наиболее плотным образом только по одному способу. В действительности это не так. Если укладку ведем в одном слое, то действительно есть только один способ их плотнейшей упаковки – каждый шар будет окружен в слое 6 ближайшими соседями (см. рис.8). Вокруг каждого шара между ним и его 2 ближайшими соседями имеются треугольные углубления. В проекции – это треугольники (3 из них имеют вершины, направленные вверх, а три 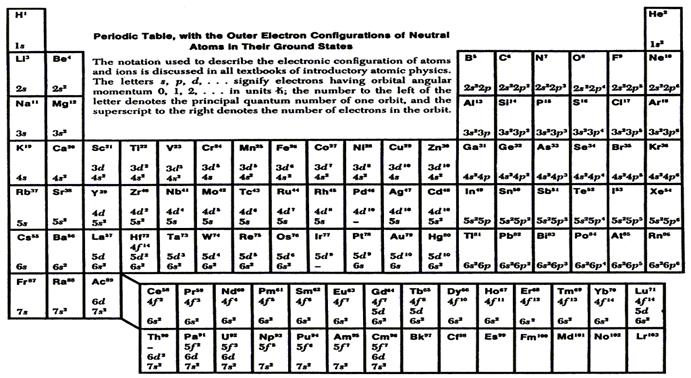 белых – вершинами вниз).
белых – вершинами вниз).
Покрываем такой плотноупакованный слой вторым, также плотноупакованным слоем. Чтобы удовлетворить принципу плотнейшей упаковки, все шары второго слоя должны попасть в углубления между шарами нижнего слоя. Легко видеть (см. рис.8), что это можно сделать двумя аналогичными способами ‑ шары второго слоя попадают в треугольные углубления с вершинами вниз (левый рис.) или вершинами вверх (правый рис.). NB! Оба сорта треугольников на этих рисунках показаны черным! Но оба способа упаковки совершенно равнозначны, так как поворотом на 180º можно первый способ упаковки совместить со вторым. Итак, в случае 2-х слоев тоже имеем только один способ наиболее плотной упаковки.
Рассматривая комбинацию двух плотно упакованных слоев можно заметить, что между слоями возникло два типа совершенно разных пустот. Одни из них расположены между 3 шарами нижнего слоя и лежащими над ними посредине шаром верхнего слоя – это тетраэдрическая пустота. Другой тип пустот образован сквозными отверстиями, проходящими между 3 шарами верхнего и 3 шарами нижнего слоя, т.е. они ограничены 6 шарами и называются октаэдрическими. Эти названия (тетраэдрическая и октаэдрическая пустота) определяют тип геометрической фигуры, образуемой шарами  плотнейшей упаковки вокруг пустот.
плотнейшей упаковки вокруг пустот.
Дальше накладываем третий слой плотноупакованных шариков: здесь уже имеем два существенно отличающихся друг от друга способа. Третий слой можно наложить на второй, помещая шары этого слоя либо в углубления первого типа, либо второго типа. Если шары третьего слоя ложатся в тетраэдрические углубления, то они оказываются точно над шарами первого слоя, повторяя своим расположением этот слой. Мы можем продолжать накладку шаров таким образом и при этом все время будем получать воспроизведение каждого слоя через один (рис.9/217 а). Видно, что каждый 1, 3, 5, 7-й и последующие слои (обозначены буквой А) будут точно также повторять расположение шаров, как 2, 4, 6, 8,... слои (обозначены буквой В). При этом сохраняются сквозные октаэдрические пустоты. Такой тип плотнейшей упаковки равновеликих шаров, когда шары упаковки повторяются через один слой, носит название двухслойной или гексагональной упаковки.
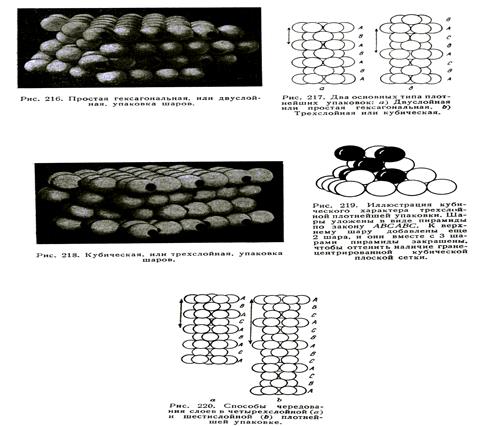 Если же шары третьего слоя ложатся в углубления второго типа (на октаэдрические, сквозные пустоты), то третий слой (он обозначен буквой С) не будет повторением первого или второго. Только четвертый слой может стать повторением первого, а пятый – второго. Имеем тип плотнейшей упаковки, называемый трехслойной или кубический упаковкой. Кубической она называется потому, что только из такой укладки шаров можно выделить кубическую ячейку с центрированными гранями. Отметим, что в кубический упаковке нет сплошных колонок из пустот одного сорта (как в гексагональной упаковке); над тетраэдрической пустотой находится октаэдрическая, и наоборот.
Если же шары третьего слоя ложатся в углубления второго типа (на октаэдрические, сквозные пустоты), то третий слой (он обозначен буквой С) не будет повторением первого или второго. Только четвертый слой может стать повторением первого, а пятый – второго. Имеем тип плотнейшей упаковки, называемый трехслойной или кубический упаковкой. Кубической она называется потому, что только из такой укладки шаров можно выделить кубическую ячейку с центрированными гранями. Отметим, что в кубический упаковке нет сплошных колонок из пустот одного сорта (как в гексагональной упаковке); над тетраэдрической пустотой находится октаэдрическая, и наоборот.
Легко обнаружить, что при наложении четвертого слоя и всех последующих слоев, также как и при наложении третьего слоя, возникает две возможности их укладки: на пустоты первого или второго типа. Поэтому кроме двух разобранных нами плотнейших упаковок можно выложить бесконечное количество более сложных упаковок: примеры 4х-и шестислойных упаковок приведены на рисунке.
Введенные понятия октаэдрических и тетраэдрических пустот (междоузлий) пригодятся нам в последующем изложении курса. Важно отметить, что можно математически показать, что во всех плотнейших упаковках имеется столько же октаэдрических пустот, сколько шаров образует упаковку, и вдвое большее количество тетраэдрических пустот: На N шаров имеем 2 N тетраэдрических (менее крупных) и N октаэдрических (более крупных) пустот. Важно отметить, что объем заполненного шарами пространства в плотнейших упаковках во всех случаях равен 74,05%, а 25,95% пространства приходится на два типа выше рассмотренных междоузлий (пустот).
Я обращаю ваше внимание на чрезвычайно плодотворное (хотя и приближенное) представление о плотнейшей или квазиплотнейшей упаковке нескольких сортов шарообразных ионов в кристаллах. Очень простыми средствами можно получить грубое представление об общих мотивах строения ионных кристаллов, в том числе и сложных, широко используемых в технике.
Большая группа оксидов и сульфидов металлов имеет важные применения в лазерной оптике, светотехнике, детекторах излучений, полупроводниковой электронике. Эти кристаллы состоят из крупных ионов (кислород или сера), имеющих заполненные s 2 p 6 оболочки (приближенно сферические) – они образуют плотнейшую (или довольно плотную) упаковки, а другие кристаллообразующие частицы находятся в тетраэдрических или октаэдрических междоузлиях этой упаковки.
Вообще из простых геометрических соображений следует, что в случае малых катионов, r c/ r a £ 0,41 – катионы занимают малые тетраэдрические пустоты, а если 0,73 > r c/ r a > 0,41, то катионы помещаются в более крупные октаэдрические пустоты.
Например, важный для цветных телевизоров материал ZnS: для радиусов имеем r (Zn2+) = 0,74 Å и r (S2-) = 1,82 Å, т.е. r c/ r a = 0,4 и Zn2+ занимают половину тетраэдрических пустот, а вторая половина тетраэдрических и все октаэдрические междоузлия остаются незаполненными. В важном полупроводниковом материале CdS r c/ r a = 0,6 и Cd2+ занимают октаэдрические пустоты. Интересен случай трехкомпонентной системы MgAl2O4 (шпинель – очень радиационно-стойкий материал, не "распухает" даже в ядерных реакторах). Здесь O2- дают плотнейшую упаковку, Mg2+ занимают октаэдрические пустоты, а Al3+ - тетраэдрические пустоты.
Если r c/ r a > 0,73, то сложно говорить о плотнейшей упаковке анионов, может меняться даже тип решетки. Например, у широко используемого как детектор излучений CsI r c/ r a = 0,87 и имеем объемноцентрированную кубическую решетку, а у его ближайшего аналога NaI: r c/ r a = 0,67 и гранецентрированная решетка (координационное число 6). Если же NaI всесторонне сжать до больших давлений, то r c/ r a увеличится до > 0,73 и тип решетки поменяется на решетку типа CsCl (давление по-разному влияет на ионные радиусы).
В заключение раздела коротко коснемся типов связей, которые удерживают атомы вместе, образуя кристаллическую структуру. Сразу отметим, что эти связи почти полностью обеспечиваются силами электростатического притяжения между электронами и положительно заряженными ядрами. Силы магнитного происхождения весьма незначительны, а гравитационными силами вообще можно пренебречь. Чтобы с помощью сил электростатического притяжения между валентными электронами (это e - с самых внешних оболочек) и ионными остовами образовать из атомов твердые тела, необходимо выполнить следующие условия:
1. Заряженные положительно ионные основы должны находиться друг от друга на таком расстоянии, чтобы кулоновское отталкивание было сведено к минимуму.
2. Валентные электроны должны находится на определенных расстояниях друг от друга, отвечающих тому же требованию.
3. Валентные e - должны быть в то же время настолько близко от ионных остовов, чтобы притяжение между разноименными зарядами было максимальным.
4. В результате выполнения трех вышеперечисленных условий полная энергия системы должна уменьшиться.
 Существование стабильных связей между атомами в кристалле предполагает, что полная энергия кристалла (кинетическая + потенциальная) меньше полной энергии такого же количества свободных атомов (удаленных друг от друга на ¥ расстояние). Разность этих двух энергий называется энергией химической связи или просто энергией связи. По типам связи твердые тела делятся на 4 класса, каждый из которых характеризуется своеобразным пространственным распределением электронов (рис.10): 1) связь за счет сил Ван-дер-Ваальса; 2) ионная связь; 3) ковалентная связь и 4) металлическая связь. Коротко охарактеризуем эти типы связей.
Существование стабильных связей между атомами в кристалле предполагает, что полная энергия кристалла (кинетическая + потенциальная) меньше полной энергии такого же количества свободных атомов (удаленных друг от друга на ¥ расстояние). Разность этих двух энергий называется энергией химической связи или просто энергией связи. По типам связи твердые тела делятся на 4 класса, каждый из которых характеризуется своеобразным пространственным распределением электронов (рис.10): 1) связь за счет сил Ван-дер-Ваальса; 2) ионная связь; 3) ковалентная связь и 4) металлическая связь. Коротко охарактеризуем эти типы связей.
1. Кристаллы инертных газов – это наиболее простые из известных нам кристаллов, здесь определяющими являются силы Ван-дер-Ваальса. Из таблицы Менделеева следует, что внешние оболочки атомов Ne, Ar, Kr, Xe – это p 6, они полностью заполнены и имеют ~ сферическую симметрию. Для кристаллов инертных газов характерна плотная упаковка, они имеют кубическую гранецентрированную решетку. Энергия связи E b мала (на один атом: Ne ‑ 0,02 eV; Ar – 0,08 eV; Kr – 0,116 eV; Xe – 0,17 eV) и составляет £ 1% от энергии ионизации электрона атома E i (Ne ® 21,6 eV; Ar ® 15,8 eV; Kr ® 14,0 eV; Xe ® 12,1 eV). Очень интересно, что температура плавления кристаллов T melt крайне низка (Ne ® 24 K; Ar ® 84 K; Kr ® 117 K и Xe ® 161 K), т.е. кристаллы существуют только в специальных криостатах и их часто называют криокристаллами. Какова же природа сил связи в кристаллах инертных газов? Распределение электронов в атомах кристалла лишь незначительно отличается от распределения электронов в свободных атомах (ведь энергия связи очень маленькая). Это искажение определяется силами Ван-дер-Ваальса.
Пусть имеем 2 атома инертного газа на расстоянии R (сильно больше атомного радиуса) друг от друга. Если бы положение ядра атома всегда совпадало с центром сферического электронного облака, то взаимодействие между атомами = 0 и твердое тело из атомов инертного газа не образовывалось бы – что противоречит эксперименту. Но е - непрерывно движутся и возможно мгновенное несовпадение положения центра электронного облака с ядром – у атома появляется электрический дипольный момент  . Этот дипольный момент создает электрическое поле в центре второго атома
. Этот дипольный момент создает электрическое поле в центре второго атома  . В результате, у второго атома наводится тоже дипольный момент
. В результате, у второго атома наводится тоже дипольный момент  (a – электронная поляризуемость). Из электростатики известно, что два параллельных дипольных момента (а у нас они параллельны) взаимодействует с энергией
(a – электронная поляризуемость). Из электростатики известно, что два параллельных дипольных момента (а у нас они параллельны) взаимодействует с энергией  (5)
(5)
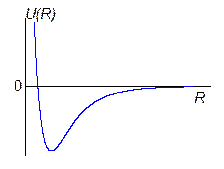 Итак, притяжение параллельных дипольных моментов U(R) = ‑ C/R 6 – это т.н. энергия Ван-дер-ваальсового взаимодействия, которое быстро увеличивается с уменьшением расстояния. Но при уменьшении R между двумя атомами их электронные облака начинают постепенно перекрываться и возникают силы отталкивания (благодаря принципу запрета Паули, т.к. оболочки заполнены). Эти силы отталкивания можно описать экспериментальной формулой ~ B/R 12. Теперь полная потенциальная энергия взаимодействия 2х атомов:
Итак, притяжение параллельных дипольных моментов U(R) = ‑ C/R 6 – это т.н. энергия Ван-дер-ваальсового взаимодействия, которое быстро увеличивается с уменьшением расстояния. Но при уменьшении R между двумя атомами их электронные облака начинают постепенно перекрываться и возникают силы отталкивания (благодаря принципу запрета Паули, т.к. оболочки заполнены). Эти силы отталкивания можно описать экспериментальной формулой ~ B/R 12. Теперь полная потенциальная энергия взаимодействия 2х атомов: 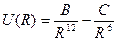 . (5')
. (5')
(5') ‑ это так называемый потенциал Ленарда-Джонса. График этого потенциала описывает взаимодействие двух атомов инертного газа. Если пренебречь кинетической энергией, то величина энергии связи кристалла инертного газа = å (5') для всех пар атомов в кристалле. Далее из d U total/d R = 0 можно найти R 0 – равновесное расстояние между ближайшими соседями в кристалле.
2. Ионные кристаллы. Состоят из позитивных и негативных ионов. Ионы образуют решетку за счет кулоновских взаимодействий, причем нужно, чтобы притяжение между ионами противоположного знака было сильнее, чем кулоновское отталкивание между ионами одного знака. Электронные оболочки ионов простого ионного кристалла аналогичны таковым для атомов инертных газов. Действительно, согласно таблице Менделеева (для LiF, например) имеем электронные оболочки 1 s 22 s для Li и 1 s 22 s 22 p 5 для F, а в кристалле будет Li+ ® 1 s 2 и F- ® 1 s 22 s 22 p 6, т.е. имеем заполненные оболочки с примерно сферической симметрией. На рис.11 видно, что рентгеновские данные подтверждают это ‑ сферическая симметрия несколько нарушается только в области соприкосновения соседних атомов. Величина энергии связи в ионном кристалле NaCl на одну молекулу E b = 7,9 eV, но это относится к ионам Na+ и Cl-. Если же мы стартуем с отдельных нейтральных атомов, то нужно учесть, что для ионизации Na0 ® Na+ + e - нужно затратить 5,14 eV, а выигрыш от присоединения e - к Cl0 определяется величиной электронного сродства c = 3,61 eV. Поэтому по отношению к Cl0 и Na0 выигрыш энергии на одну молекулу NaCl будет: 7,9 – 5,1 + 3,6 = 6,4 eV.
По сравнению с кристаллами инертных газов, энергия связи в ионных кристаллах значительно выше. На больших расстояниях взаимодействие между ионами и зарядами ± q представляет собой кулоновское взаимодействие ± q 2/ R. Притяжение, обусловленное силами Ван-дер-Ваальса, дает малый вклад в энергию связи ионных кристаллов, около 1-2%. Как и в случае кристаллов инертных газов, нужно учесть и силы отталкивания, противодействующие перекрытию электронных оболочек соседних ионов (в основном обусловлены действием принципа Паули). Электрическую энергию (кулоновскую), дающую подавляющий вклад в энергию связи ионных кристаллов, называют энергией Маделунга. Понятно, что ионы образуют такую кристаллическую структуру, чтобы кулоновское притяжение между ионами разного знака превосходило кулоновское отталкивание между ионами одного знака. Типичными представителями ионных кристаллов являются щелочногалоидные кристаллы (ЩГК: Li, Na, K, Rb, Cs – катионы и F, Cl, Br, I - анионы). Кроме CsCl, CsBr и CsI (это простые кубические), ЩГК – это гранецентрированные кубические кристаллы.
3. Ковалентные кристаллы – в них ковалентная связь осуществляется посредством классической электронной связи. В химии ковалентную связь называют гомеополярной. Это сильная связь, энергия связи между двумя атомами углерода в алмазе сравнима с силой связи в ионных кристаллах. Ковалентная связь образуется за счет перекрытия электронных оболочек нейтральных атомов и характеризуется явно выраженным свойством направленности. Так в кристаллах углерода, кремния и германия, имеющих структуру алмаза, каждый атом помещается в центре тетраэдра, образованного 4 атомами, являющимися его ближайшими соседями. С точки геометрии – это "просторная" упаковка атомов в решетке (объем всех атомов дает только 34% от объема кристалла!)
Ковалентная связь образуется двумя электронами, по одному от каждого из соединяющихся атомов. У C, Si и Ge внешние оболочки не заполнены, и перекрытие оболочек происходит без перехода электронов на более высокие энергетические уровни (т.е. в этом случае нет проблем с принципом Паули – как имело место при перекрытии электронных оболочек соседних атомов/ионов в ионных кристаллах и кристаллах инертных газов). Электронная конфигурация углевода C - 1 s 22 s 22 p 2, но перед образованием 4 тетраэдрических ковалентных связей С сначала переходит в 1 s 22 s 2 p 3 (на это требуется 4 eV, но компенсируется с избытков при образовании связей)




 Теперь вернемся к теме этого раздела – спектрам поглощения твердотельных материалов, широко используемых в качестве оптических (люминесцентных) детекторов и дозиметров радиации. Поглощение определяется законом Бугера, который в упрощенном виде можно записать:
Теперь вернемся к теме этого раздела – спектрам поглощения твердотельных материалов, широко используемых в качестве оптических (люминесцентных) детекторов и дозиметров радиации. Поглощение определяется законом Бугера, который в упрощенном виде можно записать: При измерении спектра поглощения диэлектрических кристаллов в широкой области в идеальном случае имеем дело с величинами k от 0 до 107 cm-1. На рис.2 схематически изображен спектр типичного бинарного (т.е. M+X-) ионного кристалла, построенного из положительных ионов (например, K+) – катионов и отрицательных ионов (например, F-) – анионов. По оси абсцисс отложена энергия поглощаемых фотонов (энергию принято выражать в электрон-вольтах), а по оси ординат – коэффициента k из закона Бугера (3). Отличительной чертой типичного диэлектрика (изолятора) является широкая область (от десятка meV до почти 10 eV), где поглощение практически отсутствует – фотоны с такой энергией беспрепятственно проходят сквозь кристалл и соответствующую область спектра называют областью прозрачности кристалла.
При измерении спектра поглощения диэлектрических кристаллов в широкой области в идеальном случае имеем дело с величинами k от 0 до 107 cm-1. На рис.2 схематически изображен спектр типичного бинарного (т.е. M+X-) ионного кристалла, построенного из положительных ионов (например, K+) – катионов и отрицательных ионов (например, F-) – анионов. По оси абсцисс отложена энергия поглощаемых фотонов (энергию принято выражать в электрон-вольтах), а по оси ординат – коэффициента k из закона Бугера (3). Отличительной чертой типичного диэлектрика (изолятора) является широкая область (от десятка meV до почти 10 eV), где поглощение практически отсутствует – фотоны с такой энергией беспрепятственно проходят сквозь кристалл и соответствующую область спектра называют областью прозрачности кристалла. . При рассмотрении этой атомной решетки из произвольной точки
. При рассмотрении этой атомной решетки из произвольной точки  решетка имеет тот же вид, что и при рассмотрении из точки
решетка имеет тот же вид, что и при рассмотрении из точки  :
: , (3)
, (3) Операцию перемещения кристалла параллельно самому себе, описываемую вектором
Операцию перемещения кристалла параллельно самому себе, описываемую вектором  , называют трансляцией. Вектор трансляций кристаллической решетки связывает любые две точки решетки.
, называют трансляцией. Вектор трансляций кристаллической решетки связывает любые две точки решетки. – векторами примитивной трансляции, если две любые точки
– векторами примитивной трансляции, если две любые точки  и
и  Формы кристаллов чрезвычайно разнообразны, их изучением занимается наука кристаллография. Важнейшим геометрическим свойством кристаллов, кристаллических решеток и их элементарных ячеек является симметрия по отношению к определенным направлениям (осям) и плоскостям. Число возможных видов симметрии ограничено. В середине 19 века французский кристаллограф Бравэ математическим путем показал, что в зависимости от соотношения величины и взаимной ориентации ребер элементарной кристаллической ячейки может существовать 14 типов кристаллических решеток (так называемые решетки Бравэ). Решетки Бравэ можно разделить на 7 групп (сингоний), причемв некоторых сингониях
Формы кристаллов чрезвычайно разнообразны, их изучением занимается наука кристаллография. Важнейшим геометрическим свойством кристаллов, кристаллических решеток и их элементарных ячеек является симметрия по отношению к определенным направлениям (осям) и плоскостям. Число возможных видов симметрии ограничено. В середине 19 века французский кристаллограф Бравэ математическим путем показал, что в зависимости от соотношения величины и взаимной ориентации ребер элементарной кристаллической ячейки может существовать 14 типов кристаллических решеток (так называемые решетки Бравэ). Решетки Бравэ можно разделить на 7 групп (сингоний), причемв некоторых сингониях дает строгая теория структуры кристаллов.
дает строгая теория структуры кристаллов.

 (4).
(4). – оператор Гамильтона, представляет в общем виде кинетическую и потенциальную энергии системы; E – числовые значения энергии для любого значения Y.
– оператор Гамильтона, представляет в общем виде кинетическую и потенциальную энергии системы; E – числовые значения энергии для любого значения Y. Энергия электрона в атоме водорода зависит лишь от n, но в многоэлектронных атомах энергия зависит и от l. По принципу Паули в атоме не может быть двух электронов, у которых все 4 квантовых числа одинаковы. Если n, l и m l у двух электронов совпадают, то должны отличаться их спины. Именно принцип Паули определяет строение периодической системы элементов, которые Менделеев располагал по возрастающей массе. Теперь ясно, что свойства элемента определяются строением электронной оболочки атома. Отметим, что число электронов, имеющих одинаковые значения n и l (но разные m lи s) записывают в виде показателя степени (т.е. 1 s, 1 s 2, 2 s 1 и т.д.). Причем оболочки заполняются как s 2 (l = 0); p 6 (l = 1); d 10 (l = 2); f 14 (l = 3). Посмотрим на периодическую систему Менделеева: первый элемент H – 1 s, затем He – 1 s 2, Li – 1 s 22 s, Be - 1 s 22 s 2, B – 1 s 22 s 2 p,.... На рис.7 указаны только конфигурации внешних оболочек электронов – именно они определяют в первую очередь основные функции и химические свойства элементов. Важно отметить, что элементы с полностью заполненной внешней оболочкой (например He, Ne, Ar, Kr, Xe, Rn – радон,...) имеют близкую к сферической функцию распределения электронной плотности вокруг ядра (вспомните рис.6) и их можно моделировать шариками.
Энергия электрона в атоме водорода зависит лишь от n, но в многоэлектронных атомах энергия зависит и от l. По принципу Паули в атоме не может быть двух электронов, у которых все 4 квантовых числа одинаковы. Если n, l и m l у двух электронов совпадают, то должны отличаться их спины. Именно принцип Паули определяет строение периодической системы элементов, которые Менделеев располагал по возрастающей массе. Теперь ясно, что свойства элемента определяются строением электронной оболочки атома. Отметим, что число электронов, имеющих одинаковые значения n и l (но разные m lи s) записывают в виде показателя степени (т.е. 1 s, 1 s 2, 2 s 1 и т.д.). Причем оболочки заполняются как s 2 (l = 0); p 6 (l = 1); d 10 (l = 2); f 14 (l = 3). Посмотрим на периодическую систему Менделеева: первый элемент H – 1 s, затем He – 1 s 2, Li – 1 s 22 s, Be - 1 s 22 s 2, B – 1 s 22 s 2 p,.... На рис.7 указаны только конфигурации внешних оболочек электронов – именно они определяют в первую очередь основные функции и химические свойства элементов. Важно отметить, что элементы с полностью заполненной внешней оболочкой (например He, Ne, Ar, Kr, Xe, Rn – радон,...) имеют близкую к сферической функцию распределения электронной плотности вокруг ядра (вспомните рис.6) и их можно моделировать шариками. белых – вершинами вниз).
белых – вершинами вниз). плотнейшей упаковки вокруг пустот.
плотнейшей упаковки вокруг пустот. Если же шары третьего слоя ложатся в углубления второго типа (на октаэдрические, сквозные пустоты), то третий слой (он обозначен буквой С) не будет повторением первого или второго. Только четвертый слой может стать повторением первого, а пятый – второго. Имеем тип плотнейшей упаковки, называемый трехслойной или кубический упаковкой. Кубической она называется потому, что только из такой укладки шаров можно выделить кубическую ячейку с центрированными гранями. Отметим, что в кубический упаковке нет сплошных колонок из пустот одного сорта (как в гексагональной упаковке); над тетраэдрической пустотой находится октаэдрическая, и наоборот.
Если же шары третьего слоя ложатся в углубления второго типа (на октаэдрические, сквозные пустоты), то третий слой (он обозначен буквой С) не будет повторением первого или второго. Только четвертый слой может стать повторением первого, а пятый – второго. Имеем тип плотнейшей упаковки, называемый трехслойной или кубический упаковкой. Кубической она называется потому, что только из такой укладки шаров можно выделить кубическую ячейку с центрированными гранями. Отметим, что в кубический упаковке нет сплошных колонок из пустот одного сорта (как в гексагональной упаковке); над тетраэдрической пустотой находится октаэдрическая, и наоборот. Существование стабильных связей между атомами в кристалле предполагает, что полная энергия кристалла (кинетическая + потенциальная) меньше полной энергии такого же количества свободных атомов (удаленных друг от друга на ¥ расстояние). Разность этих двух энергий называется энергией химической связи или просто энергией связи. По типам связи твердые тела делятся на 4 класса, каждый из которых характеризуется своеобразным пространственным распределением электронов (рис.10): 1) связь за счет сил Ван-дер-Ваальса; 2) ионная связь; 3) ковалентная связь и 4) металлическая связь. Коротко охарактеризуем эти типы связей.
Существование стабильных связей между атомами в кристалле предполагает, что полная энергия кристалла (кинетическая + потенциальная) меньше полной энергии такого же количества свободных атомов (удаленных друг от друга на ¥ расстояние). Разность этих двух энергий называется энергией химической связи или просто энергией связи. По типам связи твердые тела делятся на 4 класса, каждый из которых характеризуется своеобразным пространственным распределением электронов (рис.10): 1) связь за счет сил Ван-дер-Ваальса; 2) ионная связь; 3) ковалентная связь и 4) металлическая связь. Коротко охарактеризуем эти типы связей. . Этот дипольный момент создает электрическое поле в центре второго атома
. Этот дипольный момент создает электрическое поле в центре второго атома  . В результате, у второго атома наводится тоже дипольный момент
. В результате, у второго атома наводится тоже дипольный момент  (a – электронная поляризуемость). Из электростатики известно, что два параллельных дипольных момента (а у нас они параллельны) взаимодействует с энергией
(a – электронная поляризуемость). Из электростатики известно, что два параллельных дипольных момента (а у нас они параллельны) взаимодействует с энергией  (5)
(5) Итак, притяжение параллельных дипольных моментов U(R) = ‑ C/R 6 – это т.н. энергия Ван-дер-ваальсового взаимодействия, которое быстро увеличивается с уменьшением расстояния. Но при уменьшении R между двумя атомами их электронные облака начинают постепенно перекрываться и возникают силы отталкивания (благодаря принципу запрета Паули, т.к. оболочки заполнены). Эти силы отталкивания можно описать экспериментальной формулой ~ B/R 12. Теперь полная потенциальная энергия взаимодействия 2х атомов:
Итак, притяжение параллельных дипольных моментов U(R) = ‑ C/R 6 – это т.н. энергия Ван-дер-ваальсового взаимодействия, которое быстро увеличивается с уменьшением расстояния. Но при уменьшении R между двумя атомами их электронные облака начинают постепенно перекрываться и возникают силы отталкивания (благодаря принципу запрета Паули, т.к. оболочки заполнены). Эти силы отталкивания можно описать экспериментальной формулой ~ B/R 12. Теперь полная потенциальная энергия взаимодействия 2х атомов: 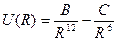 . (5')
. (5')


