Углерод — элемент IVA группы II периода. Электронная формула …2s2 2p2. А вот со степенями окисления тут хрень какая то: википедия пишет, что от включительно от -4 до +4, и она же пишет ниже, что «…Степени окисления +4 (напр., CO2), −4 (напр., CH4), редко +2 (СО, карбонилы металлов), +3 (C2N2)…». Я склоняюсь к первой версии, потому что в органических соединениях у него большой спектр с.о.Аллотропные формы углерода:кристаллический углерод (Алмаз, Графен, Графит, Карбин, Лонсдейлит, Наноалмаз, Фуллерены, Фуллерит, Углеродное волокно, Углеродные нановолокна, Углеродные нанотрубки), аморфный углерод (Активированный уголь,Древесный уголь, Ископаемый уголь: антрацит и др., Кокс каменноугольный, нефтяной и др., Стеклоуглерод, Техуглерод, Сажа, Углеродная нанопена)При обычных температурах углерод химически инертен, при достаточно высоких соединяется со многими элементами, проявляет сильные восстановительные свойства. Способность углерода образовывать полимерные цепочки, порождает огромный класс соединений на основе углерода, которых значительно больше, чем неорганических, и изучением которых занимаетсяорганическая химия (углеводороды, белки, жиры и др.) Соединения углерода составляют основу земной жизни, а их свойства во многом определяют спектр условий, в которых подобные формы жизни могут существовать. По числу атомов в живых клетках доля углерода около 25 %, по массовой доле — около 18 %.При нагревании углерод энергично взаимодействует с кислородом, образуя оксид углерода (II) и (IV), что зависит от содержания кислорода:2С+О2=2СОС+O2=СO2Под воздействием высоких температур углерод способен взаимодействовать с металлами, образуя карбиды:  Все карбиды — твердые темные порошки кристаллического строения. Их нельзя растворить ни в одном из известных растворителей. Нелетучи.Карбид кальция СаС2 и карбид алюминия Аl4С3 относятся к солеобразным карбидам, поскольку они содержат анионы углерода и катионы металлов. Их можно рассматривать как продукты замещения водорода металлом в метане СН4 или в ацетилене С2Н2.Они разлагаются водой с выделением соответствующего углеводорода:Аl4С3+12Н2O=4Аl(ОН)3+3CH4 СаС2+2Н2O =Са(ОН)2+C2H2Карбид кальция СаС2 при обычных условиях реагирует с водой с образованием ацетилена, являющегося исходным продуктом для синтеза большого количества разнообразных органических соединений.
Все карбиды — твердые темные порошки кристаллического строения. Их нельзя растворить ни в одном из известных растворителей. Нелетучи.Карбид кальция СаС2 и карбид алюминия Аl4С3 относятся к солеобразным карбидам, поскольку они содержат анионы углерода и катионы металлов. Их можно рассматривать как продукты замещения водорода металлом в метане СН4 или в ацетилене С2Н2.Они разлагаются водой с выделением соответствующего углеводорода:Аl4С3+12Н2O=4Аl(ОН)3+3CH4 СаС2+2Н2O =Са(ОН)2+C2H2Карбид кальция СаС2 при обычных условиях реагирует с водой с образованием ацетилена, являющегося исходным продуктом для синтеза большого количества разнообразных органических соединений.
Карбид железа Fe3C относится к металлоподобным карбидам. Их строение можно представить следующим образом: в кристаллическую решетку металла «внедряются» атомы углерода. Химическая связь осуществляется свободными обобществленными электронами. Участие в металлической связи принимают и электроны атомов углерода.Карбиды переходных металлов отличаются от самих металлов хрупкостью и твердостью. Карбид железа Fe3C назван цементитом. И чугун, и сталь обязаны своей твердостью и износостойкостью тому, что в их структуре присутствует Fe3C.С водородом уголь в присутствии никелевого катализатора и при нагревании образует метан — основную составную часть природных горючих газов:С+2Н2=СН4При пропускании водяных паров через раскаленный уголь или кокс получается смесь оксида углерода (II) и водорода: С+Н2О=СО+Н2называемая водяным газом. Эта реакция протекает в газогенераторе при температуре 1000°С.Углерод способен восстанавливать многие металлы из их оксидов. На этом основано получение металлов из руд.2ZnO+С= 2Zn+СО2Концентрированная серная и азотная кислота при нагревании окисляют углерод до СO2:С+2H2SO4=CO2+2SO2+2Н2О 3С+4HNO3=3CO2 + 4NO2+2H2OОксид углерода (II) (СО) — бесцветный ядовитый газ (при нормальных условиях) без вкуса и запаха. Горюч. Так называемый «запах угарного газа» на самом деле представляет собой запах органических примесей. При комнатных температурах CO малоактивен, его химическая активность значительно повышается при нагревании и в растворах (так, в растворах он восстанавливает соли Au, Pt, Pd и других до металлов уже при комнатной температуре. При нагревании восстанавливает и другие металлы, например CO + CuO → Cu + CO2↑.Оксид углерода(IV) (CO2) – бесцветныйгаз (в нормальных условиях), без запаха, со слегка кисловатым вкусом. По химическим свойствам диоксид углерода относится к кислотным оксидам. При растворении в воде образует угольную кислоту. Реагирует со щёлочами с образованием карбонатов и гидрокарбонатов. Вступает в реакции электрофильного замещения (например, с фенолом) и нуклеофильного присоединения. У́гольнаякислота́ — слабая двухосновная кислота. В чистом виде неустойчива. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.Из нормальных карбонатов в воде растворимы только соли щелочных металлов, аммония и таллия. Вследствие гидролиза растворы их показывают щелочную реакцию. Малорастворимы нормальные карбонаты кальция, бария, стронция и свинца. Все кислые карбонаты хорошо растворимы в воде; кислые карбонаты сильных щелочей также имеют слабощелочную реакцию.При нагревании кислые карбонаты переходят в нормальные карбонаты:  При сильном нагревании нормальные карбонаты разлагаются на оксиды и углекислый газ:
При сильном нагревании нормальные карбонаты разлагаются на оксиды и углекислый газ:  Карбонаты реагируют с кислотами сильнее угольной (почти все известные кислоты, включая органические) с выделением углекислого газа:
Карбонаты реагируют с кислотами сильнее угольной (почти все известные кислоты, включая органические) с выделением углекислого газа:  ;
;  Гидрокарбонаты щелочных металлов в воде растворимы. Также в воде хорошо растворимы гидрокарбонаты щелочноземельных металлов, в отличие от карбонатов.При нагревании разлагаются на соответствующий карбонат, воду и углекислый газ:
Гидрокарбонаты щелочных металлов в воде растворимы. Также в воде хорошо растворимы гидрокарбонаты щелочноземельных металлов, в отличие от карбонатов.При нагревании разлагаются на соответствующий карбонат, воду и углекислый газ:  Гидролиз гидрокарбонат-иона происходит по схеме:
Гидролиз гидрокарбонат-иона происходит по схеме:  В итоге раствор гидрокарбонатов имеет щелочную реакцию.Реагирует с щелочами:
В итоге раствор гидрокарбонатов имеет щелочную реакцию.Реагирует с щелочами:  и с кислотами:
и с кислотами: 
43.олово.общая характеристика.оксид и гидроксид олова2.соли олова 2.гидролиз.восстановительные свойства соединений олова 2.применение олова в консервной промышленности.
ОЛОВО (лат. Stannum), Sn, химический элемент с атомным номером 50, атомная масса 118,710 Олово расположено в пятом периоде в IVА группе периодической системы элементов Д. И. Менделеева. Конфигурация внешнего электронного слоя 5s25p2. В своих соединениях олово проявляет степени окисления +2 и +4 (соответственно валентности II и IV). Физические и химические свойства: простое вещество олово полиморфно. В обычных условиях оно существует в виде b-модификации (белое олово), устойчивой выше 13,2°C. Белое олово — это серебристо-белый, мягкий, пластичный металл, обладающий тетрагональной элементарной ячейкой. Температура плавления 231,9°C, температура кипения 2270°C.При охлаждении, например, при морозе на улице, белое олово переходит в a-модификацию (серое олово). Серое олово имеет структуру алмаза (кубическая кристаллическая решетка с параметром а = 0,6491 нм
Из-за сильного различия структур двух модификаций олова разнятся и их электрофизические свойства. Так, b-Sn — металл, а a-Sn относится к числу полупроводников. Ниже 3,72 К a-Sn переходит в сверхпроводящее состояние. При комнатной температуре олово, подобно соседу по группе германию, устойчиво к воздействию воздуха или воды. Такая инертность объясняется образованием поверхностной пленки оксидов. Заметное окисление олова на воздухе начинается при температурах выше 150°C:Sn + O2 = SnO2.При нагревании олово реагирует с большинством неметаллов. При этом образуются соединения в степени окисления +4, которая более характерна для олова, чем +2. Например:Sn + 2Cl2 = SnCl4С концентрированной соляной кислотой олово медленно реагирует:Sn + 4HCl = SnCl4 + H2Возможно также образование хлороловянных кислот составов HSnCl3, H2SnCl4 и других, например:Sn + 3HCl = HSnCl3 + 2H2В разбавленной серной кислоте олово не растворяется, а с концентрированной — реагирует очень медленно.Состав продукта реакции олова с азотной кислотой зависит от концентрации кислоты. В концентрированной азотной кислоте образуется оловянная кислота b-SnO2·nH2O (иногда ее формулу записывают как H2SnO3). При этом олово ведет себя как неметалл:Sn + 4HNO3 конц. = b-SnO2·H2O + 4NO2 + H2OПри взаимодействии с разбавленной азотной кислотой олово проявляет свойства металла. В результате реакции образуется соль нитрат олова (II):3Sn + 8HNO3 разб. = 3Sn(NO3)2 + 2NO + 4H2OПри нагревании олово, подобно свинцу, может реагировать с водными растворами щелочей. При этом выделяется водород и образуется гидроксокомплекс Sn (II), например:Sn + 2KOH +2H2O = K2[Sn(OH)4] + H2Гидрид олова — станнан SnH4 — можно получить по реакции:SnCl4 + Li[AlH4] = SnH4 + LiCl + AlCl3.Этот гидрид весьма нестоек и медленно разлагается уже при температуре 0°C.Олову отвечают два оксида SnO2 (образующийся при обезвоживании оловянных кислот) и SnO. Последний можно получить при слабом нагревании гидроксида олова (II) Sn(OH)2 в вакууме:Sn(OH)2 = SnO + H2OПри сильном нагреве оксид олова (II) диспропорционирует:2SnO = Sn + SnO2
При хранении на воздухе монооксид SnO постепенно окисляется:2SnO + O2 = 2SnO2.При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая a-оловянная кислота:SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl.H2[Sn(OH)6] = a-SnO2·nH2O + 3H2O.Свежеполученная a-оловянная кислота растворяется в кислотах и щелочах:a-SnO2·nH2O + KOH = K2[Sn(OH)6],a-SnO2·nH2O + HNO3 = Sn(NO3)4 + H2O.При хранении a-оловянная кислота стареет, теряет воду и переходит в b-оловянную кислоту, которая отличается большей химической инертностью. Данное изменение свойств связывают с уменьшением числа активных HO–Sn группировок при стоянии и замене их на более инертные мостиковые –Sn–O–Sn– связи.При действии на раствор соли Sn (II) растворами сульфидов выпадает осадок сульфида олова (II):Sn2+ + S2– = SnSЭтот сульфид может быть легко окислен до SnS2 раствором полисульфида аммония:SnS + (NH4)2S2 = SnS2 + (NH4)2SОбразующийся дисульфид SnS2 растворяется в растворе сульфида аммония (NH4)2S:SnS2 + (NH4)2S = (NH4)2SnS3.Применение: важное применение олова — лужение железа и получение белой жести, которая используется в консервной промышленности. Для этих целей расходуется около 33% всего добываемого олова. До 60% производимого олова используется в виде сплавов с медью, медью и цинком, медью и сурьмой (подшипниковый сплав, или баббит), с цинком (упаковочная фольга) и в виде оловянно-свинцовых и оловянно-цинковых припоев. Олово способно прокатываться в тонкую фольгу — станиоль, такая фольга находит применение при производстве конденсаторов, органных труб, посуды, художественных изделий. Олово применяют для нанесения защитных покрытий на железо и другие металлы, а также на металлические изделия (лужение). Дисульфид олова SnS2 применяют в составе красок, имитирующих позолоту («сусальное золото»).Олово представляет опасность для человека в виде паров и различных аэрозольных частиц, пыли. При воздействии паров или пыли олова может развиться станноз — поражение легких. Очень токсичны некоторые оловоорганические соединения. Временно допустимая концентрация соединений олова в атмосферном воздухе 0,05 мг/м3, ПДК олова в пищевых продуктах 200 мг/кг, в молочных продуктах и соках — 100 мг/кг. Токсическая доза олова для человека — 2 г.Оксид олова(II) — это неорганическое бинарное химическое соединение, которое существует в двух формах: стабильная, имеющая черно-синий (по другим данным коричневато-чёрный[1]) цвет и метастабильная — красный цвет. Химическая формула — SnO. В этом соединении олово имеет степень окисления равную 2+, а кислород 2−.Физические свойстваТемно-синее (почти чёрное) кристаллы, тетрагональная сингония, Оксид олова является полупроводником, тип проводимости которого зависит от примесей и способа получения.ПолучениеОксид олова получают осторожным разложением в инертной атмосфере гидроокиси олова:  Из диоксида олова:SnO2+Sn=2SnOВ лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:
Из диоксида олова:SnO2+Sn=2SnOВ лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере: 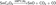 С помощью твёрдотельной реакции из хлорида олова(II):
С помощью твёрдотельной реакции из хлорида олова(II):  Метастабильный красный оксид олова(II) можно приготовить подогревая на малом огне водный раствор аммиака с оловом2+, в результате получится осадок, состоящий из красного оксида олова(II)Химические свойстваОксид олова(II) устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
Метастабильный красный оксид олова(II) можно приготовить подогревая на малом огне водный раствор аммиака с оловом2+, в результате получится осадок, состоящий из красного оксида олова(II)Химические свойстваОксид олова(II) устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:  и концентрированных кислотах:
и концентрированных кислотах:  Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn(OH2)32+ или Sn(OH)(OH2)2+, также в менее кислотных растворах — Sn3(OH)42+.Растворяется в концентрированых:
Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn(OH2)32+ или Sn(OH)(OH2)2+, также в менее кислотных растворах — Sn3(OH)42+.Растворяется в концентрированых: 
 Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.Диспропорционирует при нагревании:
Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.Диспропорционирует при нагревании:  Окисляется кислородом воздуха:
Окисляется кислородом воздуха:  Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта.[2]:
Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта.[2]:  Sn и O могут образовывать соединения нестехиометрического состава.ПрименениеОксид олова(II) в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.Оксид церия(III) с оксидом олова(II) используется в осветительных приборах как люминофор.Гидроксид олова(II) — неорганическое соединение, гидроокись олова формулой Sn(OH)2, гелевидный белый осадок, плохо растворимые в воде, проявляет амфотерные свойства.ПолучениеОсаждение щелочами из раствора солей двухвалентного олова:
Sn и O могут образовывать соединения нестехиометрического состава.ПрименениеОксид олова(II) в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.Оксид церия(III) с оксидом олова(II) используется в осветительных приборах как люминофор.Гидроксид олова(II) — неорганическое соединение, гидроокись олова формулой Sn(OH)2, гелевидный белый осадок, плохо растворимые в воде, проявляет амфотерные свойства.ПолучениеОсаждение щелочами из раствора солей двухвалентного олова:  Физические свойстваГидроксид олова(II) образует гелевидный белый осадок, плохо растворимые в воде, устойчивый в интервале pH 2,5÷10,5.
Физические свойстваГидроксид олова(II) образует гелевидный белый осадок, плохо растворимые в воде, устойчивый в интервале pH 2,5÷10,5.
Из раствора осаждается в виде гидрата m SnO•n H2O, соединение стехиометрического состава не выделено.Химические свойстваПри нагревании легко теряет воду:  Проявляет амфотерные свойства, растворяется в кислотах:
Проявляет амфотерные свойства, растворяется в кислотах:  и щелочах:
и щелочах:  При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая a-оловянная кислота:SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl.H2[Sn(OH)6] = a-SnO2·nH2O + 3H2O. Во4сстановительные свойства олова (II):2KMnO4+5SnCl2+16HCl=2MnCl2+5SnCl4+2KCl+8H2OMn7++5e=Mn2+Sn2+-2e=Sn4+
При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая a-оловянная кислота:SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl.H2[Sn(OH)6] = a-SnO2·nH2O + 3H2O. Во4сстановительные свойства олова (II):2KMnO4+5SnCl2+16HCl=2MnCl2+5SnCl4+2KCl+8H2OMn7++5e=Mn2+Sn2+-2e=Sn4+



 Все карбиды — твердые темные порошки кристаллического строения. Их нельзя растворить ни в одном из известных растворителей. Нелетучи.Карбид кальция СаС2 и карбид алюминия Аl4С3 относятся к солеобразным карбидам, поскольку они содержат анионы углерода и катионы металлов. Их можно рассматривать как продукты замещения водорода металлом в метане СН4 или в ацетилене С2Н2.Они разлагаются водой с выделением соответствующего углеводорода:Аl4С3+12Н2O=4Аl(ОН)3+3CH4 СаС2+2Н2O =Са(ОН)2+C2H2Карбид кальция СаС2 при обычных условиях реагирует с водой с образованием ацетилена, являющегося исходным продуктом для синтеза большого количества разнообразных органических соединений.
Все карбиды — твердые темные порошки кристаллического строения. Их нельзя растворить ни в одном из известных растворителей. Нелетучи.Карбид кальция СаС2 и карбид алюминия Аl4С3 относятся к солеобразным карбидам, поскольку они содержат анионы углерода и катионы металлов. Их можно рассматривать как продукты замещения водорода металлом в метане СН4 или в ацетилене С2Н2.Они разлагаются водой с выделением соответствующего углеводорода:Аl4С3+12Н2O=4Аl(ОН)3+3CH4 СаС2+2Н2O =Са(ОН)2+C2H2Карбид кальция СаС2 при обычных условиях реагирует с водой с образованием ацетилена, являющегося исходным продуктом для синтеза большого количества разнообразных органических соединений. При сильном нагревании нормальные карбонаты разлагаются на оксиды и углекислый газ:
При сильном нагревании нормальные карбонаты разлагаются на оксиды и углекислый газ:  Карбонаты реагируют с кислотами сильнее угольной (почти все известные кислоты, включая органические) с выделением углекислого газа:
Карбонаты реагируют с кислотами сильнее угольной (почти все известные кислоты, включая органические) с выделением углекислого газа:  ;
;  Гидрокарбонаты щелочных металлов в воде растворимы. Также в воде хорошо растворимы гидрокарбонаты щелочноземельных металлов, в отличие от карбонатов.При нагревании разлагаются на соответствующий карбонат, воду и углекислый газ:
Гидрокарбонаты щелочных металлов в воде растворимы. Также в воде хорошо растворимы гидрокарбонаты щелочноземельных металлов, в отличие от карбонатов.При нагревании разлагаются на соответствующий карбонат, воду и углекислый газ:  Гидролиз гидрокарбонат-иона происходит по схеме:
Гидролиз гидрокарбонат-иона происходит по схеме:  В итоге раствор гидрокарбонатов имеет щелочную реакцию.Реагирует с щелочами:
В итоге раствор гидрокарбонатов имеет щелочную реакцию.Реагирует с щелочами:  и с кислотами:
и с кислотами: 
 Из диоксида олова:SnO2+Sn=2SnOВ лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере:
Из диоксида олова:SnO2+Sn=2SnOВ лабораторных условиях оксид олова часто получают осторожным нагревом оксалата олова(II) в инертной атмосфере: 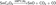 С помощью твёрдотельной реакции из хлорида олова(II):
С помощью твёрдотельной реакции из хлорида олова(II):  Метастабильный красный оксид олова(II) можно приготовить подогревая на малом огне водный раствор аммиака с оловом2+, в результате получится осадок, состоящий из красного оксида олова(II)Химические свойстваОксид олова(II) устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:
Метастабильный красный оксид олова(II) можно приготовить подогревая на малом огне водный раствор аммиака с оловом2+, в результате получится осадок, состоящий из красного оксида олова(II)Химические свойстваОксид олова(II) устойчив на воздухе, амфотерен с преобладанием основных свойств. Мало растворим в воде и разбавленных растворах щелочей. Растворяется в разбавленных кислотах:  и концентрированных кислотах:
и концентрированных кислотах:  Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn(OH2)32+ или Sn(OH)(OH2)2+, также в менее кислотных растворах — Sn3(OH)42+.Растворяется в концентрированых:
Он также растворяется в сильных кислотах, давая ионные комплексы, например Sn(OH2)32+ или Sn(OH)(OH2)2+, также в менее кислотных растворах — Sn3(OH)42+.Растворяется в концентрированых: 
 Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.Диспропорционирует при нагревании:
Также известны другие безводные оловосодержащие соединения, например, K2Sn2O3, K2SnO2.Диспропорционирует при нагревании:  Окисляется кислородом воздуха:
Окисляется кислородом воздуха:  Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта.[2]:
Восстанавливается до металлического олова водородом, углеродом, кремнием, бором и парами этилового спирта.[2]:  Sn и O могут образовывать соединения нестехиометрического состава.ПрименениеОксид олова(II) в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.Оксид церия(III) с оксидом олова(II) используется в осветительных приборах как люминофор.Гидроксид олова(II) — неорганическое соединение, гидроокись олова формулой Sn(OH)2, гелевидный белый осадок, плохо растворимые в воде, проявляет амфотерные свойства.ПолучениеОсаждение щелочами из раствора солей двухвалентного олова:
Sn и O могут образовывать соединения нестехиометрического состава.ПрименениеОксид олова(II) в подавляющем большинстве случаев используется в качестве исходного продукта в производстве других, как правило, двухвалентных, соединений олова. Может применяться также в качестве восстановителя и в создании рубинового стекла. В незначительных количествах используется в качестве этерификаторного катализатора.Оксид церия(III) с оксидом олова(II) используется в осветительных приборах как люминофор.Гидроксид олова(II) — неорганическое соединение, гидроокись олова формулой Sn(OH)2, гелевидный белый осадок, плохо растворимые в воде, проявляет амфотерные свойства.ПолучениеОсаждение щелочами из раствора солей двухвалентного олова:  Физические свойстваГидроксид олова(II) образует гелевидный белый осадок, плохо растворимые в воде, устойчивый в интервале pH 2,5÷10,5.
Физические свойстваГидроксид олова(II) образует гелевидный белый осадок, плохо растворимые в воде, устойчивый в интервале pH 2,5÷10,5. Проявляет амфотерные свойства, растворяется в кислотах:
Проявляет амфотерные свойства, растворяется в кислотах:  и щелочах:
и щелочах:  При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая a-оловянная кислота:SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl.H2[Sn(OH)6] = a-SnO2·nH2O + 3H2O. Во4сстановительные свойства олова (II):2KMnO4+5SnCl2+16HCl=2MnCl2+5SnCl4+2KCl+8H2OMn7++5e=Mn2+Sn2+-2e=Sn4+
При гидролизе растворов солей олова (IV) образуется белый осадок — так называемая a-оловянная кислота:SnCl4 + 4NH3 + 6H2O = H2[Sn(OH)6] + 4NH4Cl.H2[Sn(OH)6] = a-SnO2·nH2O + 3H2O. Во4сстановительные свойства олова (II):2KMnO4+5SnCl2+16HCl=2MnCl2+5SnCl4+2KCl+8H2OMn7++5e=Mn2+Sn2+-2e=Sn4+

