КОВАЛЕНТНАЯ СВЯЗЬ
Осуществляется за счет электронной пары, принадлежащей обоим атомам.
Ковалентная связь образуется перекрыванием свободных неспареныхэлектронов.Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
| H• + •H ® H: H
|
| 
| ®
| 
|
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;

| ®
| 
|
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной (одинаковые элементы)s-sсвязь(сигма связь)
p-pсвязь(сгма связь)
Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной (разныенеме).s-p(сигма)
S это вобород, P это хлор
СВОЙСТВА Ков связи
1. Длина связи-расстояние между центрами атомов. Чем меньше тем прочнее.
2. Энергия связи- энергия затраченая на образ связи, связана с длиной.
3. Насыщаемость-зависит от валентности.
4. Направленность-смещение электронной плотности.
ИОННАЯ СВЯЗЬ
Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.

| ®
| 
|
ВОДОРОДНАЯ СВЯЗЬ
Водородная связь - зто связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородная связь имеет частично электростатический, частично донорно-акцепторный характер.
Дипольный момент служит мерой полярности молекулы. Частично положительный и частично отрицательный(дельта плюс дельта минус)
3. Теория строения Бутлерова. Формулы органических соединений. Формулы Льюиса. Электронная теория строения. Атомная и молекулярная орбитали. Способы образования ковалентной связи.
Теория строения органических соединений A. M. Бутлерова, сформулированная ученым в 1861г., включает в себя следующие положения:
1 Атомы расположены в молекулах не хаотично, а соединены друг с другом в определенной последовательности, в соответствии с их валентностью.
2. Химические свойства веществ зависят не только от качественного или количественного состава, но и от химического строения молекул.
3. Атомы или группы атомов в молекулах взаимно влияют друг на друга, непосредственно или посредством других атомов.
Нуклеофильные реагенты
а) нейтральные молекулы, имеющие неподеленные пары электронов:
б) анионы: OH— ; CN—; NH2—; RCOO—; RS—; Cl—; Br—; I—; HSO3—;
в) соединения, содержащие центры с повышенной электронной плотностью:
Электрофильные реагенты
а) нейтральные молекулы, имеющие вакантнуюорбиталь: SO3, кислоты Льюиса (AlCl3, SnCl4, FeBr3, BF3);
б) катионы: протон (Н+), ионы металлов (Меn+); SO3H+, NO2+, NO+;
в) молекулы, имеющие центры с пониженной электронной плотностью: галогенпроизводные углеводов – Rδ+—Halδ—, галогены (Cl2, Br2, I2), соединения с карбонильной группой
Карбкатионы – положительно заряженные частицы, атом углерода, несущий положительный заряд находится в sр2-гибридизации.
Карбанионы – отрицательно заряженные частицы, заряд которых обусловлен наличием в их структуре атома Сснеподеленной электронной парой. При этом атом углерода, несущий отрицательный заряд, может быть как в sp2, так и в sр3-гибридизации.
Свободные радикалы – любая электронейтральная активная частица, содержащая одноэлектроннуюорбиталь, т.е. неспаренный электрон.
6. Кислоты и основания в орг.химии. Сопряженная кислота и сопряженное основание. Кислотно-основные равновесия, примеры. Влияние заместителей в молекуле на кислотность и основность.
По Льюису, кислотные и основные свойства органических соединений оцениваются по способности принимать или предоставлять электронную пару с последующим образованием связи. Атом,принимающий электронную пару, является акцептором электронов, а соединение, содержащее такой атом, следует отнести к кислотам. Атом, предоставляющий электронную пару, является донором элекронов, а соединение, содержащее такой атом, – основанием.
Конкретно кислотами Льюиса могут быть атом, молекула или катион: протон, галогениды элементов второй и третьей групп Периодической системы, галогениды переходных металлов – BF3, ZnCl2, AlCl3, FeCl3,FeBr3, TiCl4, SnCl4, SbCl5, катионы металлов, серный ангидрид – SO3, карбкатион. К основаниям Льюиса относятся амины (RNH2, R2NH, R3N), спирты ROH, простые эфиры ROR
По Бренстеду-Лоури, кислоты представляют собой вещества, способные отдавать протон, а основания - вещества, присоединяющие протон.
Сопряжённые кислота и основание:
HCN (кисл) и СN-(основание)
NН3(основание) и NH4+ (кислота)
Кислотно-основное (или протолитическое) равновесие– это равновесие в котором участвует протон (Н+).
HCOOH + H2O D H3O+ + HCOO-
кислота1 основание2 сопряженная сопряженное
кислота2 основание1
или
H2O + NH3 D NH4+ + OH-.
кислота1 основание2 сопряженная сопряженное
кислота2 основание1
Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, а начиная с C18 – твердые вещества. Температуры плавления и кипения алканов их плотности увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями..
· Температуры плавления и кипения понижаются от менее разветвленных к более разветвленным.
· Газообразные алканы горят бесцветным или бледно-голубым пламенем с выделением большого количества тепла.
Вращение атомов вокруг s-связи не будет приводить к ее разрыву. В результате внутримолекулярного вращения по s-связям С–С молекулы алканов, начиная с этана С2Н6, могут принимать разные геометрические формы.
Различные пространственные формы молекулы, переходящие друг в друга путем вращения вокруг s-связей С–С, называют конформациями или поворотными изомерами (конформерами).
Поворотные изомеры молекулы представляют собой энергетически неравноценные ее состояния. Их взаимопревращение происходит быстро и постоянно в результате теплового движения. Поэтому поворотные изомеры не удается выделить в индивидуальном виде, но их существование доказано физическими методами.
Общее (родовое) название предельных углеводородов — алканы.
Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с добавлением суффикса –ан
9. Углеводороды. Классификация. Предельные углеводороды ряда метана. Гомологический ряд. Номенклатура. Изомерия. Радикалы. Природные источники. Синтез Фишера-Тропша. Методы получения (из алкенов, карбоновых кислот, галогенпроизводных, по реакции Вюрца)
| УГЛЕВОДОРОДЫ
|
| Ациклические Нет замкнутых цепей в углеродном скелете
| Циклические В углеродном скелете есть хотя бы один цикл
|
| Насыщенные Все связи в молекуле одинарные
| Ненасыщенные Есть хотя бы одна кратная связь
| Алициклические Нет ароматической системы связей
| Ароматические Ароматическая система связей присутствует
|
| | | | |
Общее (родовое) название предельных углеводородов — алканы.
Названия первых четырех членов гомологического ряда метана тривиальные: метан, этан, пропан, бутан. Начиная с пятого названия образованы от греческих числительных с добавлением суффикса –ан
Свою номенклатуру имеют и радикалы (углеводородные радикалы). Одновалентные радикалы называют алкилами и обозначают буквой R или Alk.
Их общая формула CnH2n+ 1.
Названия радикалов составляют из названий соответствующих углеводородов заменой суффикса -ан на суффикс -ил (метан — метил, этан — этил, пропан — пропил и т.д.).
Двухвалентные радикалы называют, заменяя суффикс -ан на -илиден (исключение - радикал метилен ==СН2).
Трехвалентные радикалы имеют суффикс -илидин
Изомерия. Для алкановхарактерена структурная изомерия. Если в молекуле алкана содержится более трех углеродных атомов, то порядок их соединения может быть различным. Один из изомеров бутана (н -бутан) содержит неразветвленную углеродную цепь, а другой — изобутан — разветвленную (изостроение).
Важнейшим источником алканов в природе является природный газ, минеральное углеводородное сырье- нефть и сопутствующие ей нефтяные газы.
Получение алканов можно осуществить реакцией Вюрца, заключающейся в действии металлического натрия на моногалогенопроизводные углеводородов.
2CH3–CH2Br(бромистый этил) + 2Na ––> CH3–CH2–CH2–CH3(бутан) + 2NaBr
· Из алкенов
CnH2n + H2 → CnH2n+2
Синтез Фишера — Тропша
nCO + (2n+1)H2 → CnH2n+2 + nH2O
Из таблицы видно, что эти углеводороды отличаются друг от друга количеством групп - СН2-.Такой ряд сходных по строению, обладающих близкими химическими свойствами и отличающихся друг от друга числом данных групп называется гомологическим рядом. А вещества, составляющие его называются гомологами.
| Формула
| Название
|
| CH4
| метан
|
| C2H6
| этан
|
| C3H8
| пропан
|
| C4H10
| бутан
|
| C4H10
| изобутан
|
| C5H12
| пентан
|
| C5H12
| изопентан
|
| C5H12
| неопентан
|
| C6H14
| гексан
|
| C7H16
| гептан
|
| C10H22
| декан
|
|
|
|
Физические свойства
В обычных условиях первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, а начиная с C18 – твердые вещества. Температуры плавления и кипения алканов их плотности увеличиваются с ростом молекулярной массы. Все алканы легче воды, в ней не растворимы, однако растворимы в неполярных растворителях (например, в бензоле) и сами являются хорошими растворителями.
Химические свойства
Тривиальное (историческое) название алканов - "парафины" - означает "не имеющие сродства". Алканы химически малоактивны. Низкая реакционная способность алканов обусловлена очень малой полярностью связей С-С и С-Н в их молекулах вследствие почти одинаковой электроотрицательности атомов углерода и водорода. Предельные углеводороды в обычных условиях не взаимодействуют ни с концентрированными кислотами, ни со щелочами, ни даже с таким активным реагентом как перманганат калия.
Для них свойственны реакции замещения водородных атомов и расщепления.
Изомеризация.
Алканы нормального строения под влиянием катализаторов и нагревании способны превращаться в разветвленные без изменения состава молекул – изомеризация.

Применение
Первый в ряду алканов – метан – является основным компонентом природных и попутных газов и широко используется в качестве промышленного и бытового газа.
Средние члены гомологического ряда применяются как растворители и моторные топлива.
Жидкие углеводороды используются как горючее (они входят в состав бензина и керосина). Алканы широко используются в органическом синтезе.
Дегидрирование алканов
Это один из промышленных способов получения алкенов
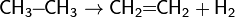
Гидрирование алкинов
Частичное гидрирование алкинов требует специальных условий и наличие катализатора

Двойная связь является сочетания сигма- и пи-связей. Сигма- связь возникает при осевом перекрывании sp2 – орбиталей, а пи-связь при боковом перекрывании
Правило Зайцева:
Отщепление атома водорода в реакциях элиминирования происходит преимущественно от наименее гидрогенизированного атома углерода.
Алкены. Строение. sp2 гибридизация, параметры кратной связи. Реакции электрофильного присоединения галогенов, галогеноводородов,, хлорноватистой кислоты. Гидратация алкенов. Правило Морковникова. Механизмы реакций.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связьмежду атомами углерода, образующие гомологический ряд с общей формулой CnH2n
Одна s- и 2 p-орбитали смешиваются и образуются 2 равноценные sp2-гибридные орбитали, расположенные в одной плоскости под углом 120.
Если связь образуется более чем одной парой электронов, то она называется кратной.
Кратная связь образуется в тех случаях, когда имеется слишком мало электронов и связывающихся атомов, чтобы каждая пригодная для образования связи валентная орбиталь центрального атома могла перекрыться с какой-либо орбиталью окружающего атома.
Гидрогалогенирование
Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова

Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинаматом водорода присоединяется к наиболее гидрогенизированному атому углерода
Гидратация
Реакция присоединения воды к алкенам протекает в присутствии серной кислоты[21]:

Карбкатион — частица, в которой на атоме углерода сосредоточен положительный заряд, атом углерода имеет вакантную p-орбиталь.
Этиленовые углеводороды. Химические свойства: реакции с окислителями. Каталитическое окисление, реакция с надкислотами, реакция окисления до гликолей, с разрывом связи углерод-углерод, озонирование. Вакер-процесс. Реакции замещения.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связьмежду атомами углерода, образующие гомологический ряд с общей формулой CnH2n
Окисление
Окисление алкенов может происходить в зависимости от условий и видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета.
При сжигании на воздухе олефины дают углекислый газ и воду.
H2C=CH2 + 3O2 => 2CO2 + 2H2O
CnH2n + 3n/O2 => nCO2 + nH2O – общая формула
Каталитическое окисление
В присутствии солей палладия этилен окисляется до ацетальдегида. Аналогично образуется ацетон из пропена.
· При действии на алкены сильных окислителей (KMnO4 или K2Cr2O7 в среде Н2SO4) при нагревании происходит разрыв двойной связи:

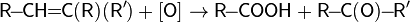 (кетон)
(кетон)

При окислении алкенов разбавленным раствором марганцовки образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера). Реакция протекает на холоде.
| 3H2C=CH2 + 2KMnO4 + 4H2O ® 3
| CH2−CH2(этиленгликоль) + 2MnO2 + 2KOH I I OH OH
|
Ациклические и циклические алкены при взаимодействии с надкислотами RCOOOH в неполярной, среде образуют эпоксиды (оксираны), поэтому сама реакция носит название реакции эпоксидирования.
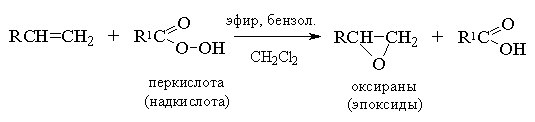
Озонирование алкенов.
при взаимодействии алкенов с озоном образуются перекисные соединения, которые называются озо-нидами. Реакция алкенов с озоном является наиболее важным методом окислительного расщепления алкенов по двойной связи
Алкены не вступают в реакции замещения.
Вакер-процесс —процесс получения ацетальдегида прямым окислениемэтилена.
Вакер-процесс основан на реакции окисления этилена дихлоридом палладия:
CH2=CH2 + PdCl2 + H2O = CH3CHO + Pd + 2HCl
Алкены: химические свойства. Гидрирование. Правило Лебедева. Изомеризация и олигомеризацияалкенов. Радикальная и ионная полимеризация. Понятие полимер, олигомер, мономер, элементарное звено, степень полимеризации. Теломеризация и сополимеризация.
Гидрирование

Гидрирование алкенов непосредственно водородом происходит только в присутствии катализатора. Катализаторами гидрирования служат платина,палладий, никель
Гидрирование можно проводить и в жидкой фазе с гомогенными катализаторами
Реакции изомеризации
При нагревании возможна изомеризация молекул алкенов, которая
может привести как к перемещению двойной связи, так и к изменению скелета
углеводорода.
CH2=CH-CH2-CH3 CH3-CH=CH-CH3
Реакции полимеризации
Это разновидность реакции присоединения. Полимеризация - это реакция последовательного соединения одинаковых молекул в большие по размеру молекулы, без выделения какого-либо низкомолекулярного продукта. При полимеризации атом водорода присоединяется к наиболее гидрогенизированному атому углерода, находящемуся у двойной связи, а к другому атому углерода присоединяется остальная часть молекулы.
CH2=CH2 + CH2=CH2 +... -CH2-CH2-CH2-CH2-...
или n CH2=CH2 (-CH2-CH2-)n (полиэтилен)
Вещество, молекулы которого вступают в реакцию полимеризации, называются мономером. Молекула мономера обязательно должна иметь хотя бы одну двойную связь. Образующиеся полимеры состоят из большого количества повторяющихся цепочек, имеющих одинаковое строение (элементарных звеньев). Число, показывающее, сколько раз в полимере повторяется структурное (элементарное) звено, называется степенью полимеризации (n).
В зависимости от вида промежуточных частиц, образующихся при полимеризации, различают 3 механизма полимеризации: а) радикальный; б)катионный; в) анионный.
По первому методу получают полиэтилен высокого давления:

Катализатором реакции выступают пероксиды.
Второй и третий методы предполагает использование в качестве катализаторов кислот (катионная полимеризация), металлорганических соединений.
В химии олигомер) — молекула в виде цепочки из небольшого числа одинаковых составных звеньев.
Теломеризация
Теломеризация – олигомеризацияалкенов в присутствии веществ – передатчиков цепи (телогенов). В результате реакции образуется смесь олигомеров (теломеров), концевые группы которых представляют собой части телогена. Например, в реакции CCl4 с этиленом телогеном является CCl4.
CCl4 + nCH2=CH2 => Cl(CH2CH2)nCCl3
Инициирование этих реакций может осуществляться радикальными инициаторами или g -излучением.
Алкены. Реакции радикального присоединения галогенов и галогеноводородов (механизм). Присоединение карбенов к олефинам. Этилен, пропилен, бутилены. Промышленные источники и основные пути использования.
Алкены легко присоединяют галогены, особенно хлор и бром (галогенирование).
Типичной реакцией такого типа является обесцвечивание бромной воды
CH2=CH2 + Вr2 → СH2Br-CH2Br (1,2-дибромэтан)
Электрофильное присоединение галогенводородов к алкенам происходит по правилу Марковникова:

Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинаматом водорода присоединяется к наиболее гидрогенизированному атому углерода
Применение
Для производства оксида пропилена, получения ацетона, акриловой кислоты, пластмасс, каучуков, моющих средств, компонентов моторных топлив, растворителей.
Бутиле́н (буте́н) C4H8 — непредельный углеводород. Бутилен — бесцветный газ с характерным запахом, температура кипения −6.6 °C, смеси бутилена с воздухом взрывоопасны.
В промышленности бутилен получают дегидратацией бутанола при 300—350 °C; дегидрированием бутана, крекингом нефти.
Бутилен широко используют для синтеза бутадиена, бензина, бутанола, изооктана и полиизобутилена.
17. Типы алкадиенов. Диеновые углеводороды с сопряженными двойными связями. Дивинил. Изопрен. Способы получения: из гликолей, спирта (метод Лебедева), из ацетона и ацетилена (метод Фаворвского), изобутилена и формальдегида, дегидрогенизацией.
Это непредельные углеводороды, в молекулах которых присутствуют две двойные связи. Общая формула алкадиенов - СnH2n-2, где n ≥ 4.
Диены могут быть:
a) кумулированными – обе двойные связи принадлежат одному атому углерода
СH2=C=CH2 - пропадиен CH2=C=CH-CH3 - бутадиен-1,2
б) сопряженными (конъюгированными) - разделены одной простой связью
СH2=CH-CH=CH2 - бутадиен-1,3; CH3-CH=CH-CH=CH2 - пентадиен-1,3
в) изолированными - разделены двумя и более простыми связями
CH2=CH-CH2-CH=CH2 - пентадиен-1,4
Наибольшее практическое значение имеют диены с сопряженными связями.
Бутадие́н-1,3 (дивинил) СН2=СН—СН=СН2 — ненасыщенный углеводород, простейший представитель сопряжённых алкадиенов.
Физические свойства
Бутадиен — газ с характерным запахом, температура кипения -4,5 °C. Плохо растворим в воде, хорошо растворим в спирте, керосине с воздухом.
Применение: Полимеризацией бутадиена получают синтетические каучуки.
Изопрен (2-метилбутадиен-1,3) — ненасыщенный углеводород, принадлежащий алкадиенам, представляющий собой бесцветную летучую жидкость с характерным запахом. Является мономером натурального каучука
Изопрен растворим во многих органических растворителях. Плохо растворим в воде. Основное применение в промышленности — синтез изопреновых каучуков, некоторых медицинских препаратов, душистых веществ.
Получение алкадиенов из этилового спиртов по методу С.В.Лебедева при 580оС и с участием катализаторов - Al2O3, ZnO.
2C2H5OH =>СH2=CH-CH=CH2 + H2 + 2H2O
Дегидратация гликолей

Хлоропрен получают из винилацетилена:
CH2=CH-C≡СH + HCl = >СH2=CCl-CH=CH2
 18. 1,3 – алкадиены. Особенности молекулярной структуры. Химические свойства. Реакции электрофильного присоединения (механизм): 1,2- и 1,4-присоединение. Цикло присоединение по Дильсу-Альдеру. Полимеризация и сополимеризация диенов. Натуральный и синтетический каучук.
18. 1,3 – алкадиены. Особенности молекулярной структуры. Химические свойства. Реакции электрофильного присоединения (механизм): 1,2- и 1,4-присоединение. Цикло присоединение по Дильсу-Альдеру. Полимеризация и сополимеризация диенов. Натуральный и синтетический каучук.
Если между двумя двойными связями находится одна одинарная связь, то такиеалкадиены называются алкадиенами-1,3 или сопряженными диенами, например,
СН2=СН–СН=СН2 бутадиен-1,3.
Структурные исследования молекулы бутадиена–1,3 показали, что все ее атомы лежат в одной плоскости. Наиболее вероятным является расположение двойных связей в транс-конформации по отношению к одинарной связи.
Особенностью сопряженных диенов является то, что двойные связи в их молекулах функционируют как единое целое и присоединение идет преимущественно по крайним положениям сопряженной системы (1,4-присоединение) с образованием новой двойной связи в центре системы. Параллельно, однако, идет второстепенная реакция присоединение по одной из 2 двойных связей (1,2-присоединение).
1.Гидрирование.
При гидрировании бутадиена-1,3 получается бутен-2, т.е происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между С2 и С3
CH2=CH-CH=CH2 + H2 =CH3-CH=CH-CH3 (бутен-2)
2. Галогенирование. Присоединение галогенов, галогеноводородов происходит по электрофильному механизму. Галогенирование сопряженных диенов происходит постепенно. ПИСАТЬ В ОТВЕТ ТРИ РЕАКЦИИ!
1,4-присоединение. CH2=CH-CH=CH2 + Br2=>СH2Br-CH=CH-CH2Br-1,4-дибромбутен-2
1,2- присоединение CH2=CH-CH=CH2 + Br2 => СH2Br-CHBr-CH=CH2 1,2-дибромбутен-1 СH2Br-CH=CH-CH2Br Br2 => СH2Br-CHBr-CHBr-CH2Br (1,2,.3,4-тетрабромбутан).

3. Диеновый синтез (реакция Дильса – Альдера) – присоединение к сопряженным диенам соединений, содержащих кратные связи (диенофилы). Реакция идет как 1,4-присоединение и приводит к образованию циклических продуктов. И ДА, РИСУЙ ЭТИ ФИГОВИНЫ!
Реакции полимеризации также проходят с перемещением двойной связи и
приводят к образованию каучуков.
nСH2=CH-CH=CH2 => (-CH2-CH=CH-CH2-)n полибутадиен (дивиниловый каучук)
nCH2=C(CH3)-CH=CH2 => (-CH2-C(CH3)=CH-CH2-)n полиизопреновый каучук
nCH2=CCl-CH=CH2 => (-CH2-CCl=CH-CH2-)n хлоропреновый каучук.
Натуральный каучук получают из млечного сока (латекса) дерева гевеи. Натуральный каучук обладает уникальным комплексом свойств: высокой текучестью, устойчивостью к износу, клейкостью, водо- и газонепроницаемостью. Для придания каучуку необходимых физико-механических свойств: прочности, эластичности, стойкости к действию растворителей и агрессивных химических сред – каучук подвергают вулканизации нагреванием до 130-140°С с серой.
В 1932 году С.В.Лебедев разработал способ синтеза синтетического каучука на основе бутадиена, получаемого из спирта. В настоящее время в промышленности выпускают каучук,в котором содержание звеньев изопрена, соединенных в положении 1,4, достигает 99%, тогда как в натуральном каучуке они составляют 98%.
Ацетиленовые углеводороды. Гомологический ряд. Изомерия. Номенклатура. Строение тройное связи, sp-гибридизация. Способы получения алкинов: из алканов, оксидов углерода, галогенпроизводных, карбида кальция, алкилированиемацетиленидов.
Алкины (ацетиленовые углеводороды) - углеводороды, имеющие в своей молекуле тройную связь. Общая формула алкинов - CnH2n-2 (n ≥ 2). Простейший алкин ацетилен.
Гомологический ряд алкинов:
· Этин (ацетилен): C2H2
· Пропин: C3H4
· Бутин: C4H6
· Пентин: C5H8
· Гексин: C6H10
· Гептин: C7H12
· Октин: C8H14
· Нонин: C9H16
· Децин: C10H18
Для них характерны 2 вида изомерии - изомерия положения тройной связи и изомерия углеродного скелета.
При названии алкинов нумерацию цепи начинают с того конца, ближе к которому находится тройная связь. Алкины, содержащие до 4 атомов углерода - газы, начиная с углеводородов с 5 атомами углерода - жидкости, начиная с С16Н30 - твердые тела.
Атомы углерода при тройной связи находятся в состоянии sp-гибридизации и имеют два гибризованных электрона, которые образуют две σ-связи. Одна σ-связь соединяет атомы углерода (sp-sp-связь), вторая - атомы углерода и водорода (sp-s-связь). Эти связи располагаются на одной линии под углом 180о. Две π-связи между атомами углерода образуются негибридизованными р-электронами. Таким образом, тройная связь является комбинацией одной σ- и двух π-связей.
Получение
1.Термическим крекингом метана(алкана) или его ближайших гомологов этана и пропана при высокой температуре (1200 -1500о). Основной способ получения ацетилена.
2CH4 =>CH≡СН + 3H2; 2C2H6 =>CH≡СН + 2H2
2. Дегидрогалогенированиемдигалогенпроизводныхалканов, содержащих галогены у одного или у соседних атомов углерода, путем нагревания со спиртовым раствором щелочи. Этим путем получают не только ацетилен, но и его гомологи. ДЛЯ ПРИМЕРА ХВАТИТ 1 РЕАКЦИИ.
CH3-CHCl2 + 2KOH =>CH≡CH + 2KCl + 2H2O
CH2Cl-CH2Cl + 2KOH => CH≡CH + 2KCl + 2H2O
CH2Cl-CHCl-CH3 + 2KOH => CH≡C-CH3 + 2KCl + 2H2O
3. Разложением карбида кальция водой. Это один из основных способов получения ацетилена. В промышленности карбид кальция получают совместным прокаливанием оксида кальция или кальция с углем.
СаС2 + Н2О => C2H2 + Ca(OH)2
4. Разложением ацетиленидов кислотами.
Cu-C≡С-Cu + 2HCl => СH≡СН + 2СuCl; СаС2 + 2HCl => C2H2 + CaCl2
20. Ацетиленовые углеводороды. Химические свойства: гидрирование, реакции электрофильного присоединения галогенов, галогеноводородов. Реакция Кучерова. Механизм реакций.
Алкины (ацетиленовые углеводороды) - углеводороды, имеющие в своей молекуле тройную связь. Общая формула алкинов - CnH2n-2 (n ≥ 2). Простейший алкин ацетилен.
Особенностью ацетилена и других алкинов, имеющих концевую тройную связь, является их способность отщеплять протон (кислотные свойства) под действием оснований, вследствие сильной поляризации связи ≡С-Н.
Реакция присоединения к алкинам идет ступенчато. На первой стадии идет присоединение к тройной связи с образованием двойной связи, на второй - присоединение к двойной связи с образованием насыщенного соединения.
Гидрогенирование (на никелевом или палладиевом катализаторе).
СН≡СН + H2 => СH2=CH2 + H2 => СH3-CH3
Галогенирование (например реакция обесцвечивание бромной воды).Реакция присоединения галогеноводорода протекает по электрофильному механизму
СН≡СН + Br2 =>СHBr=CHBr + Br2 => СHBr2-CHBr2
1,2-дибромэтен 1,1,2,2-тетрабромэтан
Гидрогалогенирование При полном гидрогалогенировании алкинов соблюдается правило Марковникова. Марковникова правило: при присоединении протонных кислот или воды к несимметричным алкенам или алкинаматом водорода присоединяется к наиболее гидрогенизированному атому углерода
Алкины. Реакции нуклеофильного присоединения спиртов, синильной и уксусной кислоты. Понятия о нуклеофильном механизме присоединения по тройной связи. Карбонилированиеалкинов. Окислительные превращения алкинов. Олигомеризация и полимеризация. Применение в промышленности.
Алкины (ацетиленовые углеводороды) - углеводороды, имеющие в своей молекуле тройную связь. Общая формула алкинов - CnH2n-2 (n ≥ 2). Простейший алкин ацетилен.
Реакции полимеризации
1. Димеризация идет в присутствии хлорида меди (I). Образующийся винилацетилен
служит сырьем для получения хлоропрена. Винилацетилен способен к дальнейшей
полимеризации и присоединяя молекулу ацетилена образует дивинилацетилен.
СН≡СН + СН≡СН => СH2=CH-С≡СН;
2. Тримеризация - объединение 3-х молекул ацетилена с образованием бензола
3СН≡СН => С6H6
Реакции олигомеризации
В присутствии солей меди(I) и хлорида аммония в водной среде ацетилен вступает в реакцию олигомеризации с образованием винилацетилена:

Реакция может идти дальше с образованием дивинилацетилена:

Реакции окисления
1. Ацетиленовые углеводороды легко окисляются при действии обычных окислителей, а при энергичном окислении разрываются по месту тройной связи. Так, ацетилен окисляется раствором перманганата калия до щавелевой кислоты (оксалата калия).
3СН≡СН + 8KMnO4 =>3KOOC-COOK + 8MnO2 + 2KOH + 2H2O
2. Горение - огромное количество тепла, выделяющееся при сгорании ацетилена в кислороде, позволяет проводить резание и сваривание металлов.
2СН≡СН + 5О2 => 4СО2 + 2H2O ∆H = -3200 кДж
Применение
Из всех ацетиленовых углеводородов серьёзное промышленное значение имеет только ацетилен, который является важнейшим химическим сырьём. Его применение:
1. В качестве топлива при резке и сваривании металлов
2. Производство ацетальдегида, а из него уксусную кислоту и этанол.
3. Производство хлорвинила сырья для получения медицинского полимера -
полихлорвинила.
4. Производство винилацетилена - сырья для получения хлоропренового каучука,
поливинилацетата.
Ацетиленовые углеводороды: С-Н-кислотные свойства алкинов с концевой тройной связью. Константа кислотности. Реакции замещения. Образование ацетиленидов, их свойства и синтетическое применение. Реакции альдегидов и кетонов с алкинами.
Реакции замещения
1. В отличие от этана и этилена, ацетилен имеет кислотные свойства. Атом водорода при углероде с тройной связью способен замещаться на атом металла. Так при пропускании ацетилена через аммиачный раствор нитрата серебра выпадает белый осадок ацетиленида серебра, аммиачный раствор хлористой меди дает красный осадок ацетиленида меди. Ацетилениды легко взрываются при ударе или нагревании. К ацетиленидам относится и карбид кальция СаС2.
СH≡СН + 2[Ag(NH3)2]Cl=>Ag-C≡С-Ag + 2NH4Cl
Ацетилениды разрушаются кислотами
Ag-C≡С-Ag + 2HCl => СH≡СН + 2AgCl
Ацетилениды щелочных и щелочно-земельных металлов используются для получения гомологов ацетилена.
Циклопарафины. Изомерия. Номенклатура. Методы получения: из дигалогенпроизводных, из солей дикарбоновых кислот, гидрогенизацией ароматических углеводородов, дегидроциклизацией парафинов, реакциями циклоприсоединения.
Циклоалканы(циклопарафины) - это насыщенные циклические углеводороды с общей формулой СnH2n. Циклоалканы могут иметь циклы, включающие три, четыре, пять, шесть и семь атомов углерода.
Осн. природный источник циклоалканов - нефть
Для циклоалканов характерны следующие виды изомерии:
1. Изомерия углеродного скелета
2. Пространственная
3. Межклассовая изомерия с алкенами
Все атомы углерода в молекулах циклоалканов имеют sp³-гибридизацию. Однако величины углов между гибриднымиорбиталями в циклобутане и особенно вциклопропане не 109°28', а меньше из-за геометрии.
Методы получения:
Дегалогенированиедигалогенпроизводныхалканов
H2C-CH2-Br + Mg => Н2С-СН2 + MgBr2
Гидрирование бензола и его гомологов (образуются циклогексан или его производные):
С6Н6 +3Н2 = С6Н12
Циклопарафины. Пространственное строение. Напряжение цикла, его виды. Инверсия цикла. Особенн










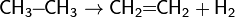




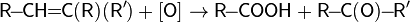 (кетон)
(кетон)
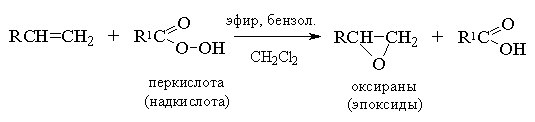



 18. 1,3 – алкадиены. Особенности молекулярной структуры. Химические свойства. Реакции электрофильного присоединения (механизм): 1,2- и 1,4-присоединение. Цикло присоединение по Дильсу-Альдеру. Полимеризация и сополимеризация диенов. Натуральный и синтетический каучук.
18. 1,3 – алкадиены. Особенности молекулярной структуры. Химические свойства. Реакции электрофильного присоединения (механизм): 1,2- и 1,4-присоединение. Цикло присоединение по Дильсу-Альдеру. Полимеризация и сополимеризация диенов. Натуральный и синтетический каучук.




