Твердые тела представляют собой ансамбли определенным образом связанных между собой атомов. Связи осуществляются в результате взаимодействия атомов (ионов) и валентных электронов, приводящего к понижению потенциальной энергии системы  и, прежде всего, энергии электронов, участвующих в связи.
и, прежде всего, энергии электронов, участвующих в связи.
Равновесное расстояние в твердом теле между атомами (ионами) – r0 соответствует минимуму потенциальной энергии кристаллической решетки. Величина г0 соответствует расстоянию, на котором силы притяжения между разноименными и силы отталкивания между одноименными зарядами уравновешиваются. С увеличением расстояния больше r0 сила связи убывает, a  растет пропорционально
растет пропорционально  , где n зависит от типа химической связи и меняется в пределах от n = 2÷3 (так называемая сильная связь – ковалентная, ионная, металлическая) до n = 6 (слабая связь – Ван-дер-Ваальса). Тип связи зависит от электронного строения свободных атомов и, прежде всего, от строения их валентных оболочек.
, где n зависит от типа химической связи и меняется в пределах от n = 2÷3 (так называемая сильная связь – ковалентная, ионная, металлическая) до n = 6 (слабая связь – Ван-дер-Ваальса). Тип связи зависит от электронного строения свободных атомов и, прежде всего, от строения их валентных оболочек.
Закономерности электронного строения свободных атомов передает периодическая система элементов Д. И. Менделеева. Состояние электрона в изолированном атоме и распределение электронов по оболочкам, подоболочкам и орбитам определяются четырьмя квантовыми числами.
Главное квантовое число п определяет размеры той или иной электронной оболочки в изолированном атоме, которую образуют электроны с одинаковым главным квантовым числом. Энергия электрона обратно пропорциональна п2.
Орбитальное квантовое число l. Оно определяет форму орбиты и величину момента количества движения электрона и может принимать значения от 0 до (п–1). Электроны с одинаковым квантовым числом l входят в одну подоболочку. Различные подоболочки обозначают следующими буквами:
| l
|
|
|
|
|
|
|
| Обозначение подоболочки
| s
| p
| d
| f
| q
| далее по латинскому алфавиту
|
Магнитное квантовое число  .Оно характеризует ориентацию плоскости орбиты электрона в пространстве.
.Оно характеризует ориентацию плоскости орбиты электрона в пространстве.  может принимать значения от – l до + l (включая 0) или (2 l +1) значений.
может принимать значения от – l до + l (включая 0) или (2 l +1) значений.
Спиновое квантовое число ms. Оно характеризует ориентацию собственного вращения электрона относительно оси z.  может принимать два значения:
может принимать два значения:  =
= 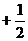 и
и  =
=  .
.
Распределение электронов по орбиталям подчиняется принципу Паули и экспериментально установленному правилу Хунда. Согласно принципу Паули, в атоме не может быть двух электронов с четырьмя одинаковыми квантовыми числами, т. е. на каждой орбите может находиться не больше двух электронов, различающихся спинами (спаренные электроны). Максимальное количество электронов в подоболочках s, р, d, f равно соответственно 2; 6; 10 и 14.
Согласно правилу Хунда, данная электронная конфигурация обладает наименьшей энергией при максимальном числе неспаренных валентных электронов. В качестве примера на рис. 2.1. показано распределение валентных 2 р -электронов в изолированном атоме углерода. Они размещаются по одному на двух р -орбиталях.
Заполнение подоболочек происходит в такой последовательности: 1s, 2s, 2p, Зs, Зp, 4s, Зd, 4р, 5s, 4d, 5р, бs, 4f, 5d, 6р, 7s, 5f, 6d. При этом энергия электронов на заполняемой орбите выше, чем на заполненной. Характер и полнота застройки электронных орбиталей валентной оболочки атома определяют тип химических связей, возникающих при образовании элементарного вещества. Элементы делят на металлы (простые и переходные), полупроводники и диэлектрики (химические связи в диэлектриках качественно не отличаются от связей в полупроводниках). Элементы, занимающие левую и центральную части развернутой периодической системы элементов – металлы, а элементы, занимающие правую часть, – преимущественно полупроводники и диэлектрики.

Рисунок 2.1. – Распределение электронов у изолированных атомов углерода (основное состояние)
Рисунок 2.2. – Схема изменения потенциала взаимодействия двух атомов 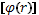 в зависимости от межатомного расстояния. В начале координат помещен фиксированный атом, r – равновесное межатомное расстояние, r – расстояние между атомами
в зависимости от межатомного расстояния. В начале координат помещен фиксированный атом, r – равновесное межатомное расстояние, r – расстояние между атомами
В материаловедении полупроводников и диэлектриков принято подгруппы, размещенные в левой и центральной частях развернутой периодической системы (табл. 2.1):
Таблица 2.1. Значения энергии химической связи ряда элементов, эВ/ат

Эта таблица взята из книги Ч.Киттеля «Введение в физику твердого тела»: Пер. с англ. – М.: Наука. – 1978. Под энергией связи понимается энергия, которая требуется для разделения твердого тела на отдельные нейтральные атомы при 0К.
в которых находятся только металлы, обозначать буквой А, а подгруппы, размещенные в правой части, – буквой В (в химии обычно принято иное обозначение: к A -подгруппам (или главным подгруппам) относят те, в которых идет застройка «ns -подоболочек при незаполненных (n – 1) d -подоболочках и застройка np-подоболочек; к B -подгруппам (или побочным подгруппам) относят те, в которых идет застройка (п–1) d и (и – 2) f подоболочек, а также ns -под-оболочек при заполненных (n – 1) d -подоболочках).
Подчеркнем, что валентными могут быть электроны не только внешней, но и предшествующей оболочки.При сближении изолированных атомов и образовании атомного ансамбля электронные оболочки (прежде всего оболочки валентных электронов) перекрываются. Взаимодействие валентных электронов, принадлежащих разным атомам, вызывает расщепление дискретных энергетических уровней электронов изолированных атомов на подуровни (эффект «возмущения»). Чем энергетически дальше от ядра удален соответствующий уровень, тем больше расстояние между сближающимися атомами, с которого начинается расщепление. Практически при равновесном межатомном расстоянии r0 (рис. 2.2.) расщепляются уровни всех электронов, участвующих в образовании связей.
При возникновении химических связей изменяются волновые функции валентных электронов. В элементарных веществах различают три типа химической связи: металлическую, ковалентную (гомеополярную) и Ван-дер-ваальсову. В соединениях и растворах возможна также ионная (гетерополярная) связь.
Как правило, в сложных, а часто и в элементарных веществах реализуются смешанные (гетеродесмические) связи. Основными характеристиками связи являются энергия связи, длина связи, энергетический спектр валентных электронов.
Под энергией связи понимают величину энергии, которую необходимо затратить, чтобы разрушить химические связи, возникшие при образовании твердого тела, и перевести образующие его атомы в свободное состояние. Количественно энергию связи можно приближенно оценивать по величине энергии, которую нужно затратить, чтобы перевести валентные электроны твердого тела на уровни свободного атома, или по теплоте сублимации.
Величину энергии связи можно также качественно характеризовать длиной связи, величиной упругих модулей, температурой плавления вещества, твердостью вещества (чем больше величина энергии связи, тем, как правило, больше величины названных характеристик).
Различные химические связи приводят к возникновению различных кристаллохимических структур, каждая из которых характеризуется своим, присущим ей пространственным расположением атомов (ионов), а следовательно, своим базисом, типом элементарной ячейки, координационным числом и т. п. При этом различные химические связи характеризуются разной степенью направленности (разной плотностью распределения валентных электронов в разных кристаллографических направлениях). Каждая кристаллохимическая структура характеризуется двумя решетками: кристаллической решеткой и обратной решеткой. Размерность вектора кристаллической решетки – длина (L), а размерность вектора обратной решетки – обратная длина (1/L).
Обратная решетка строится в пространстве волновых чисел к. (Существует однозначное соответствие между основными векторами кристаллической решетки (а, b, с) и основными векторами обратной решетки (а*, b*, с*): а*а=2π; b*b=2π; с*с=2π; а*b=0; b*а=0; с*а=0; а*с=0; b*с=0; с*b=0. Следует отметить, что в кристаллографии (в отличие от физики и материаловедения твердого тела) обычно в приведенных выше скалярных произведениях векторов множитель 2  опускают и обратную решетку строят просто в обратном пространстве). Структура обратной решетки так же реальна, как и структура кристаллической решетки, а важность ее связана с тем, что многие волновые процессы, протекающие в кристаллах, в том числе движение валентных электронов (а также распределение их по энергиям), в значительной степени определяются структурой обратной решетки.
опускают и обратную решетку строят просто в обратном пространстве). Структура обратной решетки так же реальна, как и структура кристаллической решетки, а важность ее связана с тем, что многие волновые процессы, протекающие в кристаллах, в том числе движение валентных электронов (а также распределение их по энергиям), в значительной степени определяются структурой обратной решетки.
Следовательно, кристаллическая и обратная решетки определяются возникающими химическими связями при объединении атомов в твердое тело, в связи с этим подробное описание химической связи в том или ином твердом теле не может быть проведено без анализа его кристаллической и обратной решеток. В k -пространстве строят зоны, поверхности которых соответствуют волновым векторам тех электронных волн, которые будут дифрагировать на кристаллической решетке. Это зоны Бриллюэна.
Для каждой кристаллической решетки в обратном пространстве может быть построен набор зон Бриллюэна (первая зона, вторая зона, n -ная зона). На рис. 2.3 приведена первая зона Бриллюэна для г. ц. к. решетки и решетки алмаза. Зоны Бриллюэна представляют собой симметричные многогранники, обладающие элементами симметрии точечной группы.

Рисунок 2.3. – Зоны Бриллюэна решеток г. ц. к. и алмаза
Важную роль в определении зонных структур (точнее, зон разрешенных и запрещенных энергий электронов) конкретных веществ играют не только поверхности, но и элементы симметрии соответствующих зон – Бриллюэна.
§ 2. Типы химических связей
Металлическая связь приводит к такому энергетическому спектру валентных электронов, когда в твердом теле одна из зон, возникающих из уровней электронов свободных атомов, оказывается во всем интервале существования твердого тела заполненной электронами лишь частично (точнее, лишь часть состояний в зоне оказывается занятой). Металлическая связь возникает в результате взаимодействия валентных электронов и ионного остова, при этом валентные электроны в большинстве случаев делокализованы и принадлежат всей решетке. В простейших случаях (например, для простых металлов, расположенных в IA подгруппе) модель металлического кристалла выглядит следующим образом: ионный остов погружен в «электронную жидкость». В распределении электронной плотности в геометрическом пространстве, как правило, нет заметной анизотропии. Связи в простых А – металлах построены проще, чем в переходных металлах и следующих за ними металлах с заполненными d и f подоболочками и расположенными в B – подгруппах. Энергия связи у простых A – металлов, как правило, заметно ниже, чем у переходных металлов и В -металлов, расположенных в том же периоде (см. табл. 2.1).
Кроме того, у простых металлов и неметаллов прочность связей в пределах одной подгруппы понижается с увеличением номера периода, а у переходных металлов, как правило, наоборот, повышается.
Ковалентные связи также результат взаимодействия валентных электронов и ионного остова твердого тела. Ковалентная связь осуществляется парой валентных электронов с противоположно направленными спинами, причем в случае чистых веществ эти электроны принадлежат разным атомам. При возникновении ковалентной связи орбиты валентных электронов, участвующих в образовании связей, перекрываются, при этом, чем больше перекрытие, тем прочнее связь. Для ковалентной связи характерно анизотропное распределение плотности валентных электронов. В геометрическом пространстве (ковалентная связь – направленная связь). Валентные электроны (точнее, электроны, участвующие в образовании связей) делокализованы (не принадлежат отдельным атомам), но при этом вероятность пребывания их в различных областях кристаллической решетки различна: максимальная вероятность (максимальная плотность валентных электронов) обнаружена в направлениях кратчайших межатомных расстояний.
Ковалентные связи являются насыщенными в том смысле, что не могут возникнуть ординарные ковалентные связи с числом электронов, большим, чем два.
Ковалентная связь приводит к такому энергетическому спектру валентных электронов, когда одна из зон, возникших из уровней электронов свободных атомов, при 0 К оказывается полностью свободной (зона проводимости), при этом она отделена энергетической щелью (запрещенная зона) от полностью занятой зоны (валентная зона).
Кристаллы, в которых реализуются ионные связи, состоят из положительно и отрицательно заряженных ионов (рис. 2.4.).
Ионная связь обеспечивается в основном силами электростатического притяжения (кулоновскими силами), возникающими между разноименно заряженными ионами. При этом ионы достраивают свою внешнюю электронную оболочку до устойчивой конфигурации – электронной оболочки ближайшего в периодической системе инертного газа – присоединением недостающих электронов (анионы) или отдачей электронов (катионы). Следует подчеркнуть, что полное разделение положительных и отрицательных зарядов, т.е. идеальная ионная связь, никогда не осуществляется. Из-за волновых свойств электронов вероятность нахождения

Рисунок 2.4. – Структура кристалла NaCl (а) и схема распределения электронной плотности в NaCl (б)
валентных электронов вблизи ядра катиона мала, но никогда не бывает равна нулю. Поэтому в ионных кристаллах наряду с электростатическим притяжением заряженных ионов силы связи обусловлены и перекрытием электронных орбит валентных электронов. Межатомные (межионные) расстояния в ионных кристаллах, а, следовательно, их ионные радиусы, определяются уравновешиванием сил притяжения между анионами и катионами и сил отталкивания между их электронными оболочками.
Важная особенность ионной связи – ее поляризуемость, вызванная полиризуемостью ионов. Это связано с тем, что центры тяжести отрицательного и положительного зарядов иона не совпадают. Поляризуемость характеризуется дипольным моментом М, пропорциональным напряженности электрического поля и разным произведению заряда Ze на дипольное расстояние d между центрами положительного и отрицательного зарядов иона (рис. 2.5.):
М = α *Е = Zed,
где α* – коэффициент пропорциональности, называемой поляризуемостью; Е – напряженность электрического поля, возникающая в ионе при смещении зарядов.

Рисунок 2.5. – Схема поляризации ионов: К – катион (положительный заряд иона); А – анион (отрицательный заряд иона)
Значение поляризуемости α приблизительно постоянно для данного иона. Чем больше радиус иона, тем легче он поляризуется. Поэтому анионы в общем случае поляризуются сильнее, чем катионы. Ниже приведены значения α для некоторых ионов, расположенных в 1А (Li+, K+) и VIВ подгруппах(О2-, Se2-, Te2-), подтверждающих это положение:
| ионы
| Li+
| K+
| О2-
| Se2-
| Te2-
|
| α*1024
| 0.0075
| 0.087
| 0.312
| 0.84
| 0.96
|
| R, нм
| 0,068
| 0,133
| 0,146
| 0,192
| 0,221
|
Приведенные данные показывают, что в пределах подгруппы с ростом радиуса иона значение поляризуемости растет.
Структура ионных кристаллов, а, следовательно, и значения координационных чисел зависят от относительных размеров аниона и катиона.
Условие устойчивости структуры заключается в том, чтобы каждый ион соприкасался с ионами противоположного знака (рис. 2.6). Когда ион соприкасается одновременно с ионами того же и противоположного знака, структура менее устойчива. Наконец, если размер малого иона меньше размера (поры) между соприкасающимися крупными ионами противоположного знака, структура получается неустойчивой и перестраивается в такую, в которой выполняется указанное выше условие (рис. 2.6.).

Рисунок 2.6. – Устойчивость структур ионных кристаллов в зависимости от относительных размеров аниона (Л) и катиона (к). Устойчивость структур уменьшается в направлении а  б
б  в
в
Поэтому для ионных кристаллов существуют пределы устойчивости структур с различными координационными числами. Значения этих пределов определяются из простых геометрических соотношений. Ниже приведены предельные значения отношения ионных радиусов, возможные для структур с разными координационными числами:
| ZK
|
|
|
|
|

| 0,73 – 1,37
| 0,41 – 0,73
1,37 – 2,41
| 0,22 – 0,41
2,41 – 4,45
| 0,15 – 0,22
4,45 – 6,45
|
Энергия кристаллической решетки в случае ионных кристаллов практически полностью определяется силами кулоновского взаимодействия (кулоновская энергия или энергия Маделунга) и может быть определена из выражения
 (2.1)
(2.1)
где α – постоянная Маделунга, учитывающая вклад в энергию кристаллической решетки взаимодействия ионов, расположенных в нескольких ближайших к рассматриваемому иону координационных сферах; N – число ионов в одной молекуле, равное числу NА, умноженному на число ионов (∑m) в молекуле (см. ниже); Z1, Z2 – валентности взаимодействующих ионов; R0 – расстояние от рассматриваемого иона до ионов первой координационной сферы.
Постоянная Маделунга в теории ионной связи играет важную роль. Рассмотрим ее вычисление на примере NaCL. В качестве иона, относительно которого ведется расчет, выберем ион натрия (заряд его равен +е). Ион натрия (см. рис. 2.4, а) окружен шестью отрицательными ионами хлора (первая координационная сфера), находящимися на расстоянии R, двенадцатью положительными ионами натрия (вторая координационная сфера) на расстоянии R  , восемью отрицательными ионами хлора (третья координационная сфера) на расстоянии R
, восемью отрицательными ионами хлора (третья координационная сфера) на расстоянии R  , шестью положительными ионами натрия (четвертая координационная сфера) на расстоянии R
, шестью положительными ионами натрия (четвертая координационная сфера) на расстоянии R  ; двадцатью четырьмя отрицательными ионами хлора (пятая координационная сфера), находящимися на расстоянии R
; двадцатью четырьмя отрицательными ионами хлора (пятая координационная сфера), находящимися на расстоянии R  и т.д. Ясно, что размещение ионов в координационных сферах зависит от типа решетки. Аналогичный подсчет был бы получен, если в качестве иона, относительно которого проводят расчет, был бы выбран ион хлора Cl-.
и т.д. Ясно, что размещение ионов в координационных сферах зависит от типа решетки. Аналогичный подсчет был бы получен, если в качестве иона, относительно которого проводят расчет, был бы выбран ион хлора Cl-.
Энергия связи одного иона в решетке NaС1 с учетом кулоновского взаимодействия равна:
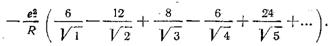
Знакопеременный ряд, стоящий в скобках, и есть постоянная Маделунга α для NаС1. По существу постоянная Маделунга учитывает застройку координационных сфер и расстояние между координационными сферами. Величина членов ряда, образующего постоянную Маделунга, определяется структурой кристаллической решетки, а сумма ряда имеет определенную величину. Ниже приведены значения постоянной Маделунга α и величины Σm для ряда кристаллических структур:
| Кристаллические структуры
| α
| Σm
|
| Хлористый натрий (NaCl)
| 1,747565
|
|
| Корунд (Al2O3)
| 4,17
|
|
| Хлористый цезий (CsCl)
| 1,762675
|
|
| Цинковая обманка (ZnS)
| 1,6381
|
|
В таблице 2.2. приведены рассчитанные и экспериментально определенные значения энергий кристаллических решеток (энергий связи) для некоторых ионных кристаллов.
Таблица 2.2. Значения энергий связи щелочно-галоидных кристаллов со структурой хлористого натрия
| кристалл
| (RA+RK), нм
| Энергия связи, кДж/моль
|
| эксперимент
| расчет
|
| LiK
| 2,014
| – 1015,2
| – 1014,8
|
| LiCl
| 2,570
| – 833,4
| – 808,3
|
| LiBr
| 2,751
| – 793,3
| – 758,4
|
| LiI
| 3,0
| – 744,6
| – 696,0
|
| Примечание. Все значения даны для комнатной температуры
|
Поляризационная связь (или связь типа Ван-дер-Ваальса) наблюдается в молекулярных кристаллах, а также в кристаллах некоторых полупроводников и диэлектриков (наряду с другими типами связи). К молекулярным кристаллам относятся кристаллы инертных газов Nе, Аг, Кг, Хе, а также кристаллы I2, Cl2, O2, HCl, HBr, H2O, CO, NH3 и ряда других веществ. В большинстве молекулярных кристаллов (например, в I2, Cl2, O2, HCl и др.) следует различать два типа связей: внутримолекулярные и межмолекулярные. Межмолекулярные связи, а также связи между атомами инертных газов в кристаллах и являются связями типа Ван-дер-Ваальса. Как правило, эти связи намного слабее внутримолекулярных, однако они определяют ряд важных свойств, в частности температуру плавления молекулярного кристалла. В основе связей типа сил Ван-дер-Ваальса лежит поляризация молекул, образующих молекулярный кристалл.
Ниже приведены некоторые свойства молекулярных кристаллов, рассчитанные по формуле (2.2):
| кристаллы
| Ne
| Ar
|
| Hсубл, кДж/моль
| 2,47
| 8,51
|
| Ер, кДж/моль
| 1,97
| 8,72
|
| Тпл, К
|
|
|
Поляризация и дипольный момент в этом случае возникает вследствие того, что при тепловых колебаниях атомов, образующих молекулы, центры тяжести положительных зарядов (ядер) и отрицательных зарядов (электронов), имеющих разную массу и, следовательно, инерцию, оказываются смещенными друг относительно друга.
На рисунке 2.7. схематично показаны основные типы химических связей в кристаллах твердых веществ.

Рисунок 2.7. – Основные типы связей в кристаллах: а – ван-дер-Ваальсовая; б – ионная; в – металлическая; г – ковалентная
Энергию решетки кристалла с ван-дер-ваальсовой связью рассчитывают по формуле:
Ер = U0Т + U1 + U2 + U3 (2.2)
где U0Т–энергия отталкивания молекул [U0Т = – b ехр(– Rо/ρ), в которой Rо – расстояние между центрами молекул, bи ρ – константы, определяемые эмпирически]; U1,U2,U3– энергии притяжения, связанные с дипольным взаимодействием молекул; U1 – энергия ориентационного взаимодействия, вызванная собственным дипольным электрическим моментом молекул ( U1 = –  , где А зависит от величины дипольного момента и температуры); U2 – энергия индукционного взаимодействия, вызванная дипольными моментами молекул, наведенными под воздействием окружающих молекул (U2= –
, где А зависит от величины дипольного момента и температуры); U2 – энергия индукционного взаимодействия, вызванная дипольными моментами молекул, наведенными под воздействием окружающих молекул (U2= –  , где В зависит от величины наведенного дипольного момента, температуры и поляризуемости молекул); U3 – энергия дисперсионного взаимодействия, вызванная флуктуационным появлением дипольного момента у молекулы, входящей в молекулярный кристалл, из-за случайного несовпадения «центров тяжести» электронов и заряда ядра ( U3=
, где В зависит от величины наведенного дипольного момента, температуры и поляризуемости молекул); U3 – энергия дисперсионного взаимодействия, вызванная флуктуационным появлением дипольного момента у молекулы, входящей в молекулярный кристалл, из-за случайного несовпадения «центров тяжести» электронов и заряда ядра ( U3=  , где С зависит от температуры, поляризуемости молекул и собственной частоты колебаний молекул).
, где С зависит от температуры, поляризуемости молекул и собственной частоты колебаний молекул).
§ 3. Химическая связь и атомные и ионные радиусы
Важной характеристикой химической связи является ее длина, равная в твердых телах кратчайшему межатомному расстоянию. У элементов, расположенных в одной подгруппе периодической системы и образующих вещества с одним типом химической связи, с ростом атомного номера растут кратчайшие межатомные расстояния (растет длина одиночных химических связей) и падает прочность химических связей (исключение составляют переходные металлы). Величины кратчайших межатомных расстояний в конденсированных телах описываются с помощью атомных и ионных радиусов. Под атомным радиусом элемента в общем случае понимают половину кратчайшего равновесного межатомного расстояния в кристаллической решетке элемента. Величина атомного радиуса химического элемента остается приблизительно неизменной в любых фазах, в образовании которых участвует данный элемент, если тип химической связи и координационное число в этих фазах такое же, как и у химического элемента. Однако если изменяется тип химической связи или при сохранении типа связи изменяется координационное число, то атомный радиус элемента приобретает новое значение.
Таким образом, каждый химический элемент можно характеризовать набором атомных радиусов, описывающих размеры его атомов при образовании металлических, ковалентных и ван-дер-ваальсовых связей. Часто используют понятия «металлический атомный радиус элемента для координационного числа, равного...», «ковалентный атомный радиус элемента для координационного числа, равного...». Например, тетраэдрический ковалентный радиус элемента описывает размеры его атомов в фазах с ковалентным типом химической связи и с координационным числом, равным 4, а октаэдрический ковалентный радиус этого же элемента описывает размеры его атомов в фазах с ковалентной связью, но с координационным числом, равным 6.
Влияние типа химической связи на величину атомных радиусов видно из следующих примеров. В кристаллической структуре полупроводниковых элементов VВ подгруппы наблюдается два типа связей: ковалентные и Ван-дер-ваальсовы. Расстояния между атомами, связанными ковалентной связью, значительно меньше, чем расстояния между соседними атомами, связанными силами типа сил Ван-дер-Ваальса (для мышьяка эти расстояния равны 0,251 и 0,35 нм соответственно). Аналогичное явление наблюдается и в металлах. Например, у цинка, кристаллизующегося в гексагональную решетку с отношением с/а=1,86, расстояние между соседними атомами в плоскостях {0001} равно 0,26649 нм, а между соседними атомами в смежных плоскостях {0001} равно 0,29129 нм. В таких случаях атомный диаметр может быть выбран по-разному: как минимальное расстояние (и это предпочтительно) или как среднеарифметическое.
Атомный радиус резко изменяется при изменении координационного числа. Увеличение координационного числа всегда сопровождается увеличением атомных радиусов. При этом относительная разность значений атомных радиусов, соответствующих двум данным координационным числам, в структурах с одинаковым типом химической связи сохраняется приблизительно неизменной. Ниже приведены переходные коэффициенты (Rzk/Rzk =12) для значений атомных радиусов (Rz) в структурах с разными координационными числами (Zк):
| Zк
|
|
|
|
|
|
|

| 1,0
| 0,97
| 0,96
| 0,88
| 0,81
| 0,72
|
Атомные радиусы элементов можно сопоставлять только при одинаковом координационном числе и одинаковом типе химической связи. Например, если рассматривается атомный радиус алюминия в твердом растворе замещения и кремнии (твердый раствор кристаллизуется в кубическую решетку алмаза с ZК=4), то атомный радиус элементарного алюминия (кристаллизуется в г. ц. к. структуру с ZК=12) должен быть приведен к значению тетраэдрического ковалентного радиуса с ZК =4.
При полиморфных превращениях твердых веществ происходит изменение кристаллических структур, сопровождающееся изменением атомных радиусов. Например, при 906 °С железо из γ-модификации (г. ц.к. решетка, коэффициент компактности η*=0,74, Zk=12 переходит при охлаждении в α-модификацию (о. ц. к. решетка, η =0,68, Zk = 8), при этом атомный металлический радиус железа уменьшается на 3 %, а удельный объем железа (∆Vуд) возрастает на 0,8 %. Если бы при переходе γ-Fe в α-Fe атомные радиусы оставались неизменными, удельный объем возрос бы на огромную величину: Vуд = 9 %. (Здесь η*– отношение объема, занимаемого атомами в элементарной ячейке, к объему ячейки: η = Vат/Vяч).
Следует отметить, что величина атомного радиуса элемента зависит от температуры, давления, состава фазы (в частности, в твердых растворах наблюдается отклонение от правила Вегарда), однако влияние перечисленных параметров на величину атомного радиуса невелико и это обстоятельство позволяет широко использовать представление об атомных радиусах при рассмотрении кристалло-химических структур различных фаз. Атомные радиусы обычно определяют в нанометрах с точностью до четвертого знака после запятой, а прецизионно – до седьмого.
В кристаллах элементарных металлов с решетками г. ц. к., о. ц. к. и г. к. (с отношением с/а=1,633) атомный радиус определяется как половина межатомного расстояния между ближайшими атомами. В случае твердых растворов, металлические атомные радиусы изменяются сложным образом.
В кристаллах элементарных полупроводников под ковалентными радиусами элементов понимают половину межатомного расстояния между ближайшими атомами, соединенными единичной ковалентной связью: Особенностью ковалентных радиусов является их приблизительное постоянство в разных ковалентных структурах с одинаковыми Zк. Так, расстояния в одинарных связях С—С в алмазе и насыщенных углеводородах практически одинаковы и равны 0,154 нм. Это позволяет оценивать неизвестные ковалентные радиусы элементов следующим образом. Пусть элемент А (ковалентный радиус которого неизвестен) образует соединение АВ с ковалентными связями, в котором RковВ известно. Тогда ковалентный радиус элемента А равен: RковА =RА–В–RковВ.
Ионные радиусы не могут быть определены как полсуммы расстояний между ближайшими ионами. Как правило, размеры катионов и анионов резко различаются. Кроме того, симметрия ионов отличается от сферической. Существует несколько подходов к оценке значений ионных радиусов. На основе этих подходов оценивают ионные радиусы элементов в соединениях, а затем из экспериментально найденных межатомных расстояний определяют ионные радиусы других элементов. Прямым экспериментальным методом, позволяющим получить картину распределения электронной плотности в кристалле, а, следовательно, представления об истинных ионных радиусах, является рентгеноструктурный метод.



 и, прежде всего, энергии электронов, участвующих в связи.
и, прежде всего, энергии электронов, участвующих в связи. , где n зависит от типа химической связи и меняется в пределах от n = 2÷3 (так называемая сильная связь – ковалентная, ионная, металлическая) до n = 6 (слабая связь – Ван-дер-Ваальса). Тип связи зависит от электронного строения свободных атомов и, прежде всего, от строения их валентных оболочек.
, где n зависит от типа химической связи и меняется в пределах от n = 2÷3 (так называемая сильная связь – ковалентная, ионная, металлическая) до n = 6 (слабая связь – Ван-дер-Ваальса). Тип связи зависит от электронного строения свободных атомов и, прежде всего, от строения их валентных оболочек. .Оно характеризует ориентацию плоскости орбиты электрона в пространстве.
.Оно характеризует ориентацию плоскости орбиты электрона в пространстве.  может принимать два значения:
может принимать два значения: 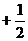 и
и  .
.
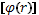 в зависимости от межатомного расстояния. В начале координат помещен фиксированный атом, r – равновесное межатомное расстояние, r – расстояние между атомами
в зависимости от межатомного расстояния. В начале координат помещен фиксированный атом, r – равновесное межатомное расстояние, r – расстояние между атомами
 опускают и обратную решетку строят просто в обратном пространстве). Структура обратной решетки так же реальна, как и структура кристаллической решетки, а важность ее связана с тем, что многие волновые процессы, протекающие в кристаллах, в том числе движение валентных электронов (а также распределение их по энергиям), в значительной степени определяются структурой обратной решетки.
опускают и обратную решетку строят просто в обратном пространстве). Структура обратной решетки так же реальна, как и структура кристаллической решетки, а важность ее связана с тем, что многие волновые процессы, протекающие в кристаллах, в том числе движение валентных электронов (а также распределение их по энергиям), в значительной степени определяются структурой обратной решетки.



 б
б 
 (2.1)
(2.1) , восемью отрицательными ионами хлора (третья координационная сфера) на расстоянии R
, восемью отрицательными ионами хлора (третья координационная сфера) на расстоянии R  , шестью положительными ионами натрия (четвертая координационная сфера) на расстоянии R
, шестью положительными ионами натрия (четвертая координационная сфера) на расстоянии R  ; двадцатью четырьмя отрицательными ионами хлора (пятая координационная сфера), находящимися на расстоянии R
; двадцатью четырьмя отрицательными ионами хлора (пятая координационная сфера), находящимися на расстоянии R  и т.д. Ясно, что размещение ионов в координационных сферах зависит от типа решетки. Аналогичный подсчет был бы получен, если в качестве иона, относительно которого проводят расчет, был бы выбран ион хлора Cl-.
и т.д. Ясно, что размещение ионов в координационных сферах зависит от типа решетки. Аналогичный подсчет был бы получен, если в качестве иона, относительно которого проводят расчет, был бы выбран ион хлора Cl-.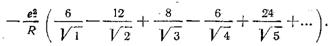

 , где А зависит от величины дипольного момента и температуры); U2 – энергия индукционного взаимодействия, вызванная дипольными моментами молекул, наведенными под воздействием окружающих молекул (U2= –
, где А зависит от величины дипольного момента и температуры); U2 – энергия индукционного взаимодействия, вызванная дипольными моментами молекул, наведенными под воздействием окружающих молекул (U2= –  , где В зависит от величины наведенного дипольного момента, температуры и поляризуемости молекул); U3 – энергия дисперсионного взаимодействия, вызванная флуктуационным появлением дипольного момента у молекулы, входящей в молекулярный кристалл, из-за случайного несовпадения «центров тяжести» электронов и заряда ядра ( U3=
, где В зависит от величины наведенного дипольного момента, температуры и поляризуемости молекул); U3 – энергия дисперсионного взаимодействия, вызванная флуктуационным появлением дипольного момента у молекулы, входящей в молекулярный кристалл, из-за случайного несовпадения «центров тяжести» электронов и заряда ядра ( U3=  , где С зависит от температуры, поляризуемости молекул и собственной частоты колебаний молекул).
, где С зависит от температуры, поляризуемости молекул и собственной частоты колебаний молекул).



