ПРЕОБРАЗОВАНИЯ ЭНЕРГИИ
Необратимость теплообмена
Пусть газ помещен в сосуд с адиабатными стенками, разделенный на две части диатермической перегородкой. Все координаты, определяющие производство работы в подсистемах, например, объёмы остаются постоянными:  ,
, 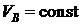 . Системы гомогенны
. Системы гомогенны  ,
,  , но
, но  . Диатермическая перегородка допускает обмен теплом, но при этом будем считать, что гомогенность и равновесность каждой из подсистем остаются неизменными. Это позволяет предположить, что процессы изменения внутренней энергии в каждой из подсистем будут протекать обратимо. Но в целом в адиабатной системе
. Диатермическая перегородка допускает обмен теплом, но при этом будем считать, что гомогенность и равновесность каждой из подсистем остаются неизменными. Это позволяет предположить, что процессы изменения внутренней энергии в каждой из подсистем будут протекать обратимо. Но в целом в адиабатной системе  процесс теплообмена необратим. Покажем это.
процесс теплообмена необратим. Покажем это.
 Рисунок 7.1
К выводу необратимости теплообмена
Рисунок 7.1
К выводу необратимости теплообмена
|
По отношению к каждой из подсистем такая необратимость носит внешний характер. Запишем первое начало термодинамики для процессов, протекающих в подсистемах «А»и«В»:  ,
,  ;
;  ,
,  . Но при этом внутренняя энергия полной адиабатной системы остается неизменной
. Но при этом внутренняя энергия полной адиабатной системы остается неизменной
 ,
,
откуда следует 
 . (7.1)
. (7.1)
Найдем соответствующее тепловым эффектам изменение энтропии в подсистемах:
 ;
;  .
.
Тепло и измененные энтропии определяются по обратимым процессам, протекающим в соответствии с принятыми допущениями в каждой из подсистем.
Энтропия системы в целом должна возрасти, т.к. в ней протекает необратимый процесс. Приращение энтропии системы найдем как сумму изменения энтропии в подсистемах «А» и «В».
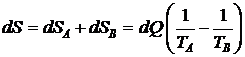 . (7.2)
. (7.2)
 тепло переходит от В к А, следовательно
тепло переходит от В к А, следовательно 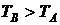 .
.
Приращения энтропии  ;
;  , но т.к.
, но т.к.  , то
, то
 . (7.3)
. (7.3)
Т.о. можно сделать вывод о том, что энтропия системы, воспринимающей тепло, возрастает больше, чем убывает энтропия системы, отдающей его. Следовательно, энтропия полной системы в рассмотренном примере в соответствии со вторым законом термодинамики возрастает 
 Рисунок 7.2
Необратимость теплообмена
Рисунок 7.2
Необратимость теплообмена
|
 . (7.4)
. (7.4)
Иногда для иллюстрации необратимости теплообмена применяют энтропийные диаграммы (рисунок 7.2)
Теплообмен связан с переносом энергии. Очевидно, что перенос энергии приводит к переносу энтропии в том же направлении. Можно отметить, что в диатермической перегородке, где проявляется скачок температуры, осуществляется производство энтропии
 . (7.5)
. (7.5)
Произведенная энтропия увеличивает энтропию, поступающую от системы В, так что система А воспринимает энтропию величиной
 . (7.6)
. (7.6)
Необратимость процесса может оцениваться величиной произведённой энтропии.
Энергию, передаваемую в форме тепла, за время  можно записать
можно записать
 . (7.7)
. (7.7)
Диссипация энергии
При протекании в системе обратимого процесса энергия, переходящая через границу в форме тепла, равна
 , (7.9)
, (7.9)
а энергия, передаваемая в форме работы, – по изменению обобщенных координат  ,
, 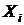

 . (7.10)
. (7.10)
Тепло и работа, исходя из объединенного уравнения первого и второго начал термодинамики, соответствуют отдельным слагаемым дифференциала внутренней энергии
 . (7.11)
. (7.11)
При необратимых процессах изменение энтропии происходит как вследствие её переноса, так и из-за её производства
 , (7.12)
, (7.12)
где  – произведенная энтропия.
– произведенная энтропия.
Если теплообмен отсутствует между частями системы, т.е. внутри системы, то производство энтропии происходит из-за наличия диссипации: трение, тепловыделение в проводнике при прохождении тока, работа вала и т.д.
Рассмотрим две адиабатные системы (рисунок 7.3).
 Рисунок 7.3
Адиабатные системы с подводом энергии в форме работы
и изменения обобщенных координат
Рисунок 7.3
Адиабатные системы с подводом энергии в форме работы
и изменения обобщенных координат
|
Для них первое начало может быть записано в виде  . В первой системе обобщенная координата – объём, во второй – объём и электрический заряд.
. В первой системе обобщенная координата – объём, во второй – объём и электрический заряд.






Они при производстве работы  остаются постоянными
остаются постоянными  ,
,
 .
.
где  – элементарнее изменение электрического разряда
– элементарнее изменение электрического разряда
Тогда, для производства энтропии можно записать
 ;
; 
 . (7.13)
. (7.13)
Энергия, подводимая в форме работы при постоянных или даже отсутствующих обобщенных координатах, приводит к увеличению внутренней энергии в процессе производства энтропии.
Необратимый процесс, при котором энергия, подводимая в форме работы, воспринимается системой без изменения обобщенных координат  или
или 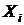 , называется диссипативным (диссипация работы).
, называется диссипативным (диссипация работы).
Количественно диссипирующая энергия может быть рассчитана по выражению
 .
.
Тогда для приведенных примеров
 ,
,
т.е. подводимая работа полностью диссипирует.
С учетом диссипирующей энергии уравнение для расчета приращения энтропии примет вид
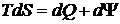 . (7.14)
. (7.14)
Тогда для необратимого процесса при квазистатических изменениях состояния системы следует
 . (7.15)
. (7.15)
Для адиабатной системы  ,
,  и
и
 (7.16)
(7.16)
Таким образом площадь под кривой изображающей в 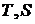 – диаграмме реальную адиабату равна энергии диссипации. В случае простой системы с объёмом как единственной обобщённой координаты можно записать соотношение
– диаграмме реальную адиабату равна энергии диссипации. В случае простой системы с объёмом как единственной обобщённой координаты можно записать соотношение

 .
.
Откуда для работы можно получить
 и
и  . (7.17)
. (7.17)
Эксергия и анергия
Если в качестве критерия выбрать степень превратимости энергии в другие виды, то известные формы энергии можно подразделить на три группы:
1. Неограниченно превратимая энергия (эксергия), например механическая или электрическая энергии.
2. Ограниченно превратимая энергия (тепло, внутренняя энергия). Их преобразование в эксергию существенно ограниченно вторым началом термодинамики.
3. Непревратимая энергия, например внутренняя энергия окружающей среды. Непревратимые в другие виды формы энергии принято называть анергией.
Анергия – энергия, которая не может быть преобразована в эксергию.
Эксергия – энергия, которая при участии окружающей среды может быть преобразована в любую другую форму энергии.
Ограниченно превратимые формы энергии по Второму началу могут быть преобразованы в эксергию лишь частично. Поэтому они как бы состоят из совокупности эксергии и анергии. Введенные понятия позволяют сделать следующую формулировку второго начала:
Все формы энергии состоят из эксергии и анергии, причем каждая из этих составляющих может быть равна нулю.
Энергия = Эксергия + Анергия.
Тогда, Первый закон термодинамики будет звучать следующим образом:
Во всех процессах сумма эксергии и анергии остается постоянной.
Обобщая вышесказанное, дадим еще одну формулировку Второго начала термодинамики.
1. Во всех необратимых процессах эксергия превращается в анергию.
2. Эксергия остается постоянной лишь в обратимых процессах.
3. Анергию в эксергию превратить невозможно.
Отметим техническую значимость введённых понятий. Отопление, охлаждение, производство и обработка материалов, транспортировка грузов и многие другие технические процессы невозможны без определенных, порой очень больших затрат энергии, для выполнения которых требуется не просто энергия, а полезная энергия или эксергия.
Поэтому эксергию необходимо рассматривать как важную в техническом смысле часть энергии, непрерывно уменьшающуюся в реальных процессах.
7.5 Преобразование тепла в полезную работу
 Рисунок 7.4
Энергетический и энтропийный баланс обратимого цикла
Рисунок 7.4
Энергетический и энтропийный баланс обратимого цикла
|
Эксергия тепла – часть энергии, передаваемой в форме тепла, которую можно превратить в любую другую форму энергии, а, следовательно, и в полезную работу. Рассмотрим обратимый круговой процесс:
Полезная работа обратимого кругового процесса совпадает с эксергией подведённого тепла при условии:
1. Круговой процесс протекает обратимо.
2. Теплоотвод происходит при температуре окружающей среды. Отведённое тепло состоит из анергии.
Обозначим эксергию тепла через 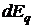 , анергию через
, анергию через 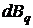 , тогда
, тогда  .
.
Воспользуемся вторым законом термодинамики в форме баланса энтропии и проведём энтропийный анализ:
 ;
; 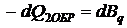 .
.
Подвод тепла 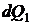 при температуре
при температуре  приводит к приращению энтропии
приводит к приращению энтропии  . Если круговой процесс обратим, то производства энтропии нет. Тогда
. Если круговой процесс обратим, то производства энтропии нет. Тогда  должно быть таким, чтобы переносимая с ним энтропия
должно быть таким, чтобы переносимая с ним энтропия  была равна
была равна  , т.е.
, т.е.
 ;
; 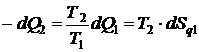 .
.
Тепло, отводимое в цикле, состоит лишь из анергии
 ,
,  .
.
Воспользуемся ранее записанным первым началом и решим его относительно элементарной полезной работы
 ,
,
 .
.
Величину эксергии найдем интегрированием:
 .
.
Аналогично выразим анергию
 ,
,
T – температура энергоносителя, отдающего или воспринимающего тепло. Тепло, эксергия и анергия являются функциями процесса, а не параметрами состояния.
Стоящий в скобках коэффициент по своей форме совпадает с термическим КПД цикла Карно реализуемого в интервале температуры  и
и  . Его принято называть фактором Карно. Он зависит от температуры окружающей среды и температуры источника.
. Его принято называть фактором Карно. Он зависит от температуры окружающей среды и температуры источника.
 .
.
 Рисунок 7.5
Диаграмма потоков эксергии и анергии обратимой слева и необратимой справа тепсиловых установках
Рисунок 7.5
Диаграмма потоков эксергии и анергии обратимой слева и необратимой справа тепсиловых установках
|
Эксергия равна теплу, помноженному на фактор Карно.
В связи с тем, что как показывает эксергетический анализ – полное тепло, подведённое к рабочему телу, в полезную работу можно преобразовать лишь частично, то термический КПД оценивает совершенство тепловой машины не совсем качественно, т.к. полученная полезно используемая в этом случае работа сравнивается не с достижимой работой по эксергии, а с теплом, полное преобразование которого в работу по второму началу невозможно.
Поэтому целесообразнее оценивать совершенство теплосиловой установки по эксергетическому КПД
 ,
,
где:  – удельная эксергия тепла,
– удельная эксергия тепла,  – удельная работа за цикл.
– удельная работа за цикл.
Для обратимого цикла  и
и  . При необратимом круговом процессе возникают потери эксергии
. При необратимом круговом процессе возникают потери эксергии  , т.е. часть эксергии превращается в анергию, поэтому полезная работа уменьшается
, т.е. часть эксергии превращается в анергию, поэтому полезная работа уменьшается
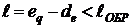
Эксергетический КПД можно записать в виде

Отклонение  от 1 (
от 1 ( ) служит мерой принципиально устранимых потерь эксергии при более рациональном проведении процесса и использовании более совершенного оборудования.
) служит мерой принципиально устранимых потерь эксергии при более рациональном проведении процесса и использовании более совершенного оборудования.
 – потеря эксергии, которая с помощью технических мероприятий может быть сокращена или в предельном случае полностью устранена.
– потеря эксергии, которая с помощью технических мероприятий может быть сокращена или в предельном случае полностью устранена.
Пример: *
Тепло в круговом процессе подводится при р = const, при этом рабочее тело нагревается от  °С до
°С до  °С. Рабочее тело воздух
°С. Рабочее тело воздух  кДж/(кг×К). Термический КПД кругового процесса
кДж/(кг×К). Термический КПД кругового процесса 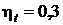 . Температура окружающей среды
. Температура окружающей среды  °С. Определить эксергетический КПД
°С. Определить эксергетический КПД  и потери эксергии кругового процесса? Изменением потенциальной и кинетической энергии потока пренебречь.
и потери эксергии кругового процесса? Изменением потенциальной и кинетической энергии потока пренебречь.
Решение: Запишем Первое начало термодинамики для поточного процесса 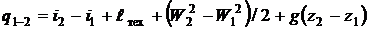
С учетом принятых условий и при отсутствии работы  , получим
, получим  кДж/кг.
кДж/кг.
Найдём эксергию тепла

По первому началу  и поэтому
и поэтому

 кДж/кг
кДж/кг
Из выражения для термического КПД найдем полезную работу
 кДж/кг
кДж/кг
Эксергетический КПД  .
.
Потери эксергии  кДж/кг
кДж/кг
Общий теплоотвод:  кДж/кг
кДж/кг
С другой стороны можно выполнить проверочное вычисление
 кДж/кг
кДж/кг
Результаты совпали, что позволяет сделать заключение о верном решении задачи.
* пример заимствован из источника [ Бэр ]
Определение потерь эксергии
Процесс совершенствования технических устройств заключается в снижении потерь эксергии в ней. Таким образом, для инженера важно знать причины потерь эксергии и способы их вычисления. Потери эксергии необратимого процесса для закрытой системы равны произведенной в этом процессе энтропии умноженной на температуру окружающей среды
 .
.
Найдем потери эксергии в стационарном поточном процессе на основе эксергетического анализа и уравнения баланса эксергии и анергии. Искомый поток эксергетических потерь  может быть найден как превышение подводимых потоков эксергии над отводимыми
может быть найден как превышение подводимых потоков эксергии над отводимыми
 ,
,
где  – эксергетические потоки;
– эксергетические потоки;  – поток подводимой механической, либо электрической эксергий;
– поток подводимой механической, либо электрической эксергий;  – поток эксергии, связанный с потоком вещества;
– поток эксергии, связанный с потоком вещества;  – эксергия вводимых или выводимых потоков тепла.
– эксергия вводимых или выводимых потоков тепла.
Потери эксергии вызваны потерями электрической или механической мощностей, с диссипативными моментами, связанными с необратимыми явлениями в контрольном пространстве. Поэтому  – иногда называют еще потерями полезной мощности или мощности вообще. Если через контрольную поверхность протекает лишь один поток вещества, то потери относят часто к массовому расходу
– иногда называют еще потерями полезной мощности или мощности вообще. Если через контрольную поверхность протекает лишь один поток вещества, то потери относят часто к массовому расходу  :
:
 .
.
При составлении эксергетического баланса необходимо вычислять все потоки эксергии, проходящие в контрольную поверхность.
Иногда предпочитают менее трудоемкий подход.
Рассмотрим баланс анергии для вещества ограниченного контрольной поверхностью. Потери мощности при этом получаются как избыток энергии подведенной к системе над отведенной от нее.
Запишем уравнение баланса энтропии для потока вещества через контрольную поверхность
 .
.
Умножим его на температуру окружающей среды 
 .
.
Правая часть полученного выражения представляет собой разность анергии, отведенной с потоками вещества из контрольного пространства, и анергии, подведенной с потоками вещества и тепла. Таким образом величина  равна избытку анергии, покидающей контрольное пространство над поступающей. Оно отражает необратимость процессов, происходящих внутри контрольной поверхности. Поток потерь эксергии в этом случаи можно записать как
равна избытку анергии, покидающей контрольное пространство над поступающей. Оно отражает необратимость процессов, происходящих внутри контрольной поверхности. Поток потерь эксергии в этом случаи можно записать как
 .
.
Потери эксергии необратимого процесса в закрытой системе и необратимого стационарного поточного процесса зависят от температуры окружающей среды и произведенной энтропии. Если контрольное пространство адиабатно, то
 и
и  .
.
Поток потерь эксергии в этом случае определяется приращением энтропии отдельных потоков вещества.
РЕАЛЬНЫХ ВЕЩЕСТВ
8.1 Термическое уравнение состояния. р,u, T – поверхность
Термодинамический анализ реальных процессов, работы технических устройств по преобразованию энергии одного вида в другие требует знания теплофизических свойств веществ, обобщаемых термическим, либо калорическим уравнениями состояния. Задача определения вида термического уравнения состояния достаточно сложна и в аналитическом виде при определенных допущениях может быть решена с использованием основных положений молекулярно-кинетической теории.

Рисунок 8.1 – р, u, T – диаграмма чистого вещества
Для простых термодинамических систем, используя Первый и Второй законы термодинамики, можно записать
 .
.
Если известно термическое уравнение состояния, то используя записанное выражение, можно вычислить калорические свойства веществ.
Рассмотрим чистые вещества, для равновесных состояний каждой из фаз которых имеется определенное термическое уравнение состояния
 .
.
Конкретный вид уравнения чаще всего определяется на основе анализа опытных данных. Записанное в неявном виде уравнение состояния термодинамической системы, состоящей из чистого вещества геометрически может быть представлено в виде пространственной поверхности состояния, в основании которой лежит u, T – плоскость, а давление  играет роль третьей координаты. На поверхности обозначены области, отображающие поведение системы в каждой из трех наиболее распространенных при нормальных условиях фаз веществ – газообразной, жидкой и твердой. Кроме областей однофазного состояния системы (гомогенные области) можно отметить существование областей двухфазных-гетерогенных состояний. Такими двухфазными областями является область насыщения: область влажного пара, область плавления и область сублимации. Малым удельным объемам соответствует область твердого тела (твердой фазы вещества), в которой даже при сравнительно больших перепадах по давлению и температуре объем тела изменяется весьма незначительно. При переходе по изобаре из окружности точки А в окресность точки В наблюдается небольшое изменение объема и рост температуры, что соответствует нагреву твердой фазы вещества. В точке В температура достигает температуры плавления. В процессе плавления температура и давление остаются неизменными, то есть процесс плавления – это изобарно-изотермический процесс. В точке С плавление завершено и вещество находится в жидком состоянии. Граничная линия из точек типа “ С ” называется линией отвердевания. С дальнейшем нагреванием при постоянном давлении жидкость расширяется. В точке D на линии кипения происходит следующий фазовый переход при повторном изобарно-изотермическом процессе с существенным ростом объема, в процессе которого вещество переходит в паровую фазу. В точке Е выкипает вся жидкость и вещество находится в газообразной (паровой) фазе. Правую границу, на которой вещество находится в виде сухого насыщенного пара принято называть линией конденсации. Вправо от этой границы состояние вещества принято называть перегретым паром. Смесь кипящей жидкости с содержащимся в ней паром принято называть влажным паром. Если к твердому телу подводить тепло при низком давлении, то в точке Н тело достигает пограничной кривой, которую называют линией сублимации (или возгонки). В этом случае тело не плавится, а начинает испаряться. Процесс непосредственного перехода из жидкой фазы в паровую принято называть сублимацией. Обратный процесс непосредственного перехода из паровой фазы в твердую фазу принято называть десублимацией. При температуре и давлении превышающим точку К двухфазной области не существует и наблюдается непрерывный переход из жидкого в паровое состояние с непрерывным накапливанием паровых свойств. Эта область состояний вещества впервые была обнаружена Эндрюсом и правильно объяснена в 1869 г.
играет роль третьей координаты. На поверхности обозначены области, отображающие поведение системы в каждой из трех наиболее распространенных при нормальных условиях фаз веществ – газообразной, жидкой и твердой. Кроме областей однофазного состояния системы (гомогенные области) можно отметить существование областей двухфазных-гетерогенных состояний. Такими двухфазными областями является область насыщения: область влажного пара, область плавления и область сублимации. Малым удельным объемам соответствует область твердого тела (твердой фазы вещества), в которой даже при сравнительно больших перепадах по давлению и температуре объем тела изменяется весьма незначительно. При переходе по изобаре из окружности точки А в окресность точки В наблюдается небольшое изменение объема и рост температуры, что соответствует нагреву твердой фазы вещества. В точке В температура достигает температуры плавления. В процессе плавления температура и давление остаются неизменными, то есть процесс плавления – это изобарно-изотермический процесс. В точке С плавление завершено и вещество находится в жидком состоянии. Граничная линия из точек типа “ С ” называется линией отвердевания. С дальнейшем нагреванием при постоянном давлении жидкость расширяется. В точке D на линии кипения происходит следующий фазовый переход при повторном изобарно-изотермическом процессе с существенным ростом объема, в процессе которого вещество переходит в паровую фазу. В точке Е выкипает вся жидкость и вещество находится в газообразной (паровой) фазе. Правую границу, на которой вещество находится в виде сухого насыщенного пара принято называть линией конденсации. Вправо от этой границы состояние вещества принято называть перегретым паром. Смесь кипящей жидкости с содержащимся в ней паром принято называть влажным паром. Если к твердому телу подводить тепло при низком давлении, то в точке Н тело достигает пограничной кривой, которую называют линией сублимации (или возгонки). В этом случае тело не плавится, а начинает испаряться. Процесс непосредственного перехода из жидкой фазы в паровую принято называть сублимацией. Обратный процесс непосредственного перехода из паровой фазы в твердую фазу принято называть десублимацией. При температуре и давлении превышающим точку К двухфазной области не существует и наблюдается непрерывный переход из жидкого в паровое состояние с непрерывным накапливанием паровых свойств. Эта область состояний вещества впервые была обнаружена Эндрюсом и правильно объяснена в 1869 г.
Линии конденсации и испарения сходятся в точке К, которую принято называть критической. Изобару и изотерму, проходящие через критическую точку, принято называть критическими: Т = Т кр, Р = Р кр.
Критические давление, температура и удельный объем для каждого из веществ являются характеристическими величинами. Равновесие между жидкой и газовой фазами возможно лишь при температуре и давлениях ниже критических.
8.2  – диаграммы
– диаграммы
Проекция р,u, T – поверхности на плоскости 
 и
и  представляет собой диаграммы, на которых также возможно выделить три области существования основных фаз веществ, разделяемых тремя кривыми – плавления, парообразования и сублимации (рисунок 8.2).
представляет собой диаграммы, на которых также возможно выделить три области существования основных фаз веществ, разделяемых тремя кривыми – плавления, парообразования и сублимации (рисунок 8.2).


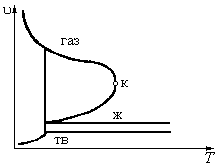
Рисунок 8.2
Возможные проекции р, u, T – диаграммы на соответствующие плоскости
В связи с тем, что отмеченные процессы относятся к числу изобарно-изотермических процессов, их проекции на р, T – диаграмме сливаются в одну линию, на которой можно отметить две характерные точки  и
и 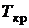 . В точке
. В точке  сходятся все три кривые фазовых переходов, следовательно в тройной точке имеет место равновесное состояние всех трех фаз: жидкой, твердой паровой. Для воды в тройной точке
сходятся все три кривые фазовых переходов, следовательно в тройной точке имеет место равновесное состояние всех трех фаз: жидкой, твердой паровой. Для воды в тройной точке  К,
К,  Па. Кривая парообразования заканчивается в критической точке
Па. Кривая парообразования заканчивается в критической точке  , где сходятся кривые кипения и конденсации. При
, где сходятся кривые кипения и конденсации. При  четко выраженная граница между жидким и парообразным состояниями отсутствует. Это позволяет жидкости и газы объединить под общим названием – сплошная (текучая) среда, которая способна воспринимать лишь сжимающие усилия (напряжения) и не в состоянии противостоять растягивающим усилиям.
четко выраженная граница между жидким и парообразным состояниями отсутствует. Это позволяет жидкости и газы объединить под общим названием – сплошная (текучая) среда, которая способна воспринимать лишь сжимающие усилия (напряжения) и не в состоянии противостоять растягивающим усилиям.
Опыты Эндрюса
Опыты показывают, что некоторые вещества при комнатной температуре, находящиеся в газообразном состоянии, можно перевести в жидкое путем повышения давления с отводом тепла. Физика этого процесса достаточно проста. В процессе изотермического сжатия растет давление газа (пара) до тех пор, пока оно не достигает давления насыщающих паров  , после чего начинается изобарно-изотермический процесс конденсации газа, ход которого, например, для углекислоты, представлен на рисунке 8.3.
, после чего начинается изобарно-изотермический процесс конденсации газа, ход которого, например, для углекислоты, представлен на рисунке 8.3.


| Рисунок 8.3
Изотерма фазовых переходов СО 2
| Рисунок 8.4
Экспериментальные изотермы Эндрюса
|
Проведя эксперименты для углекислоты, находящейся при различных начальных температурах, Эндрюс Томас впервые установил, что чем выше начальная температура вещества, тем меньше разница между удельными объемами паровой и жидкой фаз. Протяженность горизонтального участка процесса фазового перехода пропорциональна теплоте фазового перехода вещества (теплота парообразования или теплота конденсации). При критической температуре – горизонтальный участок стягивается в точку  , в которой исчезают различия между жидкой и паровой фазами. Критические давление и температура – максимальные значения для области возможного равновесного двухфазного состояния.
, в которой исчезают различия между жидкой и паровой фазами. Критические давление и температура – максимальные значения для области возможного равновесного двухфазного состояния.
В критической точке  . В этой точке обращается в нуль и теплота парообразования
. В этой точке обращается в нуль и теплота парообразования  , что видно из уравнения Клапейрона-Клазиуса:
, что видно из уравнения Клапейрона-Клазиуса:
 .
.
В критической точке изотерма претерпевает перегиб в результате чего она имеет горизонтальную касательную, а первые и вторые производные от давления по удельному объему, взятые по температуре, в критической точке равны нулю.
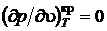 ,
,  .
.
Для различных веществ критические параметры в критической точке различны.
Ван-дер-Ваальсовский газ
Модель идеального газа предполагает отсутствие столкновений между молекулами, т. е. отсутствие сил межмолекулярного взаимодействия. Кроме того, допускается, что молекулы одноатомны, атомы представляют собой материаьные точки. Это в принципе означает, что газ раз выведенный из состояния равновесия, никогда не сможет в него вернуться.
Необходимо знать каким изменениям в уравнении состояния приведет учет столкновений и наличие конечного объема у молекул газа?
Если молекулы притягиваются друг к другу, то энергия газа должна быть равна сумме кинетической энергии его молекул и потенциальной энергии их взаимодействия. Реальный газ должен обладать несколько меньшим давлением, чем идеальный, находясь при одних и тех же значениях объема и температуры. Кроме того, наличие собственного объема, в отличие от точечной идеализации, приведет к уменьшению объема, в котором перемещаются молекулы в процессе теплового движения, а, следовательно, чуть меньше будут и расстояния между молекулами. Этот эффект также изменяет потенциальную энергию системы, и, как оказывается, облегчает процесс расширения газа.
Перечисленные отличительные факты приводят к тому, что поведение реального газа отклоняется от уравнения состояние. Причем величина отклонения тем больше, чем выше давление и ниже температура.
Попытки многих ученых создать универсальное для всех газов уравнение состояния потерпели неудачу. Такое уравнение может быть создано лишь для сильно разреженных газов, когда они теряют свои индивидуальные макроскопические свойства и могут служить моделью любого разреженного газа. Наиболее удачно свойства реального газа описывает уравнение, предложенное Ван-дер-Ваальсом. Оно удобно тем, что достаточно хорошо качественно описывает свойства жидкой, паровой фаз и двухфазной области. Ван-дер-Ваальс предложил в уравнение Клапейрона-Менделеева ввести две поправки, учитывающие реальные свойства чистых веществ:
 – поправка, учитывающая наличие межмолекулярных сил – внутреннее давление; b – поправка, учитывающая конечный объем молекул.
– поправка, учитывающая наличие межмолекулярных сил – внутреннее давление; b – поправка, учитывающая конечный объем молекул.
Поправку b можно вычислить, допуская, что молекулы – сферы. С учетом этого предположения она оказалась равной
 ,
,
где r – радиус молекулы, N – число молекул, т. е. поправка равна примерно учетверенному собственному объему всех молекул. Константа а – коэффициент пропорциональности, численное значение которого зависит от характера сил притяжения между молекулами. В настоящее время надежного способа его вычислить нет.
Уравнение Ван-дер-Ваальса
Для описания поведения реальных газов предложено большое число различных уравнений. Самым простым и хорошо описывающим качественную картину поведения веществ в жидкой и газообразной фазах является уравнение, предложенное нидерландским физиком Яном Дидериком Ван-дер-Ваальсом в 1873 г.
 , (8.1)
, (8.1)
где р – внешнее давление, Па; a [Па×м6/моль], b [м3/моль].
Поправка  по своей сути является добавкой к внешнему давлению, обусловленную взаимодействием между молекулами. Взаимное притяжение между молекулами как бы дополнительно сжимает объем.
по своей сути является добавкой к внешнему давлению, обусловленную взаимодействием между молекулами. Взаимное притяжение между молекулами как бы дополнительно сжимает объем.
Поправка к объему «b» как бы учитывает собственный суммарный объем молекул, недоступный для их теплового движения.
Уравнение Ван-дер-Ваальса можно записать для произвольного количества вещества в термодинамической системе
 , (8.2)
, (8.2)
или умножив его на число молей n
 , (8.3)
, (8.3)
где  ,
,  ,
,  ,
,  .
.
Реальные газы следуют уравнению Ван-дер-Ваальса приближенно. Хотя оно и лучше чем уравнение Клапейрона-Менделеева описывает их состояние. Газ, строго подчиняющийся уравнению Ван-дер-Ваальса, принято называть Ван-дер-Ваальсовским.
Экспериментальные изотермы
Как следует из теоретического анализа изотерм Ван-дер-Ваальса при давлении  для каждого газа существует область таких объемов, где вещество ведет себя неестественным образом: рост объема при
для каждого газа существует область таких объемов, где вещество ведет себя неестественным образом: рост объема при  сопровождается постоянством давления. Однородного вещества с такими свойствами быть не может. Следовательно, в этой области вещество становится неоднородным, т. е. оно расслаивается на две фазы: жидкую и газообразную – паровую.
сопровождается постоянством давления. Однородного вещества с такими свойствами быть не может. Следовательно, в этой области вещество становится неоднородным, т. е. оно расслаивается на две фазы: жидкую и газообразную – паровую.


| Рисунок 8.6
Экспериментальные изотермы реального газа – кривые Эндрюса
| Рисунок 8.7
Зависимость плотности жидкости и насыщенного пара от температуры
|
Экспериментальные графики изотерм реальных жидкостей и газов отличаются от Ван-дер-Ваальсовских горизонтальным участком сменяющим синусоидальную область. Можно выделить три области: жидкую – Ж, паровую – П и двухфазную, в которой жидкость находится в состоянии равновесия со своим насыщенным паром. Давление, при котором наблюдается это равновесие, принято называть давлением насыщающих паров. Как видно, с ростом давления насыщающих паров протяженность горизонтального участка уменьшается постепенно стягиваясь в точку при критической температуре  . Насыщенный пар может существовать лишь при температуре ниже критической.
. Насыщенный пар может существовать лишь при температуре ниже критической.
Фазовые превращения
Разные фазы одного и того же вещества могут находиться в равновесии, соприкасаясь друг с другом. Такое равновесие имеет место лишь в ограниченном интервале температуры. Каждому значению температуры соответствует свое значение давления р, при котором это равновесие возможно.
На экспериментальной изотерме совокупность равновесных состояний изображается отрезком горизонтальной прямой. Состояния, отвечающие различным точкам участка, отличаются распределением вещества между фазами. Концам горизонтального отрезка соответствуют однофазные состояния. Вся совокупность состояний, изображаемая в  – диаграмме отрезком прямой, на диаграмме
– диаграмме отрезком прямой, на диаграмме 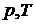 будет представлена одной точкой, определяющей значение р и Т, при которых осуществляется переход.
будет представлена одной точкой, определяющей значение р и Т, при которых осуществляется переход.
Переход вещества из одной фазы в другую обычно происходит с поглощением либо выделение энергии в форме тепла, которое называют теплотой фазового перехода. Например, при таянии льда теплота поглощается – это теплота плавления, при замерзании воды выделяется такое же количество теплоты. Изменения агрегатного состояния, сопровождаемые тепловыд



 ,
, 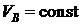 . Системы гомогенны
. Системы гомогенны  ,
,  , но
, но  . Диатермическая перегородка допускает обмен теплом, но при этом будем считать, что гомогенность и равновесность каждой из подсистем остаются неизменными. Это позволяет предположить, что процессы изменения внутренней энергии в каждой из подсистем будут протекать обратимо. Но в целом в адиабатной системе
. Диатермическая перегородка допускает обмен теплом, но при этом будем считать, что гомогенность и равновесность каждой из подсистем остаются неизменными. Это позволяет предположить, что процессы изменения внутренней энергии в каждой из подсистем будут протекать обратимо. Но в целом в адиабатной системе  процесс теплообмена необратим. Покажем это.
процесс теплообмена необратим. Покажем это. Рисунок 7.1
К выводу необратимости теплообмена
Рисунок 7.1
К выводу необратимости теплообмена
 ,
,  ;
;  ,
,  . Но при этом внутренняя энергия полной адиабатной системы остается неизменной
. Но при этом внутренняя энергия полной адиабатной системы остается неизменной ,
,
 . (7.1)
. (7.1) ;
;  .
.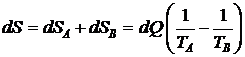 . (7.2)
. (7.2) тепло переходит от В к А, следовательно
тепло переходит от В к А, следовательно 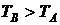 .
. ;
;  , но т.к.
, но т.к.  , то
, то . (7.3)
. (7.3)
 Рисунок 7.2
Необратимость теплообмена
Рисунок 7.2
Необратимость теплообмена
 . (7.4)
. (7.4) . (7.5)
. (7.5) . (7.6)
. (7.6) можно записать
можно записать . (7.7)
. (7.7) , (7.9)
, (7.9) ,
, 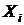

 . (7.10)
. (7.10) . (7.11)
. (7.11) , (7.12)
, (7.12) – произведенная энтропия.
– произведенная энтропия. Рисунок 7.3
Адиабатные системы с подводом энергии в форме работы
и изменения обобщенных координат
Рисунок 7.3
Адиабатные системы с подводом энергии в форме работы
и изменения обобщенных координат
 . В первой системе обобщенная координата – объём, во второй – объём и электрический заряд.
. В первой системе обобщенная координата – объём, во второй – объём и электрический заряд.





 остаются постоянными
остаются постоянными  ,
, .
. – элементарнее изменение электрического разряда
– элементарнее изменение электрического разряда ;
; 
 . (7.13)
. (7.13) .
. ,
,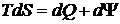 . (7.14)
. (7.14) . (7.15)
. (7.15) ,
,  и
и (7.16)
(7.16)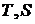 – диаграмме реальную адиабату равна энергии диссипации. В случае простой системы с объёмом как единственной обобщённой координаты можно записать соотношение
– диаграмме реальную адиабату равна энергии диссипации. В случае простой системы с объёмом как единственной обобщённой координаты можно записать соотношение
 .
. и
и  . (7.17)
. (7.17) Рисунок 7.4
Энергетический и энтропийный баланс обратимого цикла
Рисунок 7.4
Энергетический и энтропийный баланс обратимого цикла
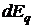 , анергию через
, анергию через 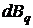 , тогда
, тогда  .
. ;
; 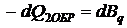 .
.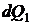 при температуре
при температуре  приводит к приращению энтропии
приводит к приращению энтропии  . Если круговой процесс обратим, то производства энтропии нет. Тогда
. Если круговой процесс обратим, то производства энтропии нет. Тогда  должно быть таким, чтобы переносимая с ним энтропия
должно быть таким, чтобы переносимая с ним энтропия  была равна
была равна  , т.е.
, т.е. ;
; 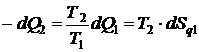 .
. ,
,  .
. ,
, .
. .
. ,
, и
и  . Его принято называть фактором Карно. Он зависит от температуры окружающей среды и температуры источника.
. Его принято называть фактором Карно. Он зависит от температуры окружающей среды и температуры источника. .
. Рисунок 7.5
Диаграмма потоков эксергии и анергии обратимой слева и необратимой справа тепсиловых установках
Рисунок 7.5
Диаграмма потоков эксергии и анергии обратимой слева и необратимой справа тепсиловых установках
 ,
, – удельная эксергия тепла,
– удельная эксергия тепла,  – удельная работа за цикл.
– удельная работа за цикл. и
и  . При необратимом круговом процессе возникают потери эксергии
. При необратимом круговом процессе возникают потери эксергии  , т.е. часть эксергии превращается в анергию, поэтому полезная работа уменьшается
, т.е. часть эксергии превращается в анергию, поэтому полезная работа уменьшается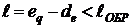

 от 1 (
от 1 ( ) служит мерой принципиально устранимых потерь эксергии при более рациональном проведении процесса и использовании более совершенного оборудования.
) служит мерой принципиально устранимых потерь эксергии при более рациональном проведении процесса и использовании более совершенного оборудования. – потеря эксергии, которая с помощью технических мероприятий может быть сокращена или в предельном случае полностью устранена.
– потеря эксергии, которая с помощью технических мероприятий может быть сокращена или в предельном случае полностью устранена. °С до
°С до  °С. Рабочее тело воздух
°С. Рабочее тело воздух  кДж/(кг×К). Термический КПД кругового процесса
кДж/(кг×К). Термический КПД кругового процесса 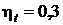 . Температура окружающей среды
. Температура окружающей среды  °С. Определить эксергетический КПД
°С. Определить эксергетический КПД  и потери эксергии кругового процесса? Изменением потенциальной и кинетической энергии потока пренебречь.
и потери эксергии кругового процесса? Изменением потенциальной и кинетической энергии потока пренебречь.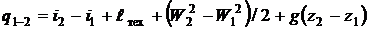
 , получим
, получим  кДж/кг.
кДж/кг.
 и поэтому
и поэтому
 кДж/кг
кДж/кг кДж/кг
кДж/кг .
. кДж/кг
кДж/кг кДж/кг
кДж/кг кДж/кг
кДж/кг .
. может быть найден как превышение подводимых потоков эксергии над отводимыми
может быть найден как превышение подводимых потоков эксергии над отводимыми ,
, – эксергетические потоки;
– эксергетические потоки;  – поток подводимой механической, либо электрической эксергий;
– поток подводимой механической, либо электрической эксергий;  – поток эксергии, связанный с потоком вещества;
– поток эксергии, связанный с потоком вещества;  – эксергия вводимых или выводимых потоков тепла.
– эксергия вводимых или выводимых потоков тепла. :
: .
. .
.
 .
. равна избытку анергии, покидающей контрольное пространство над поступающей. Оно отражает необратимость процессов, происходящих внутри контрольной поверхности. Поток потерь эксергии в этом случаи можно записать как
равна избытку анергии, покидающей контрольное пространство над поступающей. Оно отражает необратимость процессов, происходящих внутри контрольной поверхности. Поток потерь эксергии в этом случаи можно записать как .
. и
и  .
.
 .
. .
. играет роль третьей координаты. На поверхности обозначены области, отображающие поведение системы в каждой из трех наиболее распространенных при нормальных условиях фаз веществ – газообразной, жидкой и твердой. Кроме областей однофазного состояния системы (гомогенные области) можно отметить существование областей двухфазных-гетерогенных состояний. Такими двухфазными областями является область насыщения: область влажного пара, область плавления и область сублимации. Малым удельным объемам соответствует область твердого тела (твердой фазы вещества), в которой даже при сравнительно больших перепадах по давлению и температуре объем тела изменяется весьма незначительно. При переходе по изобаре из окружности точки А в окресность точки В наблюдается небольшое изменение объема и рост температуры, что соответствует нагреву твердой фазы вещества. В точке В температура достигает температуры плавления. В процессе плавления температура и давление остаются неизменными, то есть процесс плавления – это изобарно-изотермический процесс. В точке С плавление завершено и вещество находится в жидком состоянии. Граничная линия из точек типа “ С ” называется линией отвердевания. С дальнейшем нагреванием при постоянном давлении жидкость расширяется. В точке D на линии кипения происходит следующий фазовый переход при повторном изобарно-изотермическом процессе с существенным ростом объема, в процессе которого вещество переходит в паровую фазу. В точке Е выкипает вся жидкость и вещество находится в газообразной (паровой) фазе. Правую границу, на которой вещество находится в виде сухого насыщенного пара принято называть линией конденсации. Вправо от этой границы состояние вещества принято называть перегретым паром. Смесь кипящей жидкости с содержащимся в ней паром принято называть влажным паром. Если к твердому телу подводить тепло при низком давлении, то в точке Н тело достигает пограничной кривой, которую называют линией сублимации (или возгонки). В этом случае тело не плавится, а начинает испаряться. Процесс непосредственного перехода из жидкой фазы в паровую принято называть сублимацией. Обратный процесс непосредственного перехода из паровой фазы в твердую фазу принято называть десублимацией. При температуре и давлении превышающим точку К двухфазной области не существует и наблюдается непрерывный переход из жидкого в паровое состояние с непрерывным накапливанием паровых свойств. Эта область состояний вещества впервые была обнаружена Эндрюсом и правильно объяснена в 1869 г.
играет роль третьей координаты. На поверхности обозначены области, отображающие поведение системы в каждой из трех наиболее распространенных при нормальных условиях фаз веществ – газообразной, жидкой и твердой. Кроме областей однофазного состояния системы (гомогенные области) можно отметить существование областей двухфазных-гетерогенных состояний. Такими двухфазными областями является область насыщения: область влажного пара, область плавления и область сублимации. Малым удельным объемам соответствует область твердого тела (твердой фазы вещества), в которой даже при сравнительно больших перепадах по давлению и температуре объем тела изменяется весьма незначительно. При переходе по изобаре из окружности точки А в окресность точки В наблюдается небольшое изменение объема и рост температуры, что соответствует нагреву твердой фазы вещества. В точке В температура достигает температуры плавления. В процессе плавления температура и давление остаются неизменными, то есть процесс плавления – это изобарно-изотермический процесс. В точке С плавление завершено и вещество находится в жидком состоянии. Граничная линия из точек типа “ С ” называется линией отвердевания. С дальнейшем нагреванием при постоянном давлении жидкость расширяется. В точке D на линии кипения происходит следующий фазовый переход при повторном изобарно-изотермическом процессе с существенным ростом объема, в процессе которого вещество переходит в паровую фазу. В точке Е выкипает вся жидкость и вещество находится в газообразной (паровой) фазе. Правую границу, на которой вещество находится в виде сухого насыщенного пара принято называть линией конденсации. Вправо от этой границы состояние вещества принято называть перегретым паром. Смесь кипящей жидкости с содержащимся в ней паром принято называть влажным паром. Если к твердому телу подводить тепло при низком давлении, то в точке Н тело достигает пограничной кривой, которую называют линией сублимации (или возгонки). В этом случае тело не плавится, а начинает испаряться. Процесс непосредственного перехода из жидкой фазы в паровую принято называть сублимацией. Обратный процесс непосредственного перехода из паровой фазы в твердую фазу принято называть десублимацией. При температуре и давлении превышающим точку К двухфазной области не существует и наблюдается непрерывный переход из жидкого в паровое состояние с непрерывным накапливанием паровых свойств. Эта область состояний вещества впервые была обнаружена Эндрюсом и правильно объяснена в 1869 г. – диаграммы
– диаграммы
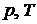 и
и  представляет собой диаграммы, на которых также возможно выделить три области существования основных фаз веществ, разделяемых тремя кривыми – плавления, парообразования и сублимации (рисунок 8.2).
представляет собой диаграммы, на которых также возможно выделить три области существования основных фаз веществ, разделяемых тремя кривыми – плавления, парообразования и сублимации (рисунок 8.2).


 и
и 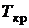 . В точке
. В точке  К,
К,  Па. Кривая парообразования заканчивается в критической точке
Па. Кривая парообразования заканчивается в критической точке  , где сходятся кривые кипения и конденсации. При
, где сходятся кривые кипения и конденсации. При  четко выраженная граница между жидким и парообразным состояниями отсутствует. Это позволяет жидкости и газы объединить под общим названием – сплошная (текучая) среда, которая способна воспринимать лишь сжимающие усилия (напряжения) и не в состоянии противостоять растягивающим усилиям.
четко выраженная граница между жидким и парообразным состояниями отсутствует. Это позволяет жидкости и газы объединить под общим названием – сплошная (текучая) среда, которая способна воспринимать лишь сжимающие усилия (напряжения) и не в состоянии противостоять растягивающим усилиям. , после чего начинается изобарно-изотермический процесс конденсации газа, ход которого, например, для углекислоты, представлен на рисунке 8.3.
, после чего начинается изобарно-изотермический процесс конденсации газа, ход которого, например, для углекислоты, представлен на рисунке 8.3.

 . В этой точке обращается в нуль и теплота парообразования
. В этой точке обращается в нуль и теплота парообразования  , что видно из уравнения Клапейрона-Клазиуса:
, что видно из уравнения Клапейрона-Клазиуса: .
.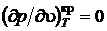 ,
,  .
. – поправка, учитывающая наличие межмолекулярных сил – внутреннее давление; b – поправка, учитывающая конечный объем молекул.
– поправка, учитывающая наличие межмолекулярных сил – внутреннее давление; b – поправка, учитывающая конечный объем молекул. ,
, , (8.1)
, (8.1) по своей сути является добавкой к внешнему давлению, обусловленную взаимодействием между молекулами. Взаимное притяжение между молекулами как бы дополнительно сжимает объем.
по своей сути является добавкой к внешнему давлению, обусловленную взаимодействием между молекулами. Взаимное притяжение между молекулами как бы дополнительно сжимает объем. , (8.2)
, (8.2) , (8.3)
, (8.3) ,
,  ,
,  ,
,  .
. для каждого газа существует область таких объемов, где вещество ведет себя неестественным образом: рост объема при
для каждого газа существует область таких объемов, где вещество ведет себя неестественным образом: рост объема при 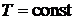 сопровождается постоянством давления. Однородного вещества с такими свойствами быть не может. Следовательно, в этой области вещество становится неоднородным, т. е. оно расслаивается на две фазы: жидкую и газообразную – паровую.
сопровождается постоянством давления. Однородного вещества с такими свойствами быть не может. Следовательно, в этой области вещество становится неоднородным, т. е. оно расслаивается на две фазы: жидкую и газообразную – паровую.

 . Насыщенный пар может существовать лишь при температуре ниже критической.
. Насыщенный пар может существовать лишь при температуре ниже критической. – диаграмме отрезком прямой, на диаграмме
– диаграмме отрезком прямой, на диаграмме 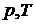 будет представлена одной точкой, определяющей значение р и Т, при которых осуществляется переход.
будет представлена одной точкой, определяющей значение р и Т, при которых осуществляется переход.


