

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...
Топ:
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Финансовый рынок и его значение в управлении денежными потоками на современном этапе: любому предприятию для расширения производства и увеличения прибыли нужны...
Влияние предпринимательской среды на эффективное функционирование предприятия: Предпринимательская среда – это совокупность внешних и внутренних факторов, оказывающих влияние на функционирование фирмы...
Дисциплины:
|
из
5.00
|
Заказать работу |
Содержание книги
Поиск на нашем сайте
|
|
|
|
Из растворов, полученных в процессе выщелачивания спеков можно выделить соединения циркония и гафния, такие как оксихлориды, основные сульфаты, сульфатоцирконаты (гафнаты) аммония или натрия, основные карбонаты, гексафторцирконаты (гафнаты) каля. Эти соединения могут быть использованы как конечные продукты, а могут поступать на дальнейшую переработку или на разделения циркония и гафния.
Кристаллизация оксихлорида циркония Zr(OH)2Cl2×7H2O.
Этот способ основан на малой растворимости Zr(OH)2Cl2×7H2O в концентрированной соляной кислоте при 20°С (при 70°С растворимость в 5 раз выше) (табл.3)
Этот способ интересен еще и тем, что дает возможность получения чистого соединения циркония, т.к. основные примеси, такие как титан, железо и алюминий остаются в солянокислом маточном растворе.
Из оксихлорида циркония довольно легко получить и другие соединения циркония:
H2O 600-700°C


 Zr(OH)2Cl2×7H2O ZrO2×H2O ZrO2
Zr(OH)2Cl2×7H2O ZrO2×H2O ZrO2
+NH4OH (99,6-99,8%Zr)
HNO3
 нитрат циркония
нитрат циркония
HF
 фторид циркония
фторид циркония
Осаждение основного сульфата.
Из солянокислых растворов можно выделить и основные сульфаты циркония. Растворы разбавляют для снижения их кислотности до 10-15г/л по соляной кислоте, чтобы избежать выпадения в осадок гидрокисда железа (III). После этого добавляют серную кислоту из расчета 0,4-0,7 моль на 1 моль циркония и нагревают раствор до 70-80°С. При этом осаждается 97-98% циркония в форме основного сульфата циркония (ОСЦ) примерно следующего состава 2ZrO2×SO3×5H2O.
Основные сульфаты выделяю обычно из сернокислых растворов. Для этого в сернокислый раствор добавляют концентрированную серную кислоту (до концентрации ее в растворе 47-57%) и немного соляной кислоты (для предотвращения выпадения в осадок гидроксида железа (III)).
Основной сульфат затем используют для получения других соединений циркония, например:
850-900°С

 Основной сульфат ZrO2 (97-98% Zr)
Основной сульфат ZrO2 (97-98% Zr)
H2SO4+Na2SO4
 сульфатоцирконат натрия (кожевенная промышленность)
сульфатоцирконат натрия (кожевенная промышленность)
Кристаллизация гексафторцирконата калия.
Гексафторцирконаты калия получают кристаллизацией из растворов выщелачивания, спекания с гексафторсиликатом калия. Процесс кристаллизации основан на зависимости растворимости гексафторцирконатов калия от температуры (табл.1) Как видно из данных таблицы с падением температуры растворимость падает. Горячие растворы после выщелачивания охлаждают и при этом гексафторцирконат калия кристаллизуется, а основные примесные элементы остаются в маточном растворе. Степень извлечения циркония ~ 97%. Доизвлекают цирконий из маточных растворов осаждением аммиаком гидратированного оксида циркония (Ур-ие 46).
К2ZrF6 + NH4ОН = ZrO2 *nH2O + КF + NH4F ( 46 )
Кроме этого метода получить гексафторцирконат калия можно гидрометаллургическим методом из основного сульфата циркония (рис. 6).
Основной сульфат циркония обрабатывают водным раствором аммиака с целью осаждения гидратированного оксида циркония. Для сокращения сброса технологических растворов, содержащих фтор-ион, и использования оборотной воды, осаждение гидроксофтороцирконата калия проводят этими растворами. После этого гидроксофтороцирконат калия вновь растворяют в воде в присутствии гексафторсиликата калия и аммиака. При этом протекает взаимодействие:
КmZr(OH)xF4∙nH2Oтв + bК2SiF6 тв+ qNH4ОН р-р ®
®К2ZrF6 р-р + bSiO2∙pH2Oтв + z(КF + 2NH4F) р-р (47)
В результате этого в растворе образуется гексафторцирконат калия, а диоксид кремния остается в осадке. Введение аммиака позволяет получать легко фильтрующиеся осадки гидратированного диоксида кремния.
Для доизвлечения циркония осадок гидратированного диоксида кремния подвергают двум последовательным промывкам оборотной водой. Для очистки от кремния фтороцирконатный раствор подкисляют соляной кислотой до рН=2 — 3 и кремнесодержащие примеси в виде кремнистого кека осаждаются. После очистки раствор К2ZrF6 направляют на кристаллизацию, а кремнистый кек по мере накопления возвращают на операцию растворения гидроксофтороцирконата калия.
Для более полного извлечения циркония маточный раствор, после выделения из него кристаллов К2ZrF6, возвращают на операцию растворения гидроксофторцирконата калия.
Перечисленные выше методы разложения цирконовых концентратов позволяют отделить цирконий от основной примеси – кремния за счет образования растворимых соединений циркония. Следующий метод разложения циркона – хлоридный – позволяет отделить цирконий от кремния за счет различной летучести соединений циркония и кремния: ZrCl4 и SiCl4.
ОСЦ
 NH3∙H2O
NH3∙H2O
 |
Осаждение ZrO2∙nH2O
 |
Фильтрация и промывка
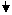 | 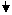 |
Раствор (NH4)2SO4 ZrO2∙nH2O
 |

 Осаждение KmZr(OH)xF4
Осаждение KmZr(OH)xF4
 |



 Растворение KmZr(OH)xF4
Растворение KmZr(OH)xF4
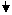 |

 Фильтрация и промывка
Фильтрация и промывка
 |  | ||
Кек (SiO2∙nH2O) раствор (K2ZrF6)
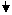 |
 Очистка от SiO2
Очистка от SiO2
 | 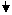 | ||
 раствор (K2ZrF6) кремнистый кек
раствор (K2ZrF6) кремнистый кек
 |
кристаллизация и
сушка
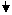 | |||
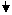 | |||
 K2ZrF6 маточный раствор
K2ZrF6 маточный раствор
Рис. 6 Принципиальная схема получения K2ZrF6 гидрометаллургическим методом
Хлорирование.
При разложении циркона хлорированием, разделение составляющих его элементов осуществляется за счет различной летучести их хлоридов. В процессе хлорирования происходит взаимодействие циркона с хлором:
ZrSiO4 +4Cl2® ZrCl4 + 2O2 +SiCl4 (48)
Но реакция хлорирования, записанная в данном виде термодинамически невероятна, т.е.  реакции величина положительная. Для осуществления реакции в процесс вводят углерод, в виде кокса.
реакции величина положительная. Для осуществления реакции в процесс вводят углерод, в виде кокса.
 (49)
(49)
Эта реакция при t=900-1100°С протекает достаточно быстро, но для самопроизвольного протекания процесса необходим постоянный подвод тепла.
Для хлорирования в промышленных условиях пригодны хлораторы любых типов, но во всех случаях необходим дополнительный подвод тепла.
Хлорирование можно проводить в шахтных хлораторах с графитовыми электродами для нагрева. В этом случае концентрат, кокс и термодабавки поступают в хлоратор в виде брикетов. Температура в реакционной зоне шахтного хлоратора поддерживается на уровне 800-1000°С. Степень извлечения циркония в технический хлорид при этом достигает 85-86%.
Все большее распространение приобретает хлорирование циркона в расплаве хлоридов щелочных металлов (NaCl:KCl=1:1). Этот метод позволяет проводить хлорирование при более низких температурах (≤900°С) при степени извлечения циркония ~99%.
В процессе хлорирования ZrCl4, SiCl4 и некоторые примеси переходят в паро-газовую смесь (ПГС), нелетучие хлориды и непрореагировавший остаток остаются в печи.
ПГС подают для разделения в систему конденсации, состоящую из пылевых камер, кулеров и оросительных конденсаторов. В пылевых камерах улавливают Zr(Hf)Cl4, которые возгоняются из твердого состояния. SiCl4, TiCl4 улавливают в оросительных конденсаторах, которые орошают жидким TiCl4, охлажденным до 5-10°С. Эту смесь (SiCl4 и TiCl4) разделяют ректификацией и четыреххлористый кремний используют в производстве кремнийорганических соединений.
В некоторых случаях процесс хлорирования разделяют как бы на две стадии. Сначала циркон восстанавливают углеродом при температурах 1900-2000°С:
 (50)
(50)
Давление паров монооксида кремния при этих температурах близко к 1 атмосфере, таким образом разделение циркония и кремния на 95% происходит уже на этой стадии.
Поскольку восстановление ведется в присутствии азота воздуха, практически получают не карбид циркония (ZrC), а смесь карбида, нитрида (ZrN) и карбооксинитрида (ZrNxCyOz).
На следующей стадии этот продукт хлорируют, причем хлорирование с большой скоростью протекает начиная уже с 400°С, а выделяемого при этом тепла вполне достаточно для самопроизвольного протекания процесса.

В промышленности карбонизацию проводят в печах кипящего слоя.
Тетрахлорид циркония, получаемый при хлорировании циркона или оксикарбонитрида циркония, является техническим, т.е. содержит примеси железа, алюминия, титана, кремния и хлора. Перед тем, как отправить его на дальнейшую переработку, необходимо провести очистку от примесей. Очистку проводят возгонкой или методами солевой очистки. Для отделения железа, его предварительно восстанавливают водородом, при этом образуется хлорид железа (II) имеющий высокую температуру кипения и не возгоняющийся при температурах 500-600°С. Таким же образом очищают от хрома и от оксихлорида циркония.
Плазменное разложение.
Чрезвычайно интересный и перспективный процесс, основан на реакции термического разложения циркона:
 (53)
(53)
Температура необходимая для разложения достигается в плазменном факеле. Цирконовый концентрат измельченный до 200мкм подают в факел с температурой ~1270°С (аргоновая плазма). Разложение длится доли секунды, а степень разложения ~99%. После охлаждения получают сферические частицы диоксида циркония,
покрытые слоем аморфного диоксида кремния, который очень химически активен и легко растворяется в 50% растворе едкого натра
при температуре 120°С.
Таким образом, в результате плазменного разложения и двухстадийного выщелачивания получают практически чистый диоксид циркония (SiO2<1%) и раствор жидкого стекла (Na2SiO3).
Это очень простой с химической точки зрения процесс, не требующий реагентов. Кроме этого в этом процессе нет стоков. Однако аппаратурное оформление процесса представляет определенные трудности в создании крупнотоннажного производства.
Для получения других соединений циркония их получают спеканием диоксида циркония с соответствующими реагентами.
При плазменном разложении гафний ведет себя подобно цирконию.
Переработка эвдиалита.
На Кольском полуострове сосредоточено крупнейшее в мире месторождение эвдиалитовой руды, которая содержит (масс.%): Zr(Hf)O2- 1,9-2,0; SiO2 – 52,2-53,5; TiO2- 1,2-1,3; (Nb2O5 + Ta2O5) – 0,22-0.24; ∑РЗЭ - 0,7-0,8. После гравитацонно-флотационного комплексного обогащения, схема которого была разработана Горным институтом Кольского научного центра получают эвдиалитовый концентрат (извлечение до 70%) и эгириновый и полевошпатный концентраты. Эвдиалитовый концентрат содержит уже (масс.%): Zr(Hf)O2- 10,3; SiO2 – 47,38; (Nb2O5 + Ta2O5) – 0,56; ∑РЗЭ - 1,38. Для переработки этого концентрата Кольским научным центром было предложено два варианта азотнокислого метода разложения эвдиалита (рис. 7). Разложение концентрата проводят 20-50% азотной кислотой. Степень извлечения циркония в раствор при этом сильно зависит от избытка кислоты, взятой на разложение. При ее стехиометрическом количестве, степень извлечения не превышает 70%, а при увеличении количества кислоты до 800% от стехиометрии она возрастает до 90%. Кроме этого в процессе разложения образуются плохо фильтруемые кремнистые осадки. Для предотвращения этого (вариант 1) разложение проводят в присутствии затравки кремнезема, нагретой до 60 -100ºС. Показатели процесса разложения можно улучшить, вводя около 3% плавиковой кислоты. Это позволяет увеличивать степень извлечения циркония на 15-17% при стехиометрических количествах азотной кислоты. После разложения и фильтрации цирконий (гафний) и РЗЭ находятся в растворе, а тантал и ниобий остаются в твердом остатке. Из азотнокислого раствора цирконий выделяют экстракцией ТБФ. А оставшиеся растворы поступают на отгонку азотной кислоты, которую возвращают на разложение и выделение РЗЭ.

Рис. 7
Принципиальная технологическая схема азотнокислой переработки эвдиалитового концентрата
Второй вариант схемы предусматривает совмещение процессов разложения с экстракцией циркония. ТБФ насыщенный азотной кислотой вводят на стадию разложения. Соотношение Т: Ж поддерживают 1:8-10 (Ж=О+В). Отношение водной и органической фаз при этом составляет 1:1-0,5. Степень извлечения циркония за счет перевода его в органическую фазу повышалась до 95-99%. Пульпу после экстракции фильтровали. Тантал и ниобий остаются в твердом остатке, а РЗЭ в растворе, который доукрепляли азотной кислотой и возвращали на разложение. После накопления в них РЗЭ растворы выводят из схемы на извлечение РЗЭ. Реэкстракцию циркония из органической фазы проводят слабым (3-4%) раствором азотной кислоты. В дальнейшем из растворов аммиаком осаждали гидратированный оксид циркония.
Таким образом, используя данные варианты переработки эвдиалита можно не только получать оксид циркония, но и все ценные компоненты, содержащиеся в исходном сырье.
Интересна технология переработки эвдиалита, при которой после разложения концентрата азотной кислотой (80 – 100% от стехиометрии), продукты разложения высушивают (250 - 300ºС) и выщелачивают водой. В раствор переходят РЗЭ (до98%) и натрий с кальцием, а оксиды кремния, циркония, тантала, ниобия и др. не растворяются. Твердую фазу можно переплавлять с получением феррасплавов или огнеупоров.
Переработка бадделита.
Одним из основных источников циркония является бадделитовый концентрат (БК). Сегодня единственным производителем БК является «Ковдорский ГРК» - Россия.
Товарный БК, содержащий 97,5-98,5% диоксида циркония используют без химической обработки в производстве огнеупоров, абразивов и керамики. Использовать БК для производства других химических соединений нецелесообразно.
Следует отметить, что в БК помимо циркония присутствуют гафний, ниобий, тантал, скандий: (мас.%)Nb2O5 – 0,6-0,8; Ta2O5 – 0,18-0,23; Sc2O3 – 0,04-0,06; HfO2- 0,7-1,8. Стоимость сопутствующих компонентов близка к стоимости БК. Поэтому комплексная переработка концентрата позволит, заметно снизить стоимость циркониевой продукции.
Ниобий (+5) и тантал (+5) примерно на 80% присутствуют в виде изоморфных примесей и входят в состав минералов уранпирохлора, пирохлора, циркелита и др. скандий практически полностью изоморфная примесь.
Радиоактивные элементы представлены ураном и торием. Для использования бадделитп необходимо максимально освободить его от радиоактивных примесей. Поэтому его повергают предварительной химической обработке соляной или серной кислотой. Это позволяет довести содержание диоксида циркония до 99,0 – 99,5%.
В зависимости от режима обработки в раствор переходят примесные редкие элементы и радиоактивные примеси.
Для переработки БК на химические соединения могут быть применены методы разложения, применяемых при разложении цирконовых концентратов. При этом значительно более полно могут быть извлечены такие элемента как ниобий, тантал, скандий, гафний.
|
|
|

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
© cyberpedia.su 2017-2025 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!