Молекулярно-кинетическая теория строения вещества дает стройное объяснение существованию трех агрегатных состояний - твердого, жидкого и газообразного, а также перехода вещества из одного состояния в другое, основываясь на различных силах притяжения и отталкивания, действующих между молекулами.
Основное положение молекулярно-кинетической теории строения вещества, вытекающее из опытных фактов, заключается в том, что атомы и молекулы, из которых состоят все макроскопические тела, находятся в состоянии непрерывного хаотического теплового движения.
Основное положение молекулярно-кинетической теории строения вещества, вытекающее из опытных фактов, заключается в том, что все макроскопические тела состоят из атомов и молекул, находящихся в состоянии непрерывного хаотического теплового движения. Наиболее убедительным опытным фактом, наглядно подтверждающим хаотический характер теплового движения и зависимость интенсивности этого движения от температуры, является броуновское движение.
Таковы в общих чертах основные представления молекулярно-кинетической теории строения вещества, лежащие в основе молекулярной физики, которой посвящена эта книга. Предметом молекулярной физики является изучение тех свойств вещества, которые обусловлены именно тем, что оно является совокупностью огромного числа движущихся молекул.
Молекулярно-кинетическая теория (сокращённо МКТ) — теория XIX века, рассматривавшая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
§ все тела состоят из частиц: атомов, молекул и ионов;
§ частицы находятся в непрерывном хаотическом движении (тепловом);
§ частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.
Основными доказательствами этих положений считались:
§ Диффузия
§ Броуновское движение
§ Изменение агрегатных состояний вещества
Статистический метод описания систем большого числа
частиц основан на большом многообразии законов природы, ко-
торые не проявляют себя при анализе поведения нескольких час-
тиц (если частицы не являются квантовыми!), однако великолеп-
но (с большой точностью!) работают, если число частиц велико.
Для квантовых частиц статистический метод необходимо приме-
нять даже для изучения небольшого количества частиц. Стати-
стический метод рассматривает параметры движения частиц
(например, координата, направление и модуль скорости части-
цы) как случайные величины, оперирует с усредненными характе-
ристиками системы частиц, с функциями распределения, с веро-
ятностями обнаружения частицы в том или ином состоянии.
Идеальный газ. Статистический и термодинамический ме-
тоды изучения систем большого числа частиц дополняют друг
друга. При их применении чрезвычайно полезной является мо-
дель идеального газа – наиболее простая модель системы мно-
гих частиц. По определению, идеальным газом называется
большое число точечных материальных частиц с конечной мас-
сой, между которыми отсутствуют силы взаимодействия,
действующие на расстоянии, и которые сталкиваются между
собой по законам соударения шаров. Простота модели делает ее
удобной для знакомства с методами изучения систем большого
числа частиц
Подидеальнымгазомбудемпониматьгаз, междучастицамикотороговзаимодействиенастолькомало, чтоимможнопренебречь.
РаспределениеМаксвеллаприменимокмножествусвойствиндивидуальныхмолекулвгазе. Онёмобычнодумаюткакораспределенииэнергиймолекулвгазе, ноономожеттакжеприменятьсякраспределениюскоростей, импульсов, имодуляимпульсовмолекул. Такжеономожетбытьвыраженокакдискретноераспределениепомножествудискретныхуровнейэнергии, иликакнепрерывноераспределениепонекоторомуконтинуумуэнергии.
Распределение энергии Максвелла может быть выражено как дискретное распределение энергии:
 ,
,
где  является числом молекул имеющих энергию
является числом молекул имеющих энергию 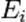 при температуре системы
при температуре системы 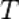 ,
,  является общим числом молекул в системе и
является общим числом молекул в системе и 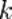 — постоянная Больцмана. (Отметьте, что иногда вышеупомянутое уравнение записывается с множителем
— постоянная Больцмана. (Отметьте, что иногда вышеупомянутое уравнение записывается с множителем 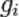 , обозначающим степень вырождения энергетических уровней. В этом случае сумма будет по всем энергиям, а не всем состояниям системы). Поскольку скорость связана с энергией, уравнение (1) может использоваться для получения связи между температурой и скоростями молекул в газе. Знаменатель в уравнении (1) известен как каноническая статистическая сумма.
, обозначающим степень вырождения энергетических уровней. В этом случае сумма будет по всем энергиям, а не всем состояниям системы). Поскольку скорость связана с энергией, уравнение (1) может использоваться для получения связи между температурой и скоростями молекул в газе. Знаменатель в уравнении (1) известен как каноническая статистическая сумма.
4.8 Параметры состояния - физические величины, характеризующие внутреннее состояние термодинамической системы. Параметры состояния термодинамической системы подразделяются на два класса: интенсивные и экстенсивные.
Интенсивные свойства не зависят от массы системы, а экстенсивные - пропорциональны массе.
Термодинамическими параметрами состояния называются интенсивные параметры, характеризующие состояние системы.
Параметры:
1. - абсолютное давление- численно равно силе F, действующей на единицу площади f поверхности тела ┴кпоследней, Па=Н/м2
2. - удельный объём-это объем единицы массы вещества.
3. Температура есть единственная функция состояния термодинамической системы, определяющая направление самопроизвольного теплообмена между телами.
Термодинамический процесс – непрерывная последовательность равновесных состояний.
Уравнение термодинамического процесса –
Внутренняя энергия – полный запас энергии, определяемый внутренним состоянием.
Теплообмен – процесс передачи энергии путём передачи теплоты.
Термодинамическая работа – работа, вызванная изменением объёма.
Основными процессами в термодинамике являются:
изохорный, протекающий при постоянном объеме; изобарный, протекающий при постоянном давлении; изотермический, происходящий при постоянной температуре; адиабатный, при котором теплообмен с окружающей средой отсутствует;
На основе использования основных положений молекулярно-кинетической теории было получено уравнение, которое позволяло вычислить давление газа, если известны масса m 0 молекулы газа, среднее значение квадрата скорости молекул 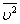 и концентрация n молекул:
и концентрация n молекул:

Это и есть основное уравнение молекулярно-кинетической теории.
Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа 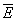 :
:
 ,
,
получим

Связь между термодинамической вероятностью состояния системы и ее энтропией
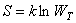 , ,
|
где, R  – универсальная газовая постоянная, NA – число Авогадро.
– универсальная газовая постоянная, NA – число Авогадро.
Изменение внутренней энергии
Δ U=U2-U1=i/2·m/μ·R (T2-T1)
4.9 Для моля газа объемом V при температуре Т и давлении р, уравнение Ван-дер-Ваальса имеет вид:
(p+a/Vm 2)(Vm - b) = RT,
где: R — газовая постоянная, a и b — экспериментальные константы, учитывающие отклонение свойств реального газа от свойств идеального газа.
Изотермы Ван-дер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса для моля газа.
Изотермический процесс идеального газа.
Осуществить изотермический процесс можно только при наличии
достаточно большой емкости источника теплоты данной температуры,
обеспечивающей непрерывный подвод теплоты к телу в течение всего
процесса, при постоянной температуре.
T=const dT=0
Pv=RT
Pv=const
P1v1=P2v2
P1 / P2=v2/v1

1-2 изотермическое расширение dv>0, dp<0
1-2' -изотермическое сжатие dv<0, dq<0, dp>0
4.10 Сумма кинетических энергий беспорядочного движения всех молекул тела и потенциальных энергий их взаимодействия друг с другом называется внутренней энергией тела.
^ Внутренняя энергия тела зависит от температуры и массы тела, от того, в каком агрегатном состоянии находится вещество и от некоторых других факторов.
Существует два способа изменения внутренней энергии тела: совершение работы и теплопередача.
При совершении работы внутренняя энергия меняется в двух случаях: при трении и при неупругой деформации.
При работе силы трения внутренняя энергия трущихся тел увеличивается за счёт уменьшения их механической энергии.
При неупругом сжатии тела его внутренняя энергия также увеличивается за счёт уменьшения механической энергии. При неупругом расширении тела его внутренняя энергия уменьшается и переходит в механическую энергию.
Теплопередача – процесс изменения внутренней энергии без совершения работы, при котором внутренняя энергия одного тела увеличивается за счёт уменьшения внутренней энергии другого тела.
Переход внутренней энергии при теплопередаче всегда происходит от тел с более высокой температурой к телам с более низкой температурой.
Существует три способа теплопередачи: теплопроводность, конвекция и излучение.
Теплопроводность – это способ теплопередачи, при котором внутренняя энергия передаётся при непосредственном контакте тел или частей тела.
^ Передача энергии при теплопроводности происходит от молекулы к молекуле по «цепочке». При этом переноса вещества не происходит.
Теплопроводность различных веществ различна. Хорошей теплопроводностью обладают металлы, особенно серебро и медь. Плохая теплопроводность у дерева. Теплопроводность жидкостей меньше, чем у твёрдых тел. Ещё меньшей теплопроводностью обладают газы, в том числе воздух. Наличие в материалах пространств, заполненных воздухом, уменьшает их теплопроводность.
Нулевой теплопроводностью обладает вакуум – пространство, в котором отсутствует вещество. В вакууме теплопроводность осуществляться не может.
Конвекция – способ теплопередачи, при котором внутренняя энергия переносится струями газа или жидкости.
При конвекции происходит перенос вещества – внутренняя энергия переносится вместе с частицами вещества.
Излучение – это способ теплопередачи, при котором внутреннюю энергию от одного тела к другому переносят электромагнитные волны. При излучении одно тело испускает электромагнитные волны и отдаёт внутреннюю энергию, а другое тело поглощает электромагнитные волны и получает внутреннюю энергию.
Количество теплоты, необходимое для повышения температуры некоторого количества вещества на 1 градус, называется его теплоемкостью.
Теплоемкость одноатомного газа при постоянном объеме Cv = (3/2) Nk
Первое начало термодинамики:
при разнообразных процессах, протекающих в природе, энергия не возникает из ничего и не уничтожается, но превращается лишь из одних видов в другие.
Изменение внутренней энергии тела равно разности сообщенного телу количество теплоты и произведенной над ним механической работы.
4.11 Изопроцессы - процессы, протекающие при неизменном значении одного из параметров.
Изотермический процесс (T = const, следовательно ΔU = 0).
По первому закону термодинамики: Q = A'.
Газ совершает работу A' за счет подводимого тепла Q (A'>0, Q>0).
Совершение работы внешними силами A (сжатие газа) требует отвода тепла Q от газа для сохранения его температуры (A>0, Q<0).
Изохорный процесс (V = const, следовательно A = 0).
По первому закону термодинамики: ΔU = Q.
Нагревание газа в закрытом сосуде приводит к увеличению его внутренней энергии U (температуры) (Q>0, ΔU>0).
Охлаждение газа в закрытом сосуде приводит к уменьшению его внутренней энергии U (температуры) (Q<0, ΔU<0).
Изобарный процесс (p = const).
По первому закону термодинамики: Q = ΔU + A'.
Подводимое к газу тепло Q частично идет на увеличение внутренней энергии U, а частично на совершение работы газом A' (Q>0, ΔU>0, A'>0).
Работа внешних сил A при изобарном сжатии газа требует отвода тепла Q от газа, одновременно уменьшается его внутренняя энергия U (Q<0, ΔU<0, A>0).
Адиабатный процесс - процесс, протекающий без теплообмена с окружающей средой (Q = 0).
По первому закону термодинамики: ΔU = A.
Вся работа внешних сил А идет только на увеличение внутренней энергии газа (A>0, ΔU>0).
Работа газа А' совершается только за счет потери внутренней энергии газа (A'>0, ΔU<0).
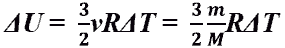 Изменение внутренней энергии
Изменение внутренней энергии
идеального одноатомного газа.
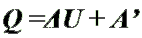 Количество теплоты, переданное телу,
Количество теплоты, переданное телу,
идет на изменение его внутренней энергии
и на совершение им работы (Первый закон термодинамики).
 Количество теплоты при нагревании и охлаждении газа.
Количество теплоты при нагревании и охлаждении газа.
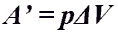 Работа газа при изобарном процессе (p = const)
Работа газа при изобарном процессе (p = const)
Энтропия системы является функцией ее состояния, определенная с точностью до произвольной постоянной.
Если система совершает равновесный переход из состояния 1 в состояние 2, то изменение энтропии
|
|  . .
|
| |
Таким образом, по формуле (6.2.1) можно определить энтропию лишь с точностью до аддитивной постоянной, т.е. начало энтропии произвольно. Физический смысл имеет лишь разность энтропий.
Исходя из этого, найдем изменения энтропии в процессах идеального газа.
Так как при Т = const,
|
| 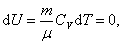 , ,
|
|
|
|
|  , ,
|
|
|
|
|  , или , или
|
|
|
|
| 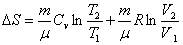 . .
|
| |
Таким образом, изменение энтропии ΔS1-2 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида перехода 1 - 2.
Каждый из изопроцессов идеального газа характеризуется своим изменением энтропии, а именно:
- изохорический:
 , т.к.
, т.к.  ;
; - изобарический:
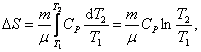 т.к. Р1 = Р2;
т.к. Р1 = Р2; - изотермический:
 т.к.
т.к. 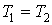 ;
; - адиабатический:
 , т.к.
, т.к. 
Отметим, что в последнем случае адиабатический процесс называют изоэнтропийным процессом, т.к.  .
.
Из второго начала термодинамики следует, что теплоемкость пропорциональна производной от энтропии системы S по т-ре Т при постоянстве внеш. силы или термодинамич. координаты (обозначается индексом z):

Наиб. важными видами теплоемкости являются теплоемкость CV при постоянном объеме V и теплоемкость Ср при постоянном давлении р:
СV = (9U/9T)V = T(9S/9T)V, Ср = (9Н/9Т)р = Т(9S/9Т)р,
где U-внутр. энергия, H-энтальпия системы.





 ,
, является числом молекул имеющих энергию
является числом молекул имеющих энергию 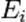 при температуре системы
при температуре системы 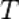 ,
,  является общим числом молекул в системе и
является общим числом молекул в системе и 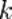 — постоянная Больцмана. (Отметьте, что иногда вышеупомянутое уравнение записывается с множителем
— постоянная Больцмана. (Отметьте, что иногда вышеупомянутое уравнение записывается с множителем 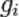 , обозначающим степень вырождения энергетических уровней. В этом случае сумма будет по всем энергиям, а не всем состояниям системы). Поскольку скорость связана с энергией, уравнение (1) может использоваться для получения связи между температурой и скоростями молекул в газе. Знаменатель в уравнении (1) известен как каноническая статистическая сумма.
, обозначающим степень вырождения энергетических уровней. В этом случае сумма будет по всем энергиям, а не всем состояниям системы). Поскольку скорость связана с энергией, уравнение (1) может использоваться для получения связи между температурой и скоростями молекул в газе. Знаменатель в уравнении (1) известен как каноническая статистическая сумма.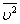 и концентрация n молекул:
и концентрация n молекул:
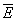 :
: ,
,
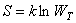 ,
,
 – универсальная газовая постоянная, NA – число Авогадро.
– универсальная газовая постоянная, NA – число Авогадро.
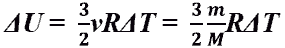 Изменение внутренней энергии
Изменение внутренней энергии 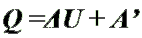 Количество теплоты, переданное телу,
Количество теплоты, переданное телу,  Количество теплоты при нагревании и охлаждении газа.
Количество теплоты при нагревании и охлаждении газа.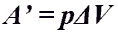 Работа газа при изобарном процессе (p = const)
Работа газа при изобарном процессе (p = const) .
.
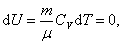 ,
,
 ,
,
 , или
, или
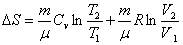 .
.
 , т.к.
, т.к.  ;
;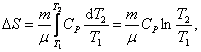 т.к. Р1 = Р2;
т.к. Р1 = Р2; т.к.
т.к. 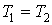 ;
; , т.к.
, т.к. 
 .
.



