

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
Топ:
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Интересное:
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Органическая химия
методические указания к лабораторному практикуму для студентов дневной формы обучения
факультетов химико-технологического и
Строительного материаловедения
Екатеринбург
Министерство образования Российской Федерации
ГОУ ВПО Уральский государственный технический университет - УПИ
Органическая химия
методические указания к лабораторному практикуму для студентов дневной формы обучения факультетов химико-технологического и строительного материаловедения
Екатеринбург
УДК 547
Составители: В.Л. Русинов, Е.Н. Уломский, Л.И. Русинова
органическая химия. методические указания к лабораторному практикуму для студентов дневной формы обучения факультетов химико-технологического и строительного материаловедения / В.Л. Русинов,
Е.Н. Уломский, Л.И. Русинова
Екатеринбург: УГТУ-УПИ, 2004, 32 с.
методическое пособие для организации самостоятельной работы студентов. В них дано описание методов получения, очистки и первичной идентификации органических соединений, приведен список контрольных вопросов по теории и эксперименту в органическом синтезе. Пособие является учебным материалом для студентов II курса ФСМ, а также II и III курсов ХТФ.
Библиогр.: 8 назв., 10 рис.
Подготовлено кафедрой «Органическая химия»
Составители: Русинов Владимир Леонидович
Уломский Евгений Нарциссович
Русинова Лариса Ивановна
Редактор
| Подписано в печать | 15.01.2001 | Формат 64 ´ 84 1/16 | |||
| Бумага типографская | Офсетная печать | Усл. печ. л. 1,16 | |||
| Уч.-изд. л. 1,11 | Тираж Заказ | Цена «С» | |||
| Редакционно-издательский отдел УГТУ-УПИ | |||||
| 620002, Екатеринбург, УГТУ-УПИ, 8-й уч. корпус | |||||
| Ротапринт УГТУ-УПИ. 620002, Екатеринбург, УГТУ-УПИ, 8-й уч. корпус | |||||
| © ГОУ ВПО Уральский государственный технический университет – УПИ, 2004 | |||||
содержание
|
|
| стр. |
Введение 3
1. Реакции нуклеофильного замещения 4
1.1. Бромистый бутил 4
1.2. Этилформиат (муравьиноэтиловый эфир) 51.3. Ацетанилид 6
2. Реакции, протекающие с участием альдегидов и кетонов 8
2.1. Оксим циклогексанона 82.2. Дибензилиденацетон (стирилкетон) 9
2.3. Бензиловый спирт и бензойная кислота из бензальдегида
(реакция Канниццаро) 10
2.4. Адипиновая кислота 11
3. Синтезы с помощью магнийорганических соединений 13
3.1. Бензойная кислота 13
4. Реакции электрофильного замещения в ароматическом ряду 14
4.1. п-Нитроанилин 14
5. Реакции восстановления нитросоединений до аминов 16
5.1. Анилин 16
6. Реакции ароматических диазосоединений 18
6.1. Метилоранж 18
6.2. Фенол 20
6.3. п-Нитроанилиновый красный 21
Рекомендуемая литература 23
Предисловие
Лабораторный практикум по органической химии является важнейшим элементом обучения предмету. Цель этого раздела программы состоит в том, чтобы обучить студентов начальным навыкам синтетической работы, закрепить теоретические знания предмета, научить правильному оформлению результатов экспериментальных результатов и умению работать со справочной и учебной литературой.
Для квалифицированного освоения всех этих стадий синтеза необходим большой опыт синтетической работы. Настоящая методическая разработка имеет целью ознакомление студентов младших курсов УГТУ-УПИ с началами органического синтеза.
I. синтез
Основными операциями синтеза являются нагревание, охлаждение, перемешивание, встряхивание, растворение и проч. Обычно считается целесообразным проводить синтез в некотором сосуде хотя бы потому, что в нем достаточно удобно регулировать условия протекания синтеза. Кроме того, из этого сосуда достаточно легко можно обработать реакционную массу на стадии выделения сырого продукта. Поэтому необходимо ознакомиться с основными видами реакционных сосудов, применяемых в органическом синтезе.
|
|
I.I. Реакционный сосуд
Для проведения реакции обычно используют сосуд, в который можно поместить реагенты и осуществить синтез. Для этого необходимо соблюдение следующих условий.
а) объем сосуда был больше общего объема загружаемых ингредиентов. Обычно коэффициент заполнения (j) реакционного сосуда составляет 0.5 – 0.7, а при проведении реакции с перемешиванием значение jсоставляет 0.4 – 0.5;
б) материал, из которого сделан сосуд, должен соответствовать требованиям, предъявляемым температурным режимом реакции, и не должен реагировать с реакционной массой;
в) сосуд должен легко соединяться с дополнительными приборами, необходимыми для проведения синтеза.
Наиболее простыми и удобными в пользовании реакционными сосудами являются химические стаканы, которые могут быть изготовлены из фарфора (рис. 1,а) или термостойкого стекла (рис. 1,б). Стеклянные стаканы менее прочны, чем фарфоровые, однако стекло лучше проводит тепло, а, кроме того, позволяет наблюдать протекание реакции.

| 
| 
| ||
| а | б | в |
Рисунок 1
Исключительная простота конструкции, отличающая стаканы, устанавливает жесткий предел их функциям, оставляя лишь простые синтезы. Так, стаканы нельзя использовать при нагревании низкокипящих и легковоспламеняющихся растворителей. В этом случае часто применяют плоскодонную колбу Эрленмейера (рис. 1,в), к тубусу которой можно присоединить дополнительные приборы или закрыть пробкой.
При всех удобствах колбы Эрленмейера ее нельзя использовать при работе с вакуумом во избежание взрыва. Кроме того, при перемешивании и кипячении суспензий осадок скапливается у стенок колбы, что мешает нормальному протеканию реакции.
Наиболее универсальной формой реакционного сосуда, позволяющей совершать наибольшее количество операций, оказывается сферическая или близкая к ней, и поэтому посудой, чаще всего применяемой в синтезе, являются круглодонные (рис. 2,а), а также грушевидные (рис. 2,б) и остродонные (рис. 2,в) колбы.
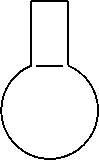
| 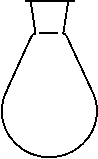
| 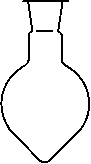
| 
| |||
| а | б | в | г |
Рисунок 2
Колбы чаще всего изготавливают из термостойкого стекла, однако известны случаи использования стальных, медных и даже полиэтиленовых колб. Материал для колбы выбирают в соответствии с условиями реакции.
|
|
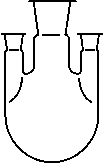
Сложные синтезы, в ходе которых оказывается необходимым осуществление нескольких операций (прибавление реагентов, перемешивание, пропускание газов, температурный контроль и проч.), требуют специальных колб с несколькими горлами (рис. 2,г), число которых обычно не превышает четырех. Если по каким-либо причинам возникает необходимость в большем числе гор, используют многогорлые насадки (рис. 8).
I.2. Перемешивание
Перемешивание в органическом синтезе используется для обеспечения фазовой и термической однородности реакционной массы. Перенос реагентов через поверхность раздела фаз в гетерогенных системах (твердое вещество - жидкость, жидкость - жидкость или жидкость - газ) замедлен и, следовательно, уменьшена скорость протекания реакции. В этом случае перемешиванием достигают увеличения поверхности межфазного контакта, таким образом, ускоряя реакцию. Часто бывает необходимо добавление реагента к реакционной массе в ходе процесса, и возникающие при этом локальные увеличения концентрации прибавляемого вещества могут привести к изменению результата взаимодействия. Перемешивание позволяет быстро и равномерно распределять реагент в реакционной массе.
В органическом синтезе обычно используют локальное нагревание (или охлаждение), могущее привести к нежелательным местным температурным скачкам. Перемешиванием при этом достигают термической однородности по всему объему смеси.
Простейший случай перемешивания наблюдается при кипячении реакционной массы. В тех случаях. Когда вязкость среды не слишком велика, интенсивное кипячение позволяет добиться вполне удовлетворительного перемешивания. Необходимо помнить о необходимости внесения перед кипячением центров парообразования, - так называемых «кипелок» (кусочков пористого кирпича или запаянных с одной стороны стеклянных капилляров).
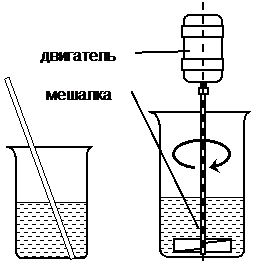
При проведении реакций жидкости с газами хорошее перемешивание обеспечивается сильным током проходящего газа. Этим способом иногда пользуются, пропуская через реакционную массу ток воздуха или инертного газа. Метод очень прост в аппаратурном оформлении и особенно часто используется в тех случаях, когда в реакционную добавляют газообразный реагент (аммиак, углекислый газ и проч.) или избавляются от ненужного газообразного продукта продуванием воздуха. Наиболее универсальным средством перемешивания в лабораторной практике являются стеклянные мешалки, однако известны случаи применения полиэтиленовых, тефлоновых и металлических мешалок. Формы мешалок бывают самыми различными в зависимости от требуемой эффективности перемешивания и конструкционных особенностей реакционного сосуда.
|
|
Простейшие мешалки представляют собой изогнутые стеклянные палочки (рис. 3,а), эффективность их, однако, невелика. Наиболее эффективны пропеллерные мешалки (рис. 3,б), они же часто используются при работе с широкогорлыми сосудами,
 | |||
 | |||
А б в г
Рисунок 3
Для узкогорлых сосудов используют лопастные (рис. 3,в) или проволочные мешалки, однако их эффективность мала. Очень мощными и удобными в работе являются мешалки, изготовленные из тефлоновой трубки.
Магнитные мешалки (рис. 3,д) часто используют в лабораторных синтезах, особенно при необходимости перемешивания в закрытом сосуде. Якорь из металла, заключенного в стеклянную, полиэтиленовую или тефлоновую оболочку, приводится в движение вращением сильного постоянного магнита. Мешалки такого рода очень удобны, однако их мощность невелика и в вязких реакционных массах они часто останавливаются.
Перемешивание в самом простом случае осуществляется вручную при помощи палочки, однако для продолжительных реакции используют электрические двигатели с мешалками. Частоту вращения при этом обычно регулируют при помощи лабораторных автотрансформаторов.
При всех преимуществах электродвигателей ни обычно не заземлены и поэтому возможно искрение (например, при работе в легковоспламеняющимися жидкостями), в качестве двигателя используют турбинки, приводимые в движение напором воды или газа.
I.3.1. Нагревание
Прямой нагрев на пламени спиртовки или газовой горелки возможен только при использовании сосудов, изготовленных из термостойких материалов (металл, термостойкое или кварцевое стекло). Нагрев осуществляется при непрерывном движении горелкой для равномерного обогрева всей поверхности сосуда.
Использование электрических плиток (особенно с закрытым элементом) является более безопасным вариантом прямого нагрева. Однако и он не применим для нагревания легковоспламеняющихся жидкостей. Удобство прямого способа нагревания состоит в возможности быстрого удаления источника тепла.
|
|
Во избежание местных перегревов, а также для более точной регулировки температурного режима используют различные бани.
Наиболее простым видом бань является баня воздушная (рис. 4,а).
Воздух, однако, - плохой и ненадежный проводник тепла (возможны местные перегревы реакционной массы в колбе), поэтому регулировать температуру воздушной бани и реакционной массы трудно. Частым вариантом воздушной бани является баня паровая, позволяющая нагревать реакционную массу при температуре 100о С. При применении песчаных бань - металлических чашек, заполненных мелким песком, - оказывается возможным нагрев практически во всем диапазоне температур, чаще всего применяемых в органическом синтезе. Однако и здесь терморегуляция является непростой проблемой, и также возможны местные перегревы, приводящие зачастую к последствиям неожиданным и нежелательным.
 | |||
 | |||
а 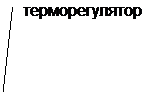
 б
б
 | |||
 | |||
Рисунок 4
Избежать локальных перегревов можно при использовании жидкостных бань. Наиболее распространенный вариант - водная баня, позволяющая осуществлять мягкий нагрев в диапазоне 20 – 100о С. Регулирование температуры осуществляют обычно посредством контактных термометров, соединенных с терморегулятором (рис. 4,б). Необходимо отметить, что при пользовании водяной (и паровой) баней трудно обеспечить безводные условия для реакционной массы. Поэтому эти бани опасны при работе со щелочными металлами.
Бани, в которых в качестве теплоносителя используются масло, парафин или глицерин (называющиеся соответственно масляными, парафиновыми или глицериновыми), позволяют нагревать реакционную массу до 200-250о С. Однако при высоких температурах они сильно дымят и становятся пожароопасными, а попадание воды приводит к разбрызгиванию содержимого, что чревато ожогами.
Прекрасным средством, позволяющим осуществить нагрев выше 80-100о С, являются эвтектические сплавы. Чаще всего применяются сплав Вуда (Тпл81о С; Bi - 50, Pb - 25, Sn - 12.5, Cd - 12.5 %) и сплав Розе (Тпл 98о С; Bi - 50, Pb - 25, Sn - 25 %). Такие бани отлично проводят тепло, подчиняются терморегуляции и непожароопасны. Правда, при охлаждении в них нельзя оставлять колбы и термометры, поскольку сплав, кристаллизуясь, разрушает стеклянную посуду.
I.3.2. Охлаждение
Способ охлаждения реакционного сосуда (как и способ нагрева) зависит от требуемой температуры.
Охлаждения до комнатной температуры достигают обычно, погружая колбу или стакан в баню с проточной холодной водой. Толстостенные и нетермостойкие сосуды во избежание их разрушения охлаждают постепенно: сначала теплой водой, затем более холодной (Dt хладоагента и стенки сосуда не должна превышать 60-80о). При необходимости отвода большего количества тепла пользуются ледяными банями - сосудами, наполненными мелко накрошенным льдом с водой. С помощью ледяных бань возможно достичь охлаждения до +5о С. Если допустимо разбавление реакционной массы водой, быстрого охлаждения можно достичь. Внося лед непосредственно в реакционную массу.
Для охлаждения смесей ниже 0о С чаще всего применяют смеси льда с различными солями. Так, смесь льда с NaCl позволяет достичь -21о С (в бане); с NaNO3 - -18 о С; с CaCl2* 6Н2O - -55 о С. Однако, температура бани сильно зависит от соотношения лед-соль, а также от степени измельчения льда.
Достижение более низких температур возможно при использовании растворов сухого льда (твердого CO2) в ацетоне (- 80 о С), этаноле (-75 о С), эфире (-99 о С) и т.д. Для таких охлаждающих бань применяют специальные сосуды, обеспечивающие теплоизоляцию бани, с двойным дном и теплоизоляцией (рис. 5,а) или вакуумированные сосуды Дьюара (рис. 5,б).
Растворы жидкого азота также позволяют получить хорошие охлаждающие бани. Сам жидкий азот (Ткип.= -196 о С) применяется лишь в особых условиях.
При работе с сухим льдом, жидким азотом и банями на их основе необходимо соблюдать осторожность, чтобы не получить обморожений.
 |
 а б
а б
 | |||
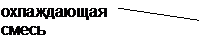 | |||

Рисунок 5
I.3.3. Конденсация
При нагревании реакционных смесей происходит испарение летучих веществ, которые необходимо либо возвращать обратно, либо - наоборот - удалять из зоны протекания реакции. Для осуществления используют холодильники, предназначенные для конденсации испарившихся жидкостей.
Простейшим холодильником является прямой воздушный, представляющий собой обычную трубку из термостойкого стекла. Он может служить для возврата конденсата в реакционную массу, называясь при этом обратным холодильником (рис. 6,а), либо для отвода паров, приобретая название нисходящего (рис. 6,б).
 |
 а б в
а б в
Рисунок 6
Потоки паров и конденсата в такой прямой трубке ламинарны (параллельны поверхности), теплообмен осуществляется только по механизму теплопроводности и, следовательно, малоэффективен. Поэтому прямой холодильник используют в качестве обратного реже, чем шариковый (рис. 7,а), который, в свою очередь, невозможно применять в качестве нисходящего. В шаровидных расширениях потоки паров и конденсата становятся турбулентными (хаотичными), вследствие чего механизм теплопередачи сменяется на более действенный - конвективный. Поскольку воздух - сухой охлаждающий агент, воздушные холодильники используют только при работе с высококипящими жидкостями (Ткип.> 150о С).
 |  | ||||||||
 |  | ||||||||
 | |||||||||
а б в г д
Рисунок 7
Вариантом прямого холодильника является холодильник с рубашкой (рис. 7.б), называемый холодильником Либиха. В качестве хладоагента для веществ с температурой кипения ниже 120 о С используется проточная вода, а в интервале 120-180 о С - непроточная. Этот холодильник часто используется как нисходящий, но в качестве обратного он не очень эффективен (по тем же причинам, что и прямой воздушный) и с этой целью применяется только для жидкостей, кипящих выше 100 о С. Наилучшим нисходящим холодильником считается змеевиковый (рис. 7,в), установленный вертикально. Его нежелательно использовать как нисходящий, поскольку конденсат может быть «выплюнут» из змеевика, что нежелательно или даже опасно. Обратным холодильником, лучшим, чем холодильник Либиха, является шариковый водяной холодильник (рис. 7,г). Еще один вариант обратного холодильника – холодильник Димрота (рис. 7д). Здесь предложена оригинальная конструкция «внутреннего» охлаждения – охлаждающий «змеевик» расположен внутри холодильника.
Достижение возможно более полной конденсации паров представляет непростую проблему и для ее решения созданы разнообразные конструкции холодильников, формы которых бывают весьма необычны и прихотливы. Существует правило, согласно которому чем холодильник эффективнее, тем он сложнее в изготовлении и, следовательно, дороже. Поэтому для большинства целей используют наиболее простые прямоточные и шариковые холодильники.
При использовании холодильников с водяным охлаждением следует помнить о том, что на наружной поверхности рубашки конденсируется атмосферная влага, могущая попасть внутрь колбы. Поэтому на холодильник ниже рубашки часто надевают манжету из фильтровальной бумаги.
V.1.1. Бромистый бутил
I. Разделы курса
Методы получения и свойства галогенопроизводных. Реакции нуклеофильного замещения SN1и SN2. Реакции элиминирования Е1 и Е2.
II. Вопросы по теории
I. Каков механизм замещения гидроксила в бутаноле-1 на бром? Почему необходима кислая среда? Механизмы нуклеофильного замещения SN1и SN2.
2. Какие спирты реагируют по механизму SN1 и какие по SN2.
3. От каких факторов зависит скорость реакции SN1 и SN2?
4. Понятие о лимитирующей стадии.
5. Порядок реакции. Моно- и бимолекулярные реакции SN.
6. Какой карбокатион: первичный, вторичный или третичный наиболее стабилен и почему?
7. Какова гибридизация атома углерода в карбокатионе?
8. Реакции элиминирования. Механизм образования олефинов. Соотношение реакций SN и Е.
9. Образование простых эфиров из спиртов. Механизм.
10. Объясните механизм реакций и назовите соединения, которые получатся из 2-метил-бутанола-2 в результате реакций SN и Е (привило Зайцева).
11. Напишите реакции превращения бутанола-1 в хлористый бутил с помощью реагентов:
1) HCl 2) PCl3 3) PCl5 4) SOCl2 .
Методы работы: перегонка низкокипящих жидкостей, сушка жидкостей.
III. Методика синтеза
Исходные вещества:
Бутиловый спирт – 46 мл
Бромистый калий – 75 г
Серная кислота конц. - 50 мл
В круглодонную колбу емкостью 250 мл вливают 70 мл воды, прибавляют тонко растертый бромистый калий и бутиловый спирт. Присоединяют обратный холодильник (какой?), вставляют в его форштросс воронку и через нее небольшими порциями (5-7 мл) приливают серную кислоту (маска!), каждый раз перемешивая смесь покачиванием колбы. В колбу бросают несколько "кипелок" и кипятят на воздушной бане 1,5 часа.
Реакционная масса разделяется на 2 слоя. Затем колбу соединяют с помощью изогнутой трубки с нисходящим холодильником и отгоняют сырой бромистый бутил. Продукт отделяют от воды в делительной воронке, промывают водой, сушат сульфатом натрия и перегоняют, собирая фракцию, кипящую при 98-103 ºC.
IV.Вопросы по методике синтеза
1. Для чего в реакционную смесь добавляют воду?
2. Какова роль серной кислоты? Почему её следует добавлять небольшими порциями и при перемешивании?
3. Что представляют собой верхний и нижний слои реакционной массы? За счет чего органический слой окрашен в бурый цвет?
4. Как определить конец отгонки сырого бромистого бутила?
5. В каком слое находится бутилбромид в дистилляте и при промывках водой?
6. Можно ли сушить бромистый бутил щелочью?
7. Схема прибора для перегонки бромистого бутила.
8. Почему перед перегонкой следует удалять добавленный для сушки Na2SO4?
9. техника безопасности при работе с концентрированной серной кислотой и огнеопасными органическими жидкостями.
V.1.2. ЭТИЛФОРМИАТ
V. Разделы курса
Сложные эфиры. Строение, свойства. Способы получения и применение.
VI.Вопросы по теории
1. Механизм реакции этерификации. Роль серной кислоты. Исследование реакции этерификации. Исследование реакции этерификации с помощью меченых атомов.
2. Обратимость реакции этерификации. Гидролиз сложного эфира в кислой и щелочной средах.
3. Почему выход продукта в равновесных условиях не превышает 70%? Как можно повысить выход эфира?
4. Как может развиваться реакция этерификации, если минеральная кислота способна одинаково протонировать в спирт и кислоту, давая в реакционной смеси два катиона – оксониевый и карбониевый?
5. Зависимость скорости реакции этерификации от строения спирта (первичный, вторичный, третичный)
6. Назовите следующие соединения: H3COSO2OCH3; C2H5OSO3H;
H3C-C(О)-OC4H9 ; H3COC2H5.
Методы работы: перегонка низкокипящих жидкостей, сушка жидкостей, выбор осушающего агента для сложных эфиров.
VII. Методика синтеза:
Исходные вещества:
Муравьиная кислота - 67 мл
Этиловый спирт 96% - 77 мл
Серная кислота конц. - 10 мл.
Исходные вещества помещают в круглодонную колбу на 250 мл, снабженную обратным холодильником, и кипятят в течение часа на водяной бане. К колбе с помощью насадки присоединяют нисходящий холодильник и отгоняют образовавшийся муравьиноэтиловый эфир до максимального подъема температуры. После падения температуры на 3-4º перегонку прекращают. Полученный дистиллят промывают небольшими количествами 10% раствора соды (10 мл), а затем водой (20 мл). После отделения эфирного слоя его помещают в сухую колбу и высушивают хлористым кальцием. Затем эфир перегоняют, собирая фракцию, кипящую при 52-54º.
VIII. Вопросы по методике синтеза:
1. Для чего этилфермиат промывают раствором соды? Почему не рекомендуется промывка щелочью?
2. В каком слое этилформиат при промывках?
3. Чем объяснить, что этилформиат кипит при более низкой температуре, чем исходные вещества?
4. Как определить теоретический выход этилформиата?
5. Техника безопасности при работе с муравьиной, серной кислотами, с низкокипящими горючими жидкостями?
6. Как потушить загоревшийся этанол, муравьиную кислоту?
V.1.3. АЦЕТАНИЛИД
IX.Разделы курса:
Амины и амиды. Сравнение свойств и реакций. Ангидриды и хлорангидриды кислот.
X. Вопросы по теории
1. Сравните основность анилина и ацетанилида, нуклеофильность анилина и фенола.
2. Механизм реакции ацилирования анилина уксусным ангидридом. Ацилирующие агенты и ацильная защита аминогруппы.
3. Роль кислого катализа при ацилировании фенолов и низкоосновных аминов.
4. Укажите среди написанных аминов первичные, вторичные и третичные:
(CH3)2NH; CH3-NН-C2H5 ;(CH3)3N; (CH3)3CNH2; (C2H5)3N+CH3X
5. Назовите следующие соединения:

6. Напишите схемы реакций получения бензамида из толуола.
7. Напишите схемы щелочного и кислотного гидролиза ацетанилида.
8. Амидом какой кислоты является мочевина?
Методы работы: перекристаллизация, определение температуры плавления.
XI.Методика синтеза:
Исходные вещества:
Анилин – 9 мл
Уксусный ангидрид – 15 мл
В круглодонную колбу с обратным холодильником, помещенную в водяную баню, вносят исходные вещества и нагревают баню до кипения. После этого через форштросс холодильника приливают 50 мл воды, колбу хорошо охлаждают, выпавший осадок отфильтровывают и перекристаллизовывают из воды.
После высушивания определяют температуру плавления.
XII. Вопросы по методике синтеза:
1. Для чего после завершения реакции ацетилирования добавляют воду? Что при этом происходит?
2. Как проводится очистка вещества с помощью перекристаллизации? Каким требованиям должен отвечать растворитель для кристаллизации?
3. На чём основано применение активированного угля?
4. Что представляют собой маслянистые капли при кристаллизации ацетанилида?
5. Как проводят горячее фильтрование?
6. Как определяют температуру плавления вещества? Как по ней судят о чистоте вещества? Что такой проба смещения и как её используют для идентификации соединений?
7. Способы сушки кристаллических веществ.
8. Техника безопасности при работе с анилином, уксусным ангидридом, огнеопасными и токсичными органическими растворителями.
Альдегидов и кетонов
XXIX.
XXXVIII.
XLIV. Вопросы по теории: см. работу 4.1.
1. Механизм реакции сульфирования. Сульфирующие реагенты.
2. Обратимость реакции сульфирования. Десульфирование. Кинетический и термодинамический контроль сульфирования.
3. Химические свойства сульфокислот и их промышленное назначение.
Методы работы: перекристаллизация, определение температуры плавления.
Методика синтеза:
Исходные вещества:
анилин 9,3 г Натр едкий 4 г
серная кислота конц. 5,5 мл соляная кислота конц.
В фарфорофой чашке осторожно при перемешивании соединяют анилин с серной кислотой. Полученный остаток тщательно растирают и нагревают при температуре 170-190 ОС 1-2 ч так, чтобы из пробы реакционной массы не выделялся анилин при растворении в щелочи. После этого еще горячую реакционную массу измельчают и помещают в колбу Эрленмейера с 10 %-ным раствором едкого натра, приготовленным из 4 г щелочи. Смесь кипятят с активированным углем 5 мин, отфильтровывают горячим и подкисляют до рН 3 соляной кислотой. Выпавший по охлаждении продукт перекристаллизовывают из воды.
Вопросы по методике синтеза:
1. Объясните способ анализа пробы реакционной массы.
2. Рассчитайте примерное количество соляной кислоты, необходимое для нейтрализации щелочи.
3. техника безопасности при работе с концентрированными кислотами, едкими щелочами, ароматическими аминами.
V.5.1. Анилин
XLIX. V.6.1. Метилоранж
LIV.
LV. V.6.2. ФЕНОЛ
LXII. Вопросы по теории
1. Механизм реакции диазотирования ароматических аминов. Образование нитрозил-катиона.
2. Механизм реакции азотосочетания.
3. В какой среде проводят азосочетание с фенолами и в какой - с аминами?
4. почему амины не вступают в реакцию азосочетания в сильно кислой среде, а фенолы- в сильно щелочной?
5. Реакционная способность b-нафтола
Методы работы: проведение реакций при охлаждении, фильтрация.
LXIII. Методика работы:
Исходные вещества:
п-Нитроанилин - 2 г
Нитрит натрия – 1,2 г
b-Нафтол - 2 г
Ацетат натрия - 4 г
В стакане растворяют п-нитроанилин в 28-30 мл горячей воды, содержащей 6 мл 6н соляной кислоты. Полученный рствор охлаждают до 0ºС и добавляют к нему по каплям раствор нитрита натрия в 8 мл воды. Если при этом выпадает осадок, добавляют еще немного 6н соляной кислоты до его полного растворения. Конец реакции проверяют по йодкрахмальной бумаге. Реакция считается законченной, если капля раствора, нанесенная на бумажку, вызывает ее посинение. Реакционную массу выдерживают 30 минут и добавляют раствор ацетата натрия в 15 мл воды.
В другом стакане растворяют b-нафтол в 8 мл 8н раствора едкого натра. Затем добавляют 100 мл горячей воды. Полученную смесь охлаждают и при перемешивании вносят в раствор соли арилдиазония. Через 30 минут выпавший осадок отфильтровывают, промывают на фильтре 20% раствором поваренной соли, затем холодной водой. Сушат на воздухе.
LXIV. Вопросы по методике синтеза:
1. С какой целью b-нафтол растворяют в щелочи?
2. Почему в ходе диазотирования и азосочетания поддерживают низкую температуру?
3. техника безопасности при работе с ароматическими аминами и нитритом натрия.
Список ЛИТЕРАТУРы
1. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – М: Высшая школа, 1981. – 529 с.
2. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. – М.: Химия, кн. 1. 1969. - 663 c.; Кн. 2. 1970. – 824 с.
3. Терней А. Современная органическая химия. – М.: Мир, 1981, т.21. – 678 с., т. 2 – 652 с.
4. Лабораторные работы по органической химии/ Под ред. О.Ф. Гинзбурга, А.А. Петрова. – М.: Высшая школа, 1974. – 286 с.
5. Практикум по органической химии / А.М. Симонов, Ф.Т. Пожарский, Г.В. Немиров, З.Н. Назарова и др. Ростов-на-Дону: изд. Ростовского униврситета, 1971. – 143 с.
6. Органикум. Практикум по органической химии/ Г. Беккер, В. Беккер, Г. Г. Доллике и др. – М.: Мир, 1979, кн. 1 – 453 с.; кн. II – 442 с.
7. А.Е. Агрономов, Ю.С. Шабаров. Лабораторные работы в органическом практикуме. М.: МГУ, 1971, 230 с.
8. С.С. Гитис, А.И. Глаз, А.И. Иванов. Практикум по органической химии. Органический синтез. М.: Высшая школа, 1991, 303 с.
9. Лабораторный практикум по синтезу промежуточных продуктов и красителей. под ред. А.В. Ельцова. Л.: Химия. 1985, 352 с.
10. А.И. Ефимов, Л.П. Белорукова, И.В. Василькова, В.П. Чечев. Свойства неорганических соединений. Справочник. Л.: Химия, 1983, 392 с.
11. Свойства органических соединений. Справочник. Под ред. А.А. Потехина. Л.: Химия, 1984, 520 с.
12. Л. Титце, Т. Айхер. Препаративная органическая химия. Реакции и синтезы в практикуме органической химии и научно-исследовательской лаборатории. Перевод под ред. Ю.Е. Алексеева. М.: Мир, 199, 704 с.
13. Дж.Шарп, И. Госни, А. Роули.
14. Практикум по органической химии. Перевод с англ. под ред. В.В. Москвы. М.: Мир, 1993, 240 с.
[1] Следует соблюдать осторожность на первой стадии окисления (хорошо перемешать реакционную массу и не допускать разогрева). Возможна бурная реакция с выбросом реакционной массы!
Органическая химия
методические указания к лабораторному практикуму для студентов дневной формы обучения
факультетов химико-технологического и
строительного материаловедения
Екатеринбург
Министерство образования Российской Федерации
ГОУ ВПО Уральский государственный технический университет - УПИ
Органическая химия
методические указания к лабораторному практикуму для студентов дневной формы обучения факультетов химико-технологического и строительного материаловедения
Екатеринбург
УДК 547
Составители: В.Л. Русинов, Е.Н. Уломский, Л.И. Русинова
органическая химия. методические указания к лабораторному практикуму для студентов дневной формы обучения факультетов химико-технологического и строительного материаловедения / В.Л. Русинов,
Е.Н. Уломский, Л.И. Русинова
Екатеринбург: УГТУ-УПИ, 2004, 32 с.
методическое пособие для организации самостоятельной работы студентов. В них дано описание методов получения, очистки и первичной идентификации органических соединений, приведен список контрольных вопросов по теории и эксперименту в органическом синтезе. Пособие является учебным материалом для студентов II курса ФСМ, а также II и III курсов ХТФ.
Библиогр.: 8 назв., 10 рис.
Подготовлено кафедрой «Органическая химия»
|
|
|

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!