

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Распространение рака на другие отдаленные от желудка органы: Характерных симптомов рака желудка не существует. Выраженные симптомы появляются, когда опухоль...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Спирты
Это производные УВ, у которых один или несколько атомов Н замещены на –ОН группу.
Классификация:
I. По количеству групп ОН различают одноатомные, двухатомные и многоатомные спирты:
СН3-СН2-ОН 

Этанол Этиленгликоль Глицерин
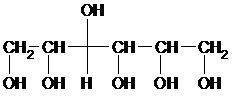
Сорбит
II. По характеру R различают: 1) предельные, 2) непредельные,
3) циклические, 4) ароматические.
2) СН2 = СН-СН2-ОН
Аллиловый спирт
 3) К непредельным циклическим спиртам относятся:
3) К непредельным циклическим спиртам относятся:
ретинол (витамин А) и холестерин

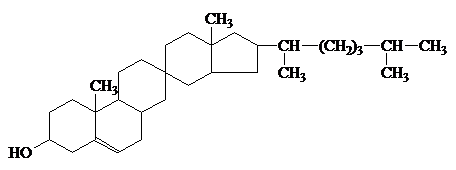 Инозит
Инозит
витаминоподобное в-во
группы В
|
| 4) | 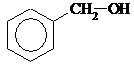 Бензиловый спирт
Бензиловый спирт
|
III. По положению гр. –ОН различают первичные, вторичные и третичные спирты.
IV. По количеству атомов С различают низкомолекулярные и высокомолекулярные.
СН3–(СН2)14 –СН2–ОН (С16Н33ОН) СН3–(СН2)29 –СН2ОН (С31Н63ОН)
Цетиловый спирт Мирициловый спирт
Цетилпальмитат – основа спермацета, мирицилпальмитат содержится в пчелином воске.
Номенклатура:
Тривиальная, рациональная, МН (корень+окончание «ол»+арабская цифра).
Изомерия:
цепи, положения гр. –ОН, оптическая.
Строение молекулы спирта


 СН-кислотный Nu центр
СН-кислотный Nu центр
|
|
 | |||||
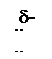 |
| ||||
R ® СН2 ® О Н
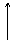 | |||
 | |||
Электрофильный Центр Кислотный
центр основности центр
Р-ции окисления
и Е
1) Спирты – слабые кислоты.
2) Спирты – слабые основания. Присоединяют Н+ лишь от сильных кислот, но они более сильные Nu.
3) –I эффект гр. –ОН увеличивает подвижность Н у соседнего углеродного атома. Углерод приобретает d+ (электрофильный центр, SЕ) и становится центром нуклеофильной атаки (Nu). Связь С–О рвется более легко, чем Н–О, поэтому характерными для спиртов явл-ся р-ции SN. Они, как правило, идут в кислой среде, т.к. протонирование атома кислорода увеличивает d+ атома углерода и облегчает разрыв связи. К этому типу относятся р-ции образования эфиров, галогенопроизводных.
|
|
4) Смещение элекронной плотности от Н в радикале приводит к появлению СН-кислотного центра. В этом случае идут р-ции окисления и элиминирования (Е).
Физические св-ва
Низшие спирты (С1–С12) – жидкости, высшие – твердые вещ-ва. Многие св-ва спиртов объясняются образованием Н-связи:

Химические св-ва
I. Кислотно-оснóвные
Cпирты – слабые амфотерные соединения.
2R–ОН + 2Nа ® 2R–ОNа + Н2
Алкоголят
натрия
Алкоголяты легко гидролизуются, что показывает – спирты более слабые кислоты, чем вода:
R– ОNа + НОН ® R–ОН + NаОН
Оснóвный центр в спиртах – гетероатом О:
|
|
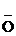 Н +
Н +  Сl- ® [СН3-СН2-
Сl- ® [СН3-СН2- 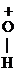 -Н]Сl-
-Н]Сl-
Этилоксонийхлорид
II. Реакции SN по гр. –ОН
Гр. -ОН является плохоуходящей группой (связь мало полярна), поэтому большинство р-ций проводят в кислой среде. Механизм р-ции:
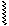
|
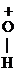 -Н ® СН3-СН2+ + Н2О
-Н ® СН3-СН2+ + Н2О
Если р-ция идет с галогеноводородами, то присоединяться будет галогенид-ион: СН3-СН2+ + Сl- ® СН3-СН2Сl
НС1 RОН R-СООН NН3 С6Н5ОNа
¯ ¯ ¯ ¯ ¯
С1- R-О- R-СОО- NН2- С6Н5О-

Анионы в таких р-циях выступают в качестве нуклеофилов (Nu) за счет «-» заряда или неподеленной электронной пары. Анионы являются более сильными основаниями и нуклеофильными реагентами, чем сами спирты. Поэтому на практике для получения простых и сложных эфиров используются –алкоголяты, а не сами спирты. Если нуклеофилом является другая молекула спирта, то она присоединяется к карбокатиону:
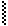
|
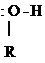 ® СН3-СН2+ -
® СН3-СН2+ - 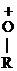 - Н
- Н 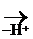 СН3-СН2-О-R
СН3-СН2-О-R
Это р-ция алкилирования (введение алкила R в молекулу).
Заместить –ОН гр. на галоген можно при действии РСl3, РСl5 и SОСl2.
По такому механизму легче реагируют третичные спирты.
Р-цией SЕ по отношению к молекуле спирта является р-ция образования сложных эфиров с органическими и минеральными к-тами:
|
|
 R – О Н + Н О –
R – О Н + Н О – 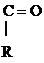
 R – О –
R – О – 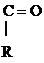 + Н2О
+ Н2О
Сложный эфир
Это р-ция ацилирования – введение ацила в молекулу.
|
 R -
R - 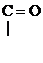
Азотная Сложный
к-та эфир
III. Р-ции Е (отщепления, или элиминирования)
Эти р-ции конкурируют с реакциями SN.

|
|
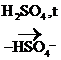 СН3-СН2-
СН3-СН2- 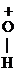 -Н
-Н 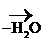 СН3-СН2+
СН3-СН2+
При избытке Н2SО4 и более высокой температуре, чем в случае р-ции образования простых эфиров, идет регенерация катализатора и образуется алкен:
СН3-СН2+ + НSО4- ® СН2 = СН2 + Н2SО4
Легче идет р-ция Е для третичных спиртов, труднее для вторичных и первичных, т.к. в последних случаях образуется менее стабильные катионы. В данных р-циях выполняется правило А. Зайцева: «При дегидратации спиртов атом Н отщепляется от соседнего атома С с меньшим содержанием атомов Н».

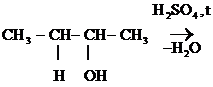 СН3-СН = СН -СН3
СН3-СН = СН -СН3
Бутанол-2
В организме гр. –ОН превращается в легкоуходящую путем образования эфиров с Н3РО4:
|
|
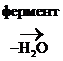 СН3-СН2-ОРО3Н2
СН3-СН2-ОРО3Н2
IV. Р-ции окисления
 1) Первичные и вторичные спирты окисляются СuО, растворами КМnО4, К2Сr2О7 при нагревании с образованием соответствующих карбонилсодержащих соединений:
1) Первичные и вторичные спирты окисляются СuО, растворами КМnО4, К2Сr2О7 при нагревании с образованием соответствующих карбонилсодержащих соединений:


|
|
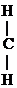 -ОН + О
-ОН + О  СН3-CH2-
СН3-CH2- 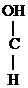 -ОН
-ОН 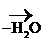 СН3-СН2-
СН3-СН2- 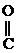 -Н
-Н



|
 - СН3 + О
- СН3 + О  СН3-
СН3- 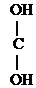 - СН3
- СН3  СН3-
СН3- 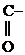 СН3
СН3
Ацетон (кетон)
2) Третичные спирты окисляются с трудом.
К реакциям окисления относятся и р-ции дегидрирования:
|
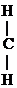 - ОН
- ОН  СН3 -
СН3 - 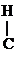 = О + Н2
= О + Н2
Этанол
V. По радикалу (R) протекают р-ции, характерные для соответствующих углеводородов (УВ). В случае предельных – SR, непредельных – АN, ароматических – SЕ:
СН3-СН2-ОН + 3Вr2 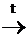 СВr3-СН2-ОН + 3НВr
СВr3-СН2-ОН + 3НВr
Этанол Нарколан
СН2 = СН-СН2-ОН + Вr2 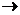 СН2 Вr–СНВr–СН2ОН
СН2 Вr–СНВr–СН2ОН
Аллиловый спирт 2,3-Дибромпропанол

Бензиловый спирт n-Нитрофенилметанол
Многоатомные спирты
Для этих спиртов характерны все р-ции одноатомных спиртов, однако имеется ряд особенностей.
1) За счет – I гр. –ОН многоатомные спирты обладают более выраженными кислотными свойствами. Они образуют алкоголяты не только с щелочными Ме, но и с щелочами:
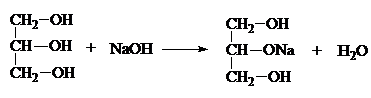
Глицерин
Качественной р-цией на двухатомные и многоатомные спирты (диольный фрагмент) является р-ция с Сu(ОН)2 в щелочной среде:

Глицерин Гликолят меди (II)
|
|
или  К2 К2
| 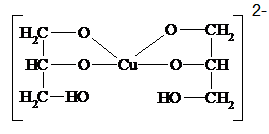
|
Синее окрашивание
Р-ции многоатомных спиртов могут протекать по одной или всем группам –ОН. Они образуют алкоголяты, простые и сложные эфиры, дегидратируются, окисляются.
| 2) | 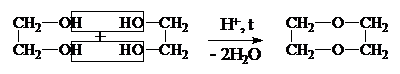
|
Элилен- Диоксан
гликоль (Циклический диэфир)
| 3) | 
|
Нитроглицерин – бесцветная маслянистая жидкость. В виде разбавленных спиртовых растворов (1%) применяется при стенокардии, т.к. оказывает сосудорасширяющее действие. Нитроглицерин – сильное взрывчатое вещество, способное взрываться от удара или при нагревании. При этом в малом объеме, который занимает жидкое вещество, мгновенно образуется очень большой объем газов, что и вызывает сильную взрывную волну. Нитроглицерин входит в состав динамита, пороха.
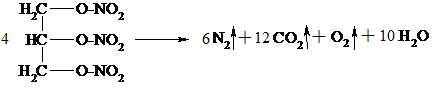
Представители пентитов и гекситов – ксилит и сорбит – соответственно, пяти- и шестиатомные спирты с открытой цепью. Накопление –ОН групп ведет к появлению сладкого вкуса. Ксилит и сорбит – заменители сахара для больных диабетом.
Глицерофосфаты – структурные фрагменты фосфолипидов, применяются как общеукрепляющее средство.
В результате действия Н3РО4 на глицерин получают смесь a- и
b-глицерофосфатов:
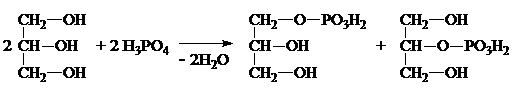
a- b-
Глицерофосфаты
Глицерофосфат железа (III) – при анемии, астении, общем упадке сил. Детям по 0,3 – 0,5 г 2 – 3 раза в день, взрослым по 1 г 3 – 4 раза:
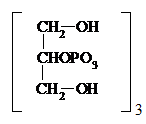
| Fе2+3 × nН2О |
Глицерофосфат кальция – при переутомлении, рахите, упадке питания. Детям по 0,05 – 0,2 г на прием, взрослым 0,2 – 0,5 г.
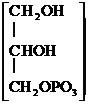 Са × Н2О +
Са × Н2О +  Са × nН2О
Са × nН2О
4) При действии КНSО4 и при нагревании – образуется акролеин:
|
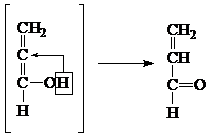
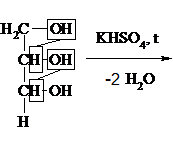
5) При окислении глицерина образуется ряд продуктов. При мягком окислении – глицериновый альдегид (1) и дигидроксиацетон (2):
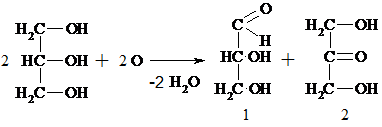
При окислении в жестких условиях образуется 1,3-диоксоацетон.
Химические свойства непредельных спиртов аналогичны предельным, однако за счет двойных или тройных связей они вступают в р-ции присоединения, полимеризации, окисления.
ЛЕКЦИЯ 4
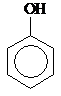
Фенолы
Это производные ароматических УВ, в которых один или несколько атомов Н замещены на –ОН группу.
| 
| 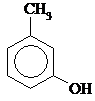
| 
| 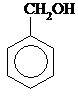
|
 Фенол Фенол
| I-Гидрокси- 2-метилбензол, О-крезол | I-Гидрокси-3-метилбензол, М-крезол | I-Гидрокси-4-метилбензол, n-крезол | Бензиловый спирт |
|
|
Изомеры положения
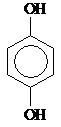
Двухатомные фенолы:
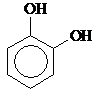
| 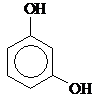
| 
| ||
| Пирокатехин, 1,2-Дигидрокси- бензол | Резорцин, 1,3-Дигидрокси- бензол | Гидрохинон, 1,4-Дигидрокси- бензол | ||
| Изомеры положения |
Трехзамещенные фенолы: рядовой (пирогаллол), симметричный и несимметричный. 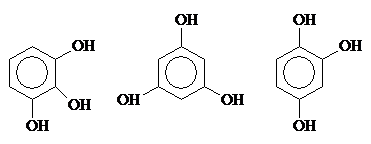
Пирогаллол
Каждый фенол дает свое характерное окрашивание в качественной реакции с FеС13:
Фенол ® Фиолетовое, Гидрохинон ® Грязно-зеленое,
Пирокатехин ® Зеленое, Пирогаллол ® Красное.
Резорцин ® Фиолетовое,
 Строение молекулы
Строение молекулы
|

....
|
|
–ОН группа проявляет + М >, чем –I, являясь ЭД.
Р-ции SЕ протекают легко за счет +М гр. –ОН, р-ции SN не характерны.
Химические свойства
I. Реакции замещения Н в группе –ОН
Это проявляется при образовании фенолятов, простых и сложных эфиров.
1) Фенолы за счет р, p-сопряжения являются более сильными к-тами, чем спирты и образуют соли (феноляты) в р-циях с Ме, МеОН и даже солями:
С6Н5ОН + NаОН ® С6Н5ОNа + Н2О
Фенолят натрия,
феноксид натрия
Однако фенолы более слабые к-ты, чем Н2СО3, поэтому при действии Н2СО3 (СО2 + Н2О) и др. к-т феноляты легко разлагаются и обратная р-ция не возможна.
С6Н5ОNа + СО2 + Н2О ® С6Н5ОН + NаНСО3
3С6Н5ОН + FеС13 ® (С6Н5О)3Fе¯ + 3НС1
Фиолетовое окрашивание
| 2) |  Простой эфир
Простой эфир
|
На практике используют феноляты.
| 3) |
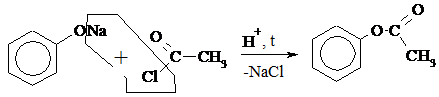
| ||
4) Р-ция восстановления с цинковой пылью при нагревании:
С6Н5ОН + 3Н2 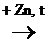 С6Н12 + ZnО
С6Н12 + ZnО
Р-ции по –ОН группе не характерны!
II. Р-ции по бензольному кольцу (SЕ)
–ОН группа – ориентант I рода, облегчает р-ции по бензольному кольцу, направляя атаку электрофильного реагента преимущественно в орто- и пара- положения:
|

Пикриновая к-та близка по силе (степени диссоциации) к соляной к-те, т.к. содержит три ЭА группы, усиливающие кислотность.
Механизм р-ции бромирования:
| а) |  
|
1) Поляризация 2) p-комплекс
| б) |  3) s-комплекс 3) s-комплекс
|
4. Р-ция конденсации


Фрагмент
фенолоформальдегидной
смолы
5. Р-ция гидрирования
6. Из фенолята натрия легко получается салициловая к-та (важный продукт фармацевтической промышленности):
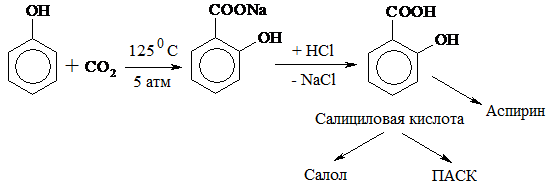
Фенол и его производные обладают дезинфицирующим свойством. Резорцин – антисептик при кожных заболеваниях. Карболовая к-та – 3%-ный раствор фенола – для дезинфекции хирургических инструментов. Пирокатехин применяется для синтеза адреналина – гормона надпочечников. В промышленности фенол используют для получения фенолоформальдегидных смол и ряда красителей.
Увеличение групп –ОН в фенолах увеличивает их активность в р-циях SЕ. Такие фенолы очень легко окисляются, являясь хорошими восстановителями (гидрохинон в фотографии). Двухатомные фенолы легко окисляются под действием слабых окислителей [FеС13, Аg2О, Сu(ОН)2] и даже кислородом воздуха, образуя хиноны. Последние легко восстанавливаются в дигидрохиноны:
|
|
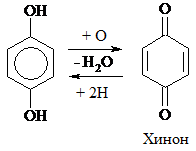
Многие биологические вещества содержат «хиноидную» систему: витамин К2 (фактор свертываемости крови), окислительно-восстановительные ферменты тканевого дыхания – убихиноны.
Тиоспирты и тиоэфиры
Их можно рассматривать как производные Н2S, где один или оба атома Н замещены на радикал:
R – SH R – S – R
Тиол Тиоэфир
Тиолы имеют неприятный запах. Получают действием гидросульфида на галогеналканы:
NaHS + R – I ® R – SH + NaI
СН3SH, СН3 – СН2 – SH
Метантиол, Этантиол (МН),
метилмеркаптан этилмеркаптан (РН)
Пропантиол содержится в луке.
Поляризуемость атома S >, чем атома О, т.к. радиус атом S >, чем атома О, однако ЭО атома S >, чем атома О. Связь S – H менее полярна, чем О – Н, поэтому поэтому Н притягивается слабее к атому S, следовательно, тиолы более сильные к-ты, чем спирты (в 3 – 4 раза).
Химические св-ва
1. Тиолы диссоциируют:
RS – H Û RS- + H+, рК 11
2. Тиолы взаимодействуют с щелочами и солями тяжелых Ме:
RS – H + NaOH ® RS – Na + H2O
Алкилтиолят
натрия,
меркаптид натрия
С солями ртути (II) образуются нерастворимые соли. На этом основано применение тиолов при отравлении солями Нg, As, Bi, Cr, Pb, Zn, Cd и др.


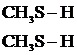 + НgС12 ®
+ НgС12 ®  Нg¯ + 2НС1
Нg¯ + 2НС1
Лекарственный препарат БАЛ (британский антилюизит) – дитиоглицерин, или 2,3-димеркаптопропанол.
Унитиол – 2,3-димеркаптопропансульфонат натрия – в виде 5%-ного раствора с рН ~ 3-5 широко применяется в медицине при отравлении солями тяжелых Ме. Группы – SH вступают в р-цию с ядами в крови тканях, образуя нетоксичные комплексы и выводятся с мочой. Унитиол < токсичен, чем БАЛ.
|

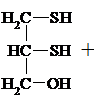
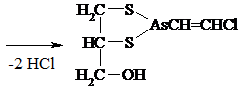

3. Подобно спиртам тиолы образуют простые и сложные эфиры, однако, как правило, не с к-той, а с ее производными:
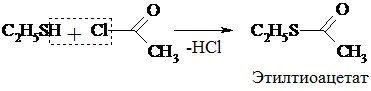
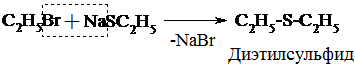
4. Окисление тиолов отличается от окисления спиртов. Тиолы легко окисляются и в мягких условиях образуют дисульфиды:
2R – SH 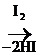 R–S–S–R
R–S–S–R
Роль в организме
Многие ОВ реакции в организме основаны на р-ции тиол Û дисульфид.
1) Образование –SH и –S–S– связей определяет структуру белков.
2) Превращение цистеина в цистин:
2 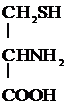
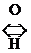
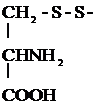
 + Н2О
+ Н2О
Трипептид глютатион (g-глютамилцистеинилглицин) входит в состав активного центра ОВ ферментов и содержит цистеин.
3) Прямые и кудрявые волосы – основа завивки – результат содержания и превращения цистеина в цистин.
4) Лекарственный препарат тетурам, применяемый при лечении алкоголизма, содержит дисульфидную группу. Действие тетурама основано на его способности задерживать окисление этанола на уровне ацетальдегида (видимо, блокируя фермент ацетальдегидоксидазу). Последний, накапливаясь в организме, вызывает крайне неприятные ощущения (появляется покраснение, жар, затруднение дыхания, шум в голове, серцебиение, чувство страха, понижается артериальное давление).
5) При жестком окислении тиолов образуются сульфокислоты, а из них при действии щелочей – алкилсульфонаты:
R – SH + 3O 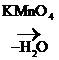 R – SO3H
R – SO3H 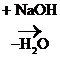 R – SO3Na
R – SO3Na
Сульфокислоты – сильные кислоты, рК ~ 1.
Если R = высший алкил, то это – синтетические моющие средства.
Ароматические сульфок-ты – основа для синтеза лекарственных сульфаниламидных препаратов.
При окислении сульфидов образуются сульфоксиды:
|
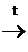 СН3–
СН3– 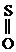 –СН3
–СН3
Диметилсульфоксид (ДМСО)
ДМСО – сильнейший растворитель, ускоритель проникновения через кожу лекарственных соединений.
Липоевая к-та – природный дисульфид, который вместе с коферментом А (кофермент ацилирования) является важной частью ферментов при окислении предельных высших карбоновых к-т до уксусной к-ты.
Амины
Это производные аммиака NH3, где один, два или три атома Н замещены на радикал R (алифатический или ароматический).
В зависимости от числа атомов Н, замещенных на R, различают первичные, вторичные и третичные амины. NH2 – аминогруппа, –NH – иминогруппа.
Номенклатура
Рациональная – название радикала (R) + «амин»:
СН3 – СН2– СН2– NН2 СН3 – NН– СН3
Пропиламин Диметиламин
МН рассматривает гр. –NH2 как заместитель в первичных аминах и ее название ставят в приставке перед названием основной цепи (корня):
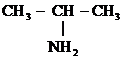
2-Аминопропан
Изомерия
Для первичных аминов – изомерия углерод-углеродной цепи (3, 4) и положения гр. – NH2 (1, 2); для вторичных и третичных аминов – изомерия радикала (5, 6) – метамерия:
1) СН3 – СН2– СН2– NН2
Пропиламин
2) 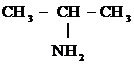
Изопропиламин
3) СН3 – СН2– СН2– СН2– NН2
Бутиламин
4) 
Изобутиламин
5) СН3 – СН2– СН2–NН–СН3
Метилпропиламин
6) СН3 – СН2–NН – СН2–СН3
Диэтиламин
Физические св-ва
Метиламин, диметиламин, триметиламин – газы, хорошо растворимые в воде; средние члены гомологического ряда аминов – жидкости, высшие – твердые вещ-ва.
Амины в заметных количествах образуются при гниении органических остатков, содержащих белки. Ряд аминов образуется в организме человека и животных из a-аминокислот под действием ферментов. Такие амины принято называть биогенными аминами.
Связи N – H, C – N полярны, однако полярность NH связи больше, чем CN согласно различной ЭО атомов N, С, Н. Поэтому первичные и вторичные амины, подобно спиртам, склонны к образованию Н-связей.
Строение молекулы амина
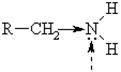
Нуклеофильный и оснóвный центры
В связи с меньшей полярностью связи С – N (0,45 D) по сравнению с полярностью N – Н (1,3 D) для аминов не характерны р-ции замещения гр. NН2 – и кислотные св-ва.
Важнейшее св-во аминов связано с наличием свободной электронной пары у атома N и его способностью присоединять «+» частицы. С этим связано проявление аминами свойств оснований, т.е. присоединять Н+ от воды и кислот, а также вступать в р-ции алкилирования, ацилирования, выполняя при этом роль Nu.
Химические св-ва
I. Оснóвные св-ва
Амины более сильные основания, чем NH3. Это объясняется + I эффектом радикалов. Чем больше электронная плотность на атоме N, тем больше основность. Вторичные амины более сильные основания, чем первичные. Основность третичных аминов уменьшается, что объясняется экранирующим влиянием атома N тремя алкильными группами.
Поскольку ЭО атома N меньше ЭО атома О, амины образуют менее прочные ассоциаты, чем соответствующие спирты и имеют более низкие температуры кипения. Температура кипения этанола 78 оС, а этиламина – 17 оС.
При растворении в воде к аминам присоединяется Н+ от молекулы НОН, поэтому растворы аминов имеют щелочную р-цию:
СН3 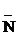 H2 + HOH ® [СН3
H2 + HOH ® [СН3 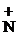 H3]OH-
H3]OH-
Гидроксидметиламмония
При действии к-т образуются соли:
СН3 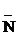 H2 + HС1 ® [СН3
H2 + HС1 ® [СН3 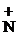 H3]Сl-
H3]Сl-
Хлоридметиламмония
Щелочи разлагают соли аминов и выделяют свободные амины:
[СН3 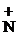 H3]Сl- + NaOH ® NaCl + CH3NH2 + H2O
H3]Сl- + NaOH ® NaCl + CH3NH2 + H2O
Особенно сильные оснóвные св-ва у чертвертичных аммониевых оснований, которые по силе соответствуют щелочам:
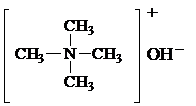
Оснóвные св-ва ароматических аминов ослаблены за счет р,p-сопряжения NH2 – группы с бензольным кольцом. Поэтому анилин образует соли только с сильными минеральными к-тами. Водный р-р анилина не изменяет окраску индикаторов.
II. Р-ции алкилирования и ацилирования
В этом случае амины проявляют нуклеофильные св-ва за счет электронной пары атома азота.
1)
|
|
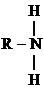 : ××××××××>
: ××××××××> 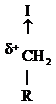 ®
® 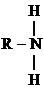 : ×××
: ××× 
 R – NH – CH2R
R – NH – CH2R
Аналогично идет образование третичных и четвертичных аминов.
2)
|
|
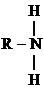 : ××××××××> d+
: ××××××××> d+ 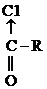 ®
® 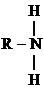 : ×××
: ××× 
 R – NH –
R – NH – 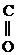 – R
– R
Подобным образом алкилируется и ацилируется С6Н5NH2.
III. Р-ция с альдегидом
R – NH2 + O = 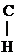 – R
– R  R – N =
R – N = 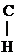 – R
– R
|
IV. Качественные р-ции на амины (р-ция с HNO2)
1)
|
 [R – N= N – OH]
[R – N= N – OH] 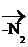 ROH
ROH
2)  + HONO
+ HONO 
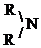 -NO¯
-NO¯
Желтый
Нитрозоамины
Нитрозоамины являются канцерогенными веществами. Нитраты в организме восстанавливаются до нитритов.
3) R3N: + НNO2 ® [R3NH]+NO2-
Соль
При действии HNO2 на соли анилина образуется не фенол, а соли диазония (широко используемые в химии красителей), которые при нагревании выделяют азот N2 с образованием фенола:
[С6Н5 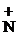 H3]Cl- + HONO ® [С6Н5
H3]Cl- + HONO ® [С6Н5 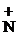 ºN]Cl- + 2Н2О
ºN]Cl- + 2Н2О
Соль диазония
[С6Н5 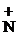 ºN]Cl- + 2Н2О
ºN]Cl- + 2Н2О 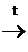 N2 + HCl + С6Н5OH
N2 + HCl + С6Н5OH
V. Р-ции по радикалу

Сульфаниловая к-та – важный продукт в синтезе лекарственных веществ (сульфаниламидных препаратов) и красителей.
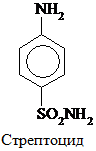 Наибольшую активность имеют производные сульфаниламидов, в которых атом Н в группе – SO2NH2 замещен на гетероцикл. Например, сульфадиметоксин:
Наибольшую активность имеют производные сульфаниламидов, в которых атом Н в группе – SO2NH2 замещен на гетероцикл. Например, сульфадиметоксин:

Сульфаниламиды, являясь антиметаболитами n-аминобензойной к-ты (ПАБК), блокируют биосинтез фолиевой к-ты (витамин Вс), необходимой для нормального развития и размножения микроорганизмов. Сульфаниламиды имеют сходные геометрические параметры с ПАБК, что позволяет им встраиваться вместо последней в синтез фолиевой к-ты.
ЛЕКЦИЯ 5
Альдегиды и кетоны
Многие биологически активные соединения (белки, углеводы, гормоны и пр.) содержат в своем составе >С=О – карбонильную группу.
Органические соединения, в молекулах которых имеется карбонильная группа, наз-ся карбонильными, или оксосоединениями. Такие соединения делятся, на альдегиды  и кетоны
и кетоны 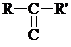 .
.
Общая формула алифатических альдегидов и кетонов СnH2nO. Альдегиды и кетоны с одинаковым числом атомов С можно рассматривать как метамеры (изомеры) – соединения, содержащие одну и ту же функциональную группу, но имеющие различное строение. Например, С3Н6О
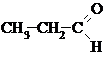
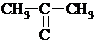
Пропаналь Пропанон-2
Р-ции альдегидов и кетонов весьма схожи, что позволяет рассматривать их вместе.
Номенклатура
Альдегиды
1) Тривальная номенклатура использует название к-т, образующихся при окислении альдегидов, + слово «альдегид»;
2) МН использует окончание – АЛЬ
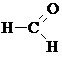
| Муравьиный альдегид, метанАЛЬ, формальдегид |

| Уксусный альдегид, этанАЛЬ, ацетальдегид |
Кетоны
1) Рациональная номенклатура – название радикалов + слово «кетон»;
2) МН использует окончание –ОН с цифрой, указывающей местонахождение кетогруппы
СН3–СН2  СН3 Метилэтилкетон, бутанон-2
СН3 Метилэтилкетон, бутанон-2
Тривиальная номенклатура используется редко.
Изомерия
Для альдегидов характерна изомерия цепи, для кетонов – цепи и положения карбонильной группы.
Физические св-ва
Низшие альдегиды имеют резкий запах, растворимы в воде, высшие альдегиды имеют приятный запах (парфюмерия), не растворимы в воде, но растворимы в органических растворителях.
Строение
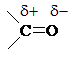
Двойная связь 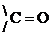 поляризована вследствии различной ЭО атомов С и О и смещена к О. Поэтому атом С карбонильной группы всегда имеет избыточный d+ заряд, а О – d-:
поляризована вследствии различной ЭО атомов С и О и смещена к О. Поэтому атом С карбонильной группы всегда имеет избыточный d+ заряд, а О – d-:

Характерными р-циями для карбонильных соединений являются р-ции нуклеофильного присоединения АN. При этом, чем больше величина d+ на атоме С группы 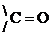 , тем выше реакционная способность соединения в реакциях АN. В кетонах d+ заряд меньше (за счет +I), чем в альдегидах, следовательно, альдегиды более реакционноспособны.
, тем выше реакционная способность соединения в реакциях АN. В кетонах d+ заряд меньше (за счет +I), чем в альдегидах, следовательно, альдегиды более реакционноспособны.
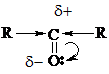
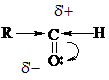
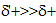
(Для увеличения d+ заряда р-ции часто проводят в слабокислой среде).
Смещение p-электронной плотности в группе 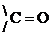 вызывает, в свою очередь, смещение электронной плотности у соседних С – С связей, что увеличивает подвижность и реакционную способность атомов Н в a-положении атома С.
вызывает, в свою очередь, смещение электронной плотности у соседних С – С связей, что увеличивает подвижность и реакционную способность атомов Н в a-положении атома С.
Химические свойства
Типы химических р-ций для альдегидов и кетонов:
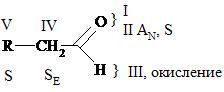
I. Р-ции АN [НОН (кроме кетонов), Н2, ROH, НСN, NaHSO3, Li[A1H4], НX].
II. Р-ции S(AN+E) 2ROH, H2N-X, PC15.
III. Р-ции окисления [Ag2O, Cu(OH)2] (Правило Попова – для кетонов).
IV. Р-ции по радикалу (р-ции с участием атома Н в a-положении, р-ц
|
|
|

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Опора деревянной одностоечной и способы укрепление угловых опор: Опоры ВЛ - конструкции, предназначенные для поддерживания проводов на необходимой высоте над землей, водой...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!