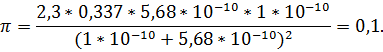16. Вычислить рН 5%-ного раствора муравьиной кислоты.
17. Вычислить рН 0,001 %-ного раствора аммиака.
18. В 100 мл раствора содержится 3,7 г муравьиной кислоты. Вычислить концентрацию формиат-иона.
19. Вычислить концентрацию ацетат-иока в растворе, в 100 мл которого содержится 0,7 г уксусной кислоты.
20. В 1 л чистой воды растворен аммиак, полученный из 1 г сульфата аммония. Вычислить рН этого раствора.
21. Вычислить рН раствору, если 3%-ный раствор аммиака разбавить в 2375 раз.
22. Вычислить концентрации Н+ и ОН- ионов в растворе с рН = 9,48.
23. Вычислить концентрации Н+ и ОН - ионов в растворе с рН=8,01. _
24. Вычислить концентрации Н+ и ОН- ионов в растворе с рН = 0,3.
25. Уксусная кислота в 0,76%-ном растворе диссоциирована на 1,17%. Вычислить константу диссоциации.
26. Дихлоруксусная кислота в 4,9%-ном растворе диссоциирована на 30,2%. Вычислить константу диссоциации.
27. В 1,42%-ном растворе гидроксиламина степень диссоциации равна 0,0143%. Вычислить константу диссоциации.
28. Аммиак в 0,5 М растворе диссоциирован на 0,59%. Вычислить константу диссоциации.
29. В 0,206 М растворе уксусной кислоты рН = = 2,72. Вычислить константу диссоциации-
30. Азотистая кислота в 0,9%-ном растворе имеет рН = 1,95. Вычислить константу диссоциации.
31. Оксохлорат (I) водорода в 3,40 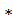 10-2 М растворе имеет рН = 4,5. Вычислить константу диссоциации.
10-2 М растворе имеет рН = 4,5. Вычислить константу диссоциации.
32. При какой концентрации уксусная кислота диссоциирована на 50%?
33. Вычислить степень диссоциации трихлоруксусной кислоты в 0,1% -ном растворе.
34. Вычислить степень диссоциации муравьиной кислоты в 0,1%-ном растворе.
35. Вычислить степень диссоциации циановодородной кислоты в 0,1%-ном растворе.
36. Константа диссоциации вещества КА = 1  10-4. При какой концентрации степень диссоциации достигает 5%?
10-4. При какой концентрации степень диссоциации достигает 5%?
37. Вычислить константу диссоциации вещества, если В 1  10-4 растворе степень диссоциации равна 10%.
10-4 растворе степень диссоциации равна 10%.
38. Какой величине должна быть равна константа диссоциации, чтобы при концентрации 4  10-2 М степень диссоциации достигла 1%?
10-2 М степень диссоциации достигла 1%?
39. Вычислить концентрацию ацетат-иона в 0,1%-ном растворе уксусной кислоты.
40. Вычислить концентрацию водородных ионов в 0,1 М растворе H2S.
Буферные растворы
Растворы слабых кислот или оснований в присутствии их солей проявляют буферное действие: рН таких растворов мало изменяется при разбавлении и добавлении к ним небольших количеств сильной кислоты или щелочи.
Для вычисления концентрации водородных ионов в буферных растворах применимы уравнения (1.29) и (1.30)
 ; (1.29)
; (1.29)
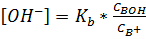 , (1.30)
, (1.30)
рН буферного раствора, содержащего слабую кислоту и ее соль, будет равен
 . (1.31)
. (1.31)
Для рН буферной смеси, состоящей из слабого основания и его соли, имеем следующее выражение:
 (1.32)
(1.32)
Если буферная смесь состоит из средней соли (М2А) и кислой соли (МНА) двухосновной кислоты, то
 , (1.33)
, (1.33)
где  и
и  —концентрации солей М2А и МНА,
—концентрации солей М2А и МНА,  —показатель константы диссоциации кислоты Н2О по второй ступени.
—показатель константы диссоциации кислоты Н2О по второй ступени.
Если буферная смесь образована кислыми солями (М2НА, МН2А) трехосновной кислоты, то для расчета рН применимо уравнение
 . (1.34)
. (1.34)
Буферное действие характеризуется буферной емкостью ( ). Буферная емкость измеряется количеством сильного основания (𝑏) или кислоты (
). Буферная емкость измеряется количеством сильного основания (𝑏) или кислоты ( ), которое необходимо добавить к данному раствору, чтобы изменить рН на единицу.
), которое необходимо добавить к данному раствору, чтобы изменить рН на единицу.
 , (1.35)
, (1.35)
 . (1.36)
. (1.36)
В области максимального буферного действия буферная емкость раствора, содержащего слабую кислоту (НА) и ее соль (МА), выражается уравнением
 , (1.37)
, (1.37)
СА - общая концентрация раствора (СА = [НА] + [А -]). Максимальное значение буферная емкость при данной концентрации СА имеет при [Н+] = 
 . (1.38)
. (1.38)
Достаточное буферное действие проявляется в интервале
pH = p  ±1. (1.39)
±1. (1.39)
При определении буферной емкости раствора, состоящего из слабого основания и его соли, в формулу (1.37) вместо  вводится константа сопряженной кислоты
вводится константа сопряженной кислоты  .
.
Пример 11. К 15 мл 0,03 М раствора муравьиной кислоты прибавлено 12 мл 0,15 М раствора формиата калия. Вычислить рН этой смеси.
Решение. Найдем концентрацию кислоты и ее аниона после смешения двух растворов
СА- =  = 0,066 М,
= 0,066 М,
СНА =  = 0,017 М.
= 0,017 М.
Подставляя эти значения в уравнение (1.29), найдем
 М,
М,
рН = 5 - 
Эту задачу можно решить более просто, если концентрацию кислоты и соли выразить в миллимолях (мМ), учитывая, что объем раствора после разбавления входит в числитель и знаменатель данного выраженя.
рН = р  + lg
+ lg  ;
;
СА- = 12*0,15 мМ; СНА= 15*0,03 мМ;
Подставляя эти значения в выражения для рН, получим
рН = 3,75 + lg  = 3,75 + lg 4 = 4,35.
= 3,75 + lg 4 = 4,35.
Пример 12. Смешано 10 мл 0,3 М раствора НСl и 20 мл 0,2 М раствора аммиака. Определить рН полученного раствора.
Решение. В данном примере буферная смесь образовалась в результате реакции

Концентрация соли NH4Cl (Св+) равна взятой концентрации НСl с учетом разбавления раствора

Концентрацию NH3 (СBOH) находим по разности между начальной концентрацией CNH (с учетом разбавления) и концентрацией НСl
 .
.
Подставляя эти значения в уравнение (1.30), найдем [OH-]
 ,
,
рН = 14 – 6 +  = 8,72.
= 8,72.
Если выразить концентрацию НСl и NH3 в мМ, то решение можно провести следующим образом:
СB+ = 10 * 0,3 = 3 мМ; Свон =20 * 0,2 – 10 * 0,3 = 1 мМ.
рН = 14 - 4,75 + lg  = 9,25 + lg0,3 = 8,72.
= 9,25 + lg0,3 = 8,72.
Пример 13. К 20 мл 0,2 М раствора гидрофосфата калия добавлено 10 мл 0,25 М раствора HCl. Определить рН полученного раствора.
Решение. При смешении данных растворов происходит следующая реакция:
К2НР04 + HCl = КН2Р04 + KCl.
В результате образовалась буферная смесь, состоящая из КН2Р04 и К2НР04. Концентрации анионов Н2Р  и НР
и НР  равны
равны
[Н2Р  ] = 10 * 0,25 = 2,5 мМ;
] = 10 * 0,25 = 2,5 мМ;
[HP  ] = 20 * 0,2 -10 * 0,25 = 1,5 мМ.
] = 20 * 0,2 -10 * 0,25 = 1,5 мМ.
Используя уравнение (1.34), находим рН
рН = 7,21 + lg  = 7,21 +
= 7,21 + 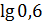 = 6,99.
= 6,99.
Пример 14. Сколько г ацетата натрия надо добавить к 200 мл 0,2 М раствора НСl, чтобы рН = 4,5?
Решение. Напишем уравнение реакции
CH3COONa + НСl = СН3СООН + NaCl.
В результате данной реакции образовалась уксусная кислота, концентрация которой равна концентрации HCl (СНА = 0,2). Равновесная концентрация анионов CH3СОО- определяется по разности между начальной концентрацией соли (х) и концентрацией HCl

Подставляем данные значения в уравнение (1.31) и находим х
 ,
,
4,5 = 4,76 + lg  ,
,
-0,26 = lg 
 lg
lg  ,
,
0,5495* 0,2 = х - 0,2,
х= 0,5495 * 0,2 + 0,2 = 0,1099 + 0,2 = 0,3099 М.
Количество CH3COONa в г на 200 мл (В) равно
B  г.
г.
Пример 15. Вычислить буферную емкость раствора, состоящего из 1,140 М СН3СООН и 0,205 М CH3COONa, рН=4.
Решение. Находим общую концентрацию компонентов
СА = 1,140 + 0,205 = 1,345 М.
Подставив в формулу (1.37), получим
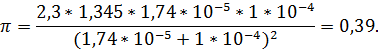
Пример 16. Буферный раствор, приготовленный из раствора аммиака и хлорида аммония, имеет рН = 10. Вычислить буферную емкость этого раствора, если общая концентрация СА = 0,336 М.
Решение. Константа диссоциации сопряженной кислоты согласно реакции
 + H20
+ H20 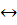
 + ОН-
+ ОН-
равна

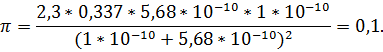
Задачи



 10-2 М растворе имеет рН = 4,5. Вычислить константу диссоциации.
10-2 М растворе имеет рН = 4,5. Вычислить константу диссоциации. 10-4. При какой концентрации степень диссоциации достигает 5%?
10-4. При какой концентрации степень диссоциации достигает 5%? ; (1.29)
; (1.29)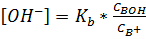 , (1.30)
, (1.30) . (1.31)
. (1.31) (1.32)
(1.32) , (1.33)
, (1.33) и
и  —концентрации солей М2А и МНА,
—концентрации солей М2А и МНА,  —показатель константы диссоциации кислоты Н2О по второй ступени.
—показатель константы диссоциации кислоты Н2О по второй ступени. . (1.34)
. (1.34) ). Буферная емкость измеряется количеством сильного основания (𝑏) или кислоты (
). Буферная емкость измеряется количеством сильного основания (𝑏) или кислоты ( ), которое необходимо добавить к данному раствору, чтобы изменить рН на единицу.
), которое необходимо добавить к данному раствору, чтобы изменить рН на единицу. , (1.35)
, (1.35) . (1.36)
. (1.36) , (1.37)
, (1.37)
 . (1.38)
. (1.38) .
. = 0,066 М,
= 0,066 М, = 0,017 М.
= 0,017 М. М,
М,
 ;
; = 3,75 + lg 4 = 4,35.
= 3,75 + lg 4 = 4,35.

 .
. ,
, = 8,72.
= 8,72. = 9,25 + lg0,3 = 8,72.
= 9,25 + lg0,3 = 8,72. и НР
и НР  равны
равны ] = 10 * 0,25 = 2,5 мМ;
] = 10 * 0,25 = 2,5 мМ; = 7,21 +
= 7,21 +  = 6,99.
= 6,99.
 ,
, lg
lg  г.
г.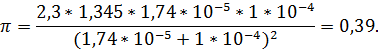
 + H20
+ H20 
 + ОН-
+ ОН-