Что такое критерий гидродинамического подобия Эйлера Eu? Расшифровать входящие в критерий Эйлера символы и пояснить физический смысл критерия.
Ответ: Гидродинамическое подобие описывает течение 2-х подобных моделей (индексы 1 и 2) и описывается выражением:
 .
.
Произведем сопоставление 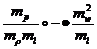 ; разделим на
; разделим на  и учтем, что
и учтем, что  ,
,  и
и  .
.
Тогда получим что  или
или  . Критерий (число) гидродинамического подобия Эйлера Eu=
. Критерий (число) гидродинамического подобия Эйлера Eu=  , где pi – давление i-той системы,
, где pi – давление i-той системы,  - скорость течения i-той системы,
- скорость течения i-той системы,  - плотность жидкости в i-той системе. Физический смысл критерия ясен из процедуры сопоставления – сопоставление сил инерции и давления. В технологических процессах чаще используется не конкретное давление p, а перепад давлений
- плотность жидкости в i-той системе. Физический смысл критерия ясен из процедуры сопоставления – сопоставление сил инерции и давления. В технологических процессах чаще используется не конкретное давление p, а перепад давлений  . Тогда выражение для критерия Эйлера принимает следующее выражение Eu=
. Тогда выражение для критерия Эйлера принимает следующее выражение Eu=  .
.
 9. Под действием каких сил одиночная сферическая частица (плотность ρт) находится неподвижно в восходящем потоке (плотность ρ)? Назовите эти силы и укажите направления их действия относительно выбранной системы координат.
9. Под действием каких сил одиночная сферическая частица (плотность ρт) находится неподвижно в восходящем потоке (плотность ρ)? Назовите эти силы и укажите направления их действия относительно выбранной системы координат.
Ответ: Чтобы частица находилась неподвижно в восходящем потоке, необходимо равенство действующих на нее сил: веса частицы Рч, выталкивающей (архимедовой силы) Ра, и воздействия потока среды Рп. При ρт>ρ:
Рч=Ра+Рп
10. Приведите формулу для расчета расхода жидкости при истечении из отверстия в дне сосуда при постоянном уровне (H = const). В чем состоит физический смысл коэффициента Кр? (коэффициент расхода).
Ответ: Рассмотрим истечение жидкости из закрытого сосуда в стационарных условиях – при поддержании постоянным в ходе процесса давлений над свободной поверхностью (р0) и с в среде, куда происходит истечение (р`), z1 а также уровня жидкости в сосуде (h). Вы берем горизонтальную плоскость отсчета 0-0 и запишем уравнение Бернулли для сечений со свободной поверхностью жидкости (на расстоянии z2 от этой плоскости).
 , где W1 и W – скорости жидкости в сечениях F и fc,
, где W1 и W – скорости жидкости в сечениях F и fc, 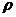 - плотность жидкости,
- плотность жидкости,  - потерянный напор.
- потерянный напор.
 , где
, где 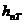 - потери напора от трения,
- потери напора от трения,  - потери напора от местного сопротивления (отверстия). Пренебрежем
- потери напора от местного сопротивления (отверстия). Пренебрежем 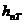 - мала. Тогда
- мала. Тогда  , где
, где  - коэффициент местного сопротивления при протекании жидкости через отверстие.
- коэффициент местного сопротивления при протекании жидкости через отверстие.  ;
;  . Т.к.
. Т.к. 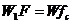 , то
, то  .
.  . Пренебрежем
. Пренебрежем  , т.к. она мала в сравнении с 1 и с
, т.к. она мала в сравнении с 1 и с  .
.  , тогда
, тогда  . Введем приведенную высоту
. Введем приведенную высоту 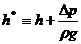 .
.  - коэффициент скорости.
- коэффициент скорости.  . Расход жидкости
. Расход жидкости  ,
,  , где
, где  - коэффициент сжатия струи;
- коэффициент сжатия струи;  .
. 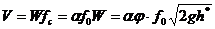 .
.  - коэффициент расхода.
- коэффициент расхода.

 Физический смысл Kp – это коэффициент, который учитывает влияние толщины стенок и состояния кромок отверстия сосуда (коэффициент сжатия
Физический смысл Kp – это коэффициент, который учитывает влияние толщины стенок и состояния кромок отверстия сосуда (коэффициент сжатия  ); форму отверстия и его расположение относительно сосуда (коэффициент сжатия струи
); форму отверстия и его расположение относительно сосуда (коэффициент сжатия струи  ) на истечение.
) на истечение.
Дайте определение процесса абсорбции. Каким образом изменение условий проведения процесса физической абсорбции в аппаратах (температура абсорбента, рабочее давление) будет влиять на эффективность абсорбции?
 Ответ: Абсорбцией называют процесс избирательного извлечения одного или нескольких компонентов из газовой смеси жидким поглотителем (абсорбентом). Обратный процесс-выделение из абсорбента растворенных в нем газов (паров) носит название десорбции. При отсутствии химического взаимодействия между поглощаемым компонентом и абсорбенто процесс называется физической абсорбцией.
Ответ: Абсорбцией называют процесс избирательного извлечения одного или нескольких компонентов из газовой смеси жидким поглотителем (абсорбентом). Обратный процесс-выделение из абсорбента растворенных в нем газов (паров) носит название десорбции. При отсутствии химического взаимодействия между поглощаемым компонентом и абсорбенто процесс называется физической абсорбцией.
Кривая 3 характеризует равновесные концентрации в фазах при некоторой постоянной температуре t (изотерма абсорбции). Если температуру системы t изменить до t1, то прежней концентрации компонета х будет соответствовать новое значение у1, виличине х’ – значение у’ и т.д При этом с увеличением температуры растворимость поглощаемого компонента в жидкости понижается. Этим объясняется проведение процесса адсорбции при пониженной температуре – в таких условиях адсорбент обладает большей поглотительной способностью, а значит его расход меньше при прочих равных условиях.

При неизменной концентрации ПК в газовой фазе его растворимость в жидкости с повышением давления увеличивается, поэтому абсорбцию выгодно проводить при повышенном
Какое минимальное количество колонн необходимо использовать при разделении трехкомпонентных зеотропных смесей непрерывной ректификацией для получения чистых компонентов? Представьте возможные схемы разделения и поясните их преимущества и недостатки.
Ответ: Непрерывная ректификация многокомпонентных смесей осуществляется в установках, состоящих из ряда ректификационных колонн непрерывного действия, соединение которых в общую схему может быть различным. Каждая из колонн разделяет поступающую на нее смесь на два продукта – дистиллят и кубовый остаток. Поэтому при наличии трех компонентов в смеси разделение их в одной колонне невозможно. В этом случае нужны две колонны, причем их работа может быть организована в двух вариантах:
- Кубовый остаток – бинарная смесь.
 Смесь из трех компонентов А, В, С разделяется в первой колонне на дистиллят (компонент А требуемой чистоты) и кубовый остаток, состоящий преимущественно из компонентов В и С. Эту бинарную смесь разделяют во второй колонне на В (дистиллят) и С (кубовая жидкость). Кипящая кубовая жидкость из первой колонны во вторую подается насосом.
Смесь из трех компонентов А, В, С разделяется в первой колонне на дистиллят (компонент А требуемой чистоты) и кубовый остаток, состоящий преимущественно из компонентов В и С. Эту бинарную смесь разделяют во второй колонне на В (дистиллят) и С (кубовая жидкость). Кипящая кубовая жидкость из первой колонны во вторую подается насосом.
- Дистиллят – бинарная смесь.
 Дистиллятом первой колонны является концентрированная смесь двух компонентов (А и В), а кубовый остаток содержит преимущественно компонент С. Бинарная смесь А+В самотеком направляется во вторую колонну, где разделяется на А и В.
Дистиллятом первой колонны является концентрированная смесь двух компонентов (А и В), а кубовый остаток содержит преимущественно компонент С. Бинарная смесь А+В самотеком направляется во вторую колонну, где разделяется на А и В.
Отсутствие насоса для перекачивания кипящей жидкости как будто делает вариант (2) более привлекательным, чем (1). Однако (2) характеризуется повышенным расходом флегмы по сравнению с (1), где расход флегмы определяется возвратом на орошение лишь одного компонента А. Поэтому для варианта (2) характерны более высокие расходы теплоносителей и увеличенные теплообменные поверхности кипятильника и конденсатора. Оценки показывают, что вариант (2) по энергетическим затратам становится равноценным (1), если конденсатор первой колонны по схеме (2) использовать в качестве дефлегматора.
26. При проведении процесса разделения смесей жидкостной экстракцией наибольшую эффективность достигают:
а) однократной экстракцией,
б) порционной (перекрестной) экстракцией,
в) противоточной непрерывной экстракцией,
г) прямоточной непрерывной экстракцией.
В чем состоят преимущества проведения процесса выпаривания в прямоточной многокорпусной выпарной установке по сравнению с использованием однокорпусной установки? Составьте тепловой баланс для однокорпусной выпарной установки.
Ответ: Преимущества использования прямоточной многокорпусной выпарной установки по сравнению с однокорпусной установкой таковы:
1) С энергетической точки зрения удаётся использовать теплоту вторичного пара, полученного в предыдущем корпусе для обогрева следующего (благодаря уменьшению температуры кипения упариваемого раствора от корпуса к корпусу).
2) Прямоточная схема, благодаря уменьшению давления в каждом последующем корпусе, позволяет осуществлять непринудительное перемещение раствора из корпуса в корпус без затрат дополнительной энергии.
3) При работе многокорпусной выпарной установки практически всегда экономически выгодно отводить экстра-пар (если есть потребитель этого пара).
Задача теплового расчёта процесса выпаривания сводится к определению необходимого теплового потока Q, расхода теплоносителя Dгр, а также требуемой поверхности теплообмена F. Для стационарного режима работы выпарной установки тепловой баланс запишется следующим образом: Q+Socoto-Wi-S1c1t1=0. Отсюда имеем:
Q=Soco(t1-t0)=W(i-cpt1). Таким образом, необходимый тепловой поток расходуется на нагрев So кг/с исходного раствора от to до t1 и на последующее испарение растворителя W кг/с при температуре t1. П рассчитанному тепловому потоку Q найдём расход греющего пара D гр : D гр h - Q - D гр с кT=0, т.е.  . Значит площадь поверхности теплообмена F равна:
. Значит площадь поверхности теплообмена F равна:  . Потери тепла в окружающую среду Qо при определении расхода греющего пара:
. Потери тепла в окружающую среду Qо при определении расхода греющего пара:  . Однако при расчёте площади теплообмена F труб нагревательной камеры учитывается лишь тепловой поток на процесс выпаривания Q.
. Однако при расчёте площади теплообмена F труб нагревательной камеры учитывается лишь тепловой поток на процесс выпаривания Q.
Привести схему и принцип работы простого регенеративного цикла высокого давления (цикл Линде). Каким образом нужно изменять параметры воздуха (температуру, давление) в циклах глубокого охлаждения пред конечным дросселированием воздуху до жидкого состояния с целью увеличения удельной холодопроизводительности цикла (хр)?
Ответ: Это – наиболее простой из циклов, использующих только дросселирование. Чтобы получить приемлемо низкую температуру, надо подвергать дросселированию по возможности охлажденный газ. Для этого процесс сжатия в многоступенчатом компрессорном агрегате проводят условно изотермически, охлаждая газ (воздух) после каждой ступени в холодильнике до температуры перед сжатием. Но этого недостаточно, поэтому сжатый газ направляют в теплообменный аппарат (в процессах глубокого охлаждения его называют холодообменником), где он дополнительно охлаждается. В этом случае после дросселирования воздух попадает в область влажного пара, что позволяет после сепарации выделить:
- жидкую составляющую, используемую как конечный продукт (выводится из цикла);
- холодный пар (газ) – он используется в цикле охлаждения встречного потока в холодообменнике.
Анализ удобно вести в расчете на 1 кг газа, сжигаемого в компрессоре.
На рис. 21.16,а изображена принципиальная схема простого регенеративного цикла Линде. Исходный воздух изотермически сжимается от давления р1 до р2 в компрессионном агрегате К и охлаждается в холодообменнике Х при постоянном давлении р2 (за счет обратного потока холодного воздуха). Затем сжатый воздух дросселируется в вентиле Др до давления р1. Полученная парожидкостная смесь поступает в сепаратор С, откуда жидкость (сжиженный газ) отводится от системы в количестве х, а газ в количестве (1-х) возвращается в холодообменник Х, забирая теплоту у потока сжатого газа, идущего на дросселирование.
Заметим: давление р1, как правило атмосферное: свежий воздух забирается из атмосферы; жидкий воздух храниться и транспортируется в сосудах Дьюара, где зона хранения соединена с атмосферой.
В связи с р1 =1 бар может возникнуть вопрос: зачем долю (1-х) возвращать в цикл, не проще ли направлять на сжатие в компрессор весь воздух (1 кг) из атмосферы, а не небольшую долю х? Дело в том. что воздух в циклах глубокого охлаждения проходит специальную подготовку (очистку от воды, диоксида углерода и др. примесей) Очистка воздушного потока Gx дешевле, чем полного потока G. Поэтому поток воздуха G(1-x), ранее уже прошедшего очистку, возвращают в цикл. В диаграмме Т-s (рис.21.16,б) стадии процесса изображены следующим образом:
1-2 – изотермическое (Т1=Т2=const) сжатие 1 кг воздуха;
2-3 – изобарическое (р2= const) охлаждение в холодообменнике;
3-4 – дросселирование (h=const);
4-0 и 4-5 - изобарическая (р1= const) сепарация (с выводом потока х жидкого воздуха);
5-1 – изобарическое (р1= const) нагревание потока (1-х) воздуха (с присоединением потока х свежего воздуха и направлением 1 кг смеси на сжатие в компрессор).
Далее стадии повторяются. Вследствие отбора и восполнения количества (х) рабочего тела (воздуха) цикл по РТ не замкнут, и его можно трактовать как замкнутый только условно.
Удельная холодопроизводительность – теплота, отбираемая у 1 кг изотермически сжимаемого РТ в компрессионном агрегате К с холодильниками. УХ=h1-h2
Степень сжижения (теоретическая), если она определяется в предположении отсутствия потерь холода в окружающую среду и о полной рекуперации теплоты в холодобменнике. 
 .
.
Удельный расход энергии на сжатие 1 кг воздуха.
Удельная работа, приходящаяся на 1 кг жидкого воздуха
Мощность на валу компрессора.
Пути совершенствования цикла
С целью совершенствования крайне энергоемкого цикла Линде используются два основных пути.
Первый состоит в понижении температуры газа перед дросселированием. Это должно благоприятно сказаться на удельных энергетических затратах, прежде всего за счет увеличения степени ожижения.
Возрастание эффективности цикла в общем плане здесь обусловлено уменьшением температуры верхнего источника Тв. Конкретно: при более низкой температуре исходного воздуха для полного ожижения потребуется отвести от него меньше теплоты. Кроме того, несколько увеличится удельная холодопроизводительность (разность энтальпий) в сравнении с фиксируемой при более высоких температурах. Понижение газа перед дросселированием осуществляется в испарителе машины умеренного охлаждения. Так строиться цикл с предварительным охлаждением.
Второй путь связан с различным характером влияния рабочих давлений р1 и р2 на затраты энергии в компрессоре и на интегральный эффект охлаждения при дросселировании. Энергетически выгодно дросселировать газ до некоторого промежуточного давления. Но продукт (жидкий воздух) должен быть получен при атмосферном давлении. Поэтому некоторую долю газа все же дросселируют от промежуточного давления до атмосферного. Так строиться цикл с двукратным дросселировнаием и циркуляцией воздуха промежуточного среднего давления. Наибольший эффект дает сочетание первого и второго путей модификации циклов. (см. рис. 21.16 (а,б), стр. 593)
Скорость гетерогенного каталитического процесса лимитирует стадия адсорбции исходных веществ на поверхности катализатора. Какое изменение в условиях процесса приведет к наибольшему повышению интенсивности процесса? Обосновать ответ.
Ответ: Процесс проходит во внешнедиффузионной области.
Скорость определяется как
r=β(Cv-CF)
СV, CF-концентрация газообразного вещества в объеме, и на поверхности катализатора
Для интенсификации процесса
1Увеличиваем концентрацию газообразного реагента
2Увеличиваем линейную скорость потока
3Перемешиваем или турбулизируем поток
4Увеличение поверхности контакта
12. Получение этанола методом прямой гидратации этилена:
С2Н4 + Н2О = С2Н5ОН (∆ Н < 0).
Обосновать ответ.
Ответ: Если процесс идет с уменьшением числа молей, то разбавление инертным компонентом смещает равновесие в сторону реагентов.
1) Если процесс идет с увеличением числа молей, то разбавление инертным компонентом смещает равновесие в сторону продуктов.
Применяется ↓ Р в системе (парциальное давление в компонентов смеси) (по принципу Ле-Шателье) для смещения равновесия вправо, при ↓ Р уменьшается скорость химической реакции(по стехиометрии) r ~ P n-1
Чем больше степень изменения количества молей, тем в большей степени система реагирует на изменение давления.
Р эффективное = Р общее(1- Сi)2
Рi = Nj P – закон Дальтона. Эффект разбавления (Nj ↓) подобен снижению давления в системе. Инертный компонент: дешевый, легко отделяется, подавляет побочные реакции, препятствует отложению углерода в органических системах. Для экзотермической реакции является теплоносителем для поддержания температуры.
Наиболее часто применяемый инертный агент – вод. пар.
14. С чем связаны ограничения в выборе объёмной скорости в производстве этанола методом прямой гидратации? Обосновать ответ. Какими соображениями определяется выбор объёмной скорости в циркуляционных процессах. С2 Н4 + Н2О ↔С2Н5ОН, ∆Н<0
Ответ: Процесс сложный, обратимый, экзотермический. При температуре максимальной активности катализатора выход составляет 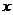 ≈10%, что обуславливает большой размер рецикла. В случаях, когда размер рецикла велик, процесс целесообразно проводить с большими объемными скоростями (дабы уменьшить размеры аппаратуры). Однако в случае гидратации этилена объемная скорость газообразных веществ относительно невелика (порядка 1500 м3/ч). это обусловлено тем, что при больших скоростях велик унос фосфорной кислоты (которая является катализатором), что вызывает коррозию и понижает срок службы оборудования. Кроме того, при высоких объемных скоростях сложно организовать автотермический процесс.
≈10%, что обуславливает большой размер рецикла. В случаях, когда размер рецикла велик, процесс целесообразно проводить с большими объемными скоростями (дабы уменьшить размеры аппаратуры). Однако в случае гидратации этилена объемная скорость газообразных веществ относительно невелика (порядка 1500 м3/ч). это обусловлено тем, что при больших скоростях велик унос фосфорной кислоты (которая является катализатором), что вызывает коррозию и понижает срок службы оборудования. Кроме того, при высоких объемных скоростях сложно организовать автотермический процесс.
Объёмную скорость процесса выбирают так, чтобы обеспечить высокую интенсивность и производительность процесса. В то же время не следует выбирать слишком большие скорости, т. к. в этом случае возможен «проскок» реагента
Обосновать ответ.
Ответ: Ле Шателье: Если на систему, находящуюся в состоянии равновесия, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении.
Введение инертного компонента, проведение процесса под вакуумом. В качестве инерта используется водяной пар (дешевый, подавляет побочные реакции, легко отделяется). Реакция эндотермическая, протекает с увеличением числа молей, следовательно, надо уменьшить давление. Эндотермическая реакция является теплоносителем, для поддержания температуры применяется отдувка инертных примесей (С остается постоянной).
21. Как повлияет повышение температуры процесса на равновесный выход продуктов реакции в первом и втором случае: аА + вВ ↔ rR + sS
1) DН <0, DS < 0; 2) DН > 0, DS < 0?
Обосновать ответ.
Ответ: Ле Шателье: Если на систему, находящуюся в состоянии равновесия, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведенного воздействия, и положение равновесия сместится в том же направлении. Равновесный выход – отношение количества продукта, полученного в состоянии равновесия в условиях процесса, к стехиометрическому количеству этого продукта. Это функция от Т, Р, С реагента.
h=NR*/NR стех
1) Реакция экзотермическая, поэтому при увеличении температуры уменьшиться равновесный выход продуктов реакции.
2) Реакция эндотермическая, поэтому при увеличении температуры увеличиться равновесный выход продуктов реакции.
DG=DH-TDS DG=-RTlnkP
22. Для чего используют катализатор в просессе конверсии метана водяным паром: СН4 + Н2О ↔ СО + 3 Н2 (DН>0), сопровождающейся разложением метана на углерод и водород?
Обосновать ответ.
Ответ: Получение водорода конверсией метана водяным паром описывается уравнениями:
1) СН4 + 2Н2О = СО2 + 4Н2 - 165кДж/моль
2) СН4 + Н2О ↔ СО + 3Н2 - 206кДж/моль
3) СО + Н2О ↔ СО2 + Н2 + 41кДж/моль
4) СН4 + СО2 = 2СО + 2Н2 - 248кДж/моль
5) СН4 + 0,5О2 = СО + 2Н2 + 35кДж/моль
Реакция 1) до конца не протекает и проходит через 2) и 3) стадии. Стадия 2) сложная, обратимая, эндотермическая, протекающая с увеличением числа молей. Стадия 3) сложная, обратимая, экзотермическая. Если проводить процесс при высокой температуре как требует процесс 2), то останется много неконвертированного СО по реакции 3). Если вести процесс при температурах реакции 3), то останется много неконвектированного метана. Поэтому процесс ведут в 2 стадии: 1 – конверсия метана и 2 – конверсия СО.
В 1 стадии (реакция 2) надо сместить равновесие, увеличить скорость реакции, подавить побочные реакции. Данная реакция характеризуется высокой энергией активации. Для ускорения реакции требуется температура ~ 1300ºС, а в этих условиях происходит разложение метана, так как энергия активации реакции разложения метана меньше энергии активации прямой реакции. Для понижения энергии активации вводим катализатор, с введением катализатора появляется возможность ввести процесс при более низкой температуре. В данном процессе применяется никелевый катализатор (катализирует окисление) на носителе из оксида алюминия в альфа форме (высокопористый),интервал рабочих температур катализатора 800-900ºС. Процесс протекает в диффузионной области на поверхности катализатора. Лимитирует процесс подвод тепла.
23. Как изменится равновесный выход продукта с увеличением концентрации инертных примесей в исходной смеси для реакции:
аА + вВ ↔ rR + sS в случае: 1) a + b > r + s; 2) a + b < r + s?
Обосновать ответ.
Ответ: Введение инертного компонента равноценно понижению давления в системе. В первом случае реакция идет с уменьшением числа молей, поэтому снижение давления в системе, согласно принципу Ле Шателье, вызовет смещение равновесия препятствуя этому изменению, то есть равновесие сместится в сторону исходных веществ. Случай два обратный первому случаю, следовательно, равновесие во втором варианте сместится в сторону конечных продуктов.
24. Получение ацетальдегида на палладиевом катализаторе: C2H4 + 0,5O2 → CH3CHO (Δ H < 0) сопровождается последовательными побочными реакциями. Что делают для их подавления? Обосновать ответ. Какие еще приемы используют для подавления побочных реакций?
Ответ: Скорость отдельных реакций и, соответственно, скорость образования побочных продуктов зависит от условий проведения процесса. На скорость суммарной реакции, селективность процесса и выход ацетальдегида существенно влияет состав катализаторного раствора (содержание PdCl2, CuCl2 и FeCl2), кислотность среды, давление, температура, соотношение этилена и окисляющего агента.
1. Соотношение между общим суммарным содержанием металлов окислительно-восстановительной системы (Cu, Fe или смеси) и Pd должно быть не меньше 15:1. На практике используется соотношение (25:1)- (50:1). Такой избыток меди и железа обуславливается высокой стоимостью Pd.
2. Конверсия олефина зависит также от мольного соотношения в катализаторе меди (железа) и галогена; оно поддерживается в узком диапазоне (1:1,4-1:1,8). Поэтому добавляемый в ходе процесса галоген в виде хлорида или этилхлорида должен дозироваться достаточно точно, так как при соотношении меньшем, чем 1:1, снижается конверсия этилена, а при соотношении 1:2 и выше реакция замедляется. В этом случае добавляют ацетат меди.
3. Процесс следует проводить в кислой (pH = 0,8-3,0) или нейтральной среде (pH = 6,0-7,5), так как при повышении pH из катализаторного раствора будет выпадать хлорид меди (I), что приводит к снижению выхода ацетальдегида и забивки отверстий газораспределительного устройства. Растворимость Cu(I) можно повысить добавлением в катализаторный раствор муравьиной, уксусной, а лучше – трихлоруксусной кислоты. Однако их следует добавлять в незначительном количестве (особенно уксусную кислоту), так как карбоновые кислоты образуют с Cu малоактивные соли. Кроме того, уксусная кислота растворяет продукты синтеза, что приводит к образованию побочных хлорированных продуктов.
4. Растворимость солей в воде ограничена, поэтому образуются разбавленные растворы катализатора, что приводит к его низкой удельной производительности. В связи с этим выгоднее работать с катализатором, находящимся в виде суспензии в воде или в разбавленной уксусной кислоте (шламовый катализатор). Применение шламового катализатора позволяет сочетать высокую концентрацию катализатора с хорошим отводом тепла; образовывать стабильную пену, что в свою очередь приводит к хорошему диспергированию газа.
5. В качестве сырья можно использовать как концентрированный этилен, так и этан-этиленовую фракцию. Наличие малых количеств водорода, оксида и диоксида углерода, предельных углеводородов не мешает протеканию процесса. Содержание непредельных углеводородов и серы должно быть незначительным (ацетилена ≤ 0,005 %, высших олефинов ≤ 0,03%, серы ≤0,001%) во избежание образования побочных продуктов.
6. Превращение этилена в ацетальдегид про 200С протекает с низкой скоростью. Реакция проходит сравнительно интенсивно при 100-1300С.
7. Для поддержания реакционной массы в жидком состоянии при такой температуре требуется повышенное давление (0,3-1,1 МПа), которое способствует и ускорению процесса за счет улучшения растворимости газов. Для повышения растворимости олефина и кислорода в водных растворах рекомендуется применять реакционные устройства, в которых осуществляется турбулизация жидкости и обеспечивается максимальная поверхность контакта фаз.
25. При протекании параллельных реакций в газовой фазе А→В (основная) и А→R(побочная) энергия активации основной реакции больше, чем побочной (Е1 > Е2), а порядок реакции по компоненту А n1< n2. Каким образом повысить селективность процесса?Обосновать ответ.
Ответ: Селектвность – отношение количества исходного реагента, превратившегося в целевой продукт, к общему количеству прореагировавшего реагента.
A=B (основная)
A=R (побочная)
Дано: E1>E2; h1>h2
Если h1>h2 , при повышении СА селективность будет расти
Если h1<h2 , при повышении СА селективность будет падать
Следовательно, для увеличения селективности при h1<h2 необходимо уменьшать СА
При E1>E2 увеличение температуры приводит к увеличению селективности
26. Основные потери в синтезе аммиака N2 + 3H2 ↔ 2NH3 (Δ H < 0) связаны с отдувкой части рециркулирующей газовой смеси. С какой целью проводится отдувка? От чего зависит объем продувки?
Ответ: Эффективное давление в системе рассчитывается по формуле
Pэф = Pобщ(1-i), где i-доля инертов в системе.
Для поддержания в циркуляционном газе постоянного содержания инертных газов, не превышающего 10%, проводят продувку газа после первичной конденсации аммиака (после сепаратора). Продувочные газы содержат 8-9% NH3, который выделяется при температуре -25-30 0С в конденсационной колонне и испарителе продувочных газов. Смесь танковых и продувочных газов после выделения аммиака используют как топливный газ.Объем отдувки зависит от объема накопившихся инертов
 27.В исследуемой системе основная (1) и побочная(2) реакции идут в газовой фазе.
27.В исследуемой системе основная (1) и побочная(2) реакции идут в газовой фазе.
A + 2B ↔ R (∆ H < 0) (1)
A + B → S (2)
Константа равновесия основной реакции (1) в широком диапазоне температур изменяется в пределах 102 –10-2. Энергия активации реакции 1 меньше энергии активации реакции 2. Какими приёмами можно сместить равновесие реакции 1 в нужную сторону и повысить селективность процесса?
Ответ: Понизить температуру и повысить давление
28.Синтез аммиака проводят с большими объёмными скоростями для:
Ответ: увеличения интенсивности процесса
29. Почему гетерогенный каталитический процесс, осложненный последовательными превращениями целевого продукта: А→ В→ D (В – целевой продукт) проводят во внешнедиффузионной области на непористом катализаторе?
Ответ: Потому что, если взять пористый катализатор, то процесс последующего превращения целевого продукта также будет катализироваться, потому что не будет успевать выходить из пор, до следующего превращения. А на беспористом катализаторе у нас будет идти первая реакция и в результате «текучки» не будет успевать идти следующая реакция.
Ответ.
Понижение давления реализуется введением в реакционную смесь инертного компонента, в нашем случае - водяного пара.
Pэф. = Pобщ.(1-Ci), где Ci – содержание инерта.
Это технологическое решение имеет несколько преимуществ:
* Водяной пар дешев.
* Водяной пар легко отделяется на завершающих стадиях технологической цепочки.
* Водяной пар препятствует коксообразованию, а именно газифицирует образующийся на стенках труб кокс.
34. Процесс экзотермичен. Реагенты и продукты находятся в газовой фазе. Число молей продуктов больше, чем число молей реагентов. Процесс протекает с возрастанием энтропии. Как сместить равновесие реакции в сторону образования продуктов?
Ответ.
1) Оценка влияния на равновесие температуры.
Процесс экзотермичен => ∆H < 0.
Процесс протекает с возрастанием энтропии => ∆S > 0.
Исходя из ∆G = ∆H - T∆S,
∆G = - RTLn(Кр);
получим Ln(Кр) = ∆S/R - ∆H/RT. Окончательно, с учетом знаков:
Ln(Кр) = ∆S/R + │∆H│/RT, откуда очевидно что с ростом температуры константа скорости прямой реакции уменьшается. Т.е. для смещения равновесия в сторону образования продуктов необходимо понижать температуру.
2) Оценка влияния на равновесие давления.
Т. к. число молей продуктов больше, чем число молей реагентов, то понижение давления, в соответствии с принципом Ле Шатерье, сместит равновесия в сторону образования продуктов.
35. Окисление SO2 в SO3: SO2 + 0,5О2 ↔SO3 (∆ H < 0) – обратимая экзотермическая реакция, которая проводится на ванадиевом катализаторе в интервале температур 400-6000 С. Какой приём применяют для получения большого выхода продукта? Объяснить суть приёма.
Ответ:
 У данной реакции большая величина энергии активации (
У данной реакции большая величина энергии активации ( ), поэтому применяют катализаторы. Чаще всего ванадиевые. У применяемых катализаторов рабочая температура 400-600 0С.
), поэтому применяют катализаторы. Чаще всего ванадиевые. У применяемых катализаторов рабочая температура 400-600 0С.
Так как реакция экзотермическая, то для смещения равновесия вправо следует понижать температуру. Нижний предел ограничен температурой зажигания катализатора: 400 0С. Но при такой температуре очень мала скорость процесса и при промышленных объемных скоростях не достигается требуемой степени превращения. При повышении температуры возрастает скорость реакции, но равновесие смещается влево, т.е. равновесная концентрация продукта (SO3) уменьшается (см. линию равновесия). Верхний предел ограничен 600 0С, т.к. при более высоких температурах катализатор теряет активность. Для получения высокой конверсии с требуемой скоростью процесс ведут по линии оптимальных температур (ЛОТ). Суть приёма состоит в следующем. Процесс ведут с уменьшением температуры в секционированном контактном аппарате: сначала реакционная смесь нагревается до температуры зажигания катализатора 400 0С и поступает в первый слой контактного аппарата. В этих условиях велика скорость процесса и быстро достигается конверсия, близкая к равновесной. При этом реакционная смесь разогревается приблизительно до 600 0С. После разогрева до этой температуры реакционная смесь охлаждается. Чаще всего выносными теплообменниками, реже – байпасным введением холодного воздуха. Последнее кстати дополнительно смещает равновесие в сторону продукта (повышение концентрации реагента). Затем охлаждённая смесь снова поступает уже во второй слой контактного аппарата. После разогрева реакционной смеси до определённой температуры (уже < 600 0С), она поступает в следующий теплообменник. И так далее. В каждом последующем слое контактного аппарата температура понижается по сравнению с предыдущей, при этом уменьшается скорость процесса и увеличивается степень превращения. Количество слоёв определяется из экономических соображений. Таким образом, благодаря высокой температуре вначале процесса мы получаем большую скорость реакции. А постепенно охлаждая реакционную смесь в каждом слое повышаем выход продукта. (в данном случае все слова «конверсия» и «степень превращения» можно заменить на «выход», т.к. процесс простой и селективность = 1).
36. В эндотермическом газофазном процессе число молей продуктов меньше, чем число молей реагентов. Реакция характеризуется убылью энтропии. Как сместить равновесие реакции в сторону образования продуктов?
Ответ: Энергия Гиббса равна  . Из условий задачи получаем:
. Из условий задачи получаем: 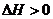 (эндотермический процесс),
(эндотермический процесс),  (энтропия уменьшается). Получаем, что
(энтропия уменьшается). Получаем, что  . При
. При  равновесие реакции сдвинуто влево, выход продукта мал. (это почти не реализуемые процессы).
равновесие реакции сдвинуто влево, выход продукта мал. (это почти не реализуемые процессы).
В соответствии с принципом Ле Шателье («Если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-нибудь из условий, определяющих положение равновесия, то в системе усилится то направление процесса, течение которого ослабляет влияние произведённого воздействия, и положение равновесия сместится в том же направлении». Т.е. равновесие смещается в сторону тех условий, которые ослабляют внешнее воздействие.) сместить равновесие в сторону образования продуктов можно следующим образом:<





 .
.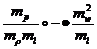 ; разделим на
; разделим на  и учтем, что
и учтем, что  ,
,  и
и  .
. или
или  . Критерий (число) гидродинамического подобия Эйлера Eu=
. Критерий (число) гидродинамического подобия Эйлера Eu=  , где pi – давление i-той системы,
, где pi – давление i-той системы,  - скорость течения i-той системы,
- скорость течения i-той системы,  - плотность жидкости в i-той системе. Физический смысл критерия ясен из процедуры сопоставления – сопоставление сил инерции и давления. В технологических процессах чаще используется не конкретное давление p, а перепад давлений
- плотность жидкости в i-той системе. Физический смысл критерия ясен из процедуры сопоставления – сопоставление сил инерции и давления. В технологических процессах чаще используется не конкретное давление p, а перепад давлений  . Тогда выражение для критерия Эйлера принимает следующее выражение Eu=
. Тогда выражение для критерия Эйлера принимает следующее выражение Eu=  .
. 9. Под действием каких сил одиночная сферическая частица (плотность ρт) находится неподвижно в восходящем потоке (плотность ρ)? Назовите эти силы и укажите направления их действия относительно выбранной системы координат.
9. Под действием каких сил одиночная сферическая частица (плотность ρт) находится неподвижно в восходящем потоке (плотность ρ)? Назовите эти силы и укажите направления их действия относительно выбранной системы координат. , где W1 и W – скорости жидкости в сечениях F и fc,
, где W1 и W – скорости жидкости в сечениях F и fc, 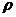 - плотность жидкости,
- плотность жидкости,  - потерянный напор.
- потерянный напор. , где
, где 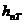 - потери напора от трения,
- потери напора от трения,  - потери напора от местного сопротивления (отверстия). Пренебрежем
- потери напора от местного сопротивления (отверстия). Пренебрежем  , где
, где  - коэффициент местного сопротивления при протекании жидкости через отверстие.
- коэффициент местного сопротивления при протекании жидкости через отверстие.  ;
;  . Т.к.
. Т.к. 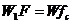 , то
, то  .
.  . Пренебрежем
. Пренебрежем  , т.к. она мала в сравнении с 1 и с
, т.к. она мала в сравнении с 1 и с  , тогда
, тогда  . Введем приведенную высоту
. Введем приведенную высоту 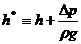 .
.  - коэффициент скорости.
- коэффициент скорости.  . Расход жидкости
. Расход жидкости  ,
,  , где
, где  - коэффициент сжатия струи;
- коэффициент сжатия струи;  .
. 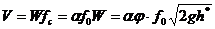 .
.  - коэффициент расхода.
- коэффициент расхода.
 Физический смысл Kp – это коэффициент, который учитывает влияние толщины стенок и состояния кромок отверстия сосуда (коэффициент сжатия
Физический смысл Kp – это коэффициент, который учитывает влияние толщины стенок и состояния кромок отверстия сосуда (коэффициент сжатия  ); форму отверстия и его расположение относительно сосуда (коэффициент сжатия струи
); форму отверстия и его расположение относительно сосуда (коэффициент сжатия струи  Ответ: Абсорбцией называют процесс избирательного извлечения одного или нескольких компонентов из газовой смеси жидким поглотителем (абсорбентом). Обратный процесс-выделение из абсорбента растворенных в нем газов (паров) носит название десорбции. При отсутствии химического взаимодействия между поглощаемым компонентом и абсорбенто процесс называется физической абсорбцией.
Ответ: Абсорбцией называют процесс избирательного извлечения одного или нескольких компонентов из газовой смеси жидким поглотителем (абсорбентом). Обратный процесс-выделение из абсорбента растворенных в нем газов (паров) носит название десорбции. При отсутствии химического взаимодействия между поглощаемым компонентом и абсорбенто процесс называется физической абсорбцией.
 Смесь из трех компонентов А, В, С разделяется в первой колонне на дистиллят (компонент А требуемой чистоты) и кубовый остаток, состоящий преимущественно из компонентов В и С. Эту бинарную смесь разделяют во второй колонне на В (дистиллят) и С (кубовая жидкость). Кипящая кубовая жидкость из первой колонны во вторую подается насосом.
Смесь из трех компонентов А, В, С разделяется в первой колонне на дистиллят (компонент А требуемой чистоты) и кубовый остаток, состоящий преимущественно из компонентов В и С. Эту бинарную смесь разделяют во второй колонне на В (дистиллят) и С (кубовая жидкость). Кипящая кубовая жидкость из первой колонны во вторую подается насосом. Дистиллятом первой колонны является концентрированная смесь двух компонентов (А и В), а кубовый остаток содержит преимущественно компонент С. Бинарная смесь А+В самотеком направляется во вторую колонну, где разделяется на А и В.
Дистиллятом первой колонны является концентрированная смесь двух компонентов (А и В), а кубовый остаток содержит преимущественно компонент С. Бинарная смесь А+В самотеком направляется во вторую колонну, где разделяется на А и В. . Значит площадь поверхности теплообмена F равна:
. Значит площадь поверхности теплообмена F равна:  . Потери тепла в окружающую среду Qо при определении расхода греющего пара:
. Потери тепла в окружающую среду Qо при определении расхода греющего пара:  . Однако при расчёте площади теплообмена F труб нагревательной камеры учитывается лишь тепловой поток на процесс выпаривания Q.
. Однако при расчёте площади теплообмена F труб нагревательной камеры учитывается лишь тепловой поток на процесс выпаривания Q.
 .
. ≈10%, что обуславливает большой размер рецикла. В случаях, когда размер рецикла велик, процесс целесообразно проводить с большими объемными скоростями (дабы уменьшить размеры аппаратуры). Однако в случае гидратации этилена объемная скорость газообразных веществ относительно невелика (порядка 1500 м3/ч). это обусловлено тем, что при больших скоростях велик унос фосфорной кислоты (которая является катализатором), что вызывает коррозию и понижает срок службы оборудования. Кроме того, при высоких объемных скоростях сложно организовать автотермический процесс.
≈10%, что обуславливает большой размер рецикла. В случаях, когда размер рецикла велик, процесс целесообразно проводить с большими объемными скоростями (дабы уменьшить размеры аппаратуры). Однако в случае гидратации этилена объемная скорость газообразных веществ относительно невелика (порядка 1500 м3/ч). это обусловлено тем, что при больших скоростях велик унос фосфорной кислоты (которая является катализатором), что вызывает коррозию и понижает срок службы оборудования. Кроме того, при высоких объемных скоростях сложно организовать автотермический процесс. 27.В исследуемой системе основная (1) и побочная(2) реакции идут в газовой фазе.
27.В исследуемой системе основная (1) и побочная(2) реакции идут в газовой фазе. У данной реакции большая величина энергии активации (
У данной реакции большая величина энергии активации ( ), поэтому применяют катализаторы. Чаще всего ванадиевые. У применяемых катализаторов рабочая температура 400-600 0С.
), поэтому применяют катализаторы. Чаще всего ванадиевые. У применяемых катализаторов рабочая температура 400-600 0С. . Из условий задачи получаем:
. Из условий задачи получаем: 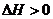 (эндотермический процесс),
(эндотермический процесс),  (энтропия уменьшается). Получаем, что
(энтропия уменьшается). Получаем, что  . При
. При 

