

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...
Топ:
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Искусственное повышение поверхности территории: Варианты искусственного повышения поверхности территории необходимо выбирать на основе анализа следующих характеристик защищаемой территории...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Берегоукрепление оползневых склонов: На прибрежных склонах основной причиной развития оползневых процессов является подмыв водами рек естественных склонов...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
ДИФФУЗИЯ В ГАЗАХ
ЦЕЛЬ РАБОТЫ:
* Знакомство с компьютерной моделью, описывающей диффузию молекул идеального газа
* Экспериментальное подтверждение закона диффузии.
·Определение средней скорости теплового движения частиц.
Ознакомьтесь с теорией в конспекте и учебнике: Савельев, Физика, т.1, §128, §130.
Запустите программу «Открытая химия». Выберите модель 4.11.«Диффузия газов». Прочитайте краткие теоретические сведения. Необходимое запишите в свой конспект.
КРАТКАЯ ТЕОРИЯ:
1. При нарушении равновесия макросистема стремится вернуться в равновесное состояние. ЯВЛЕНИЯМИ ПЕРЕНОСА называются процессы, связанные с возникновением в веществе НАПРАВЛЕННОГО ПЕРЕНОСА (потока) массы, импульса или внутренней энергии.
ДИФФУЗИЯ есть процесс установления внутри фаз вещества равновесного распределения концентраций, который обеспечивается направленным переносом массы этого вещества. Диффузия обусловлена тепловым движением молекул и проявляется в самопроизвольном выравнивании концентраций в смеси нескольких веществ.
САМОДИФФУЗИЯ имеет место при самопроизвольном выравнивании концентрации однородного вещества, если по некоторым причинам равновесное распределение концентрации было нарушено.
ДЛИНА СВОБОДНОГО ПРОБЕГА l есть среднее расстояние, пролетаемое частицей между двумя последовательными столкновениями:
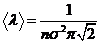 , (1)
, (1)
где n = N/V – число молекул газа в единице объема, σ – Эффективный диаметр частицы, т.е. минимальное расстояние, на которое сближаются центры двух сталкивающихся частиц.
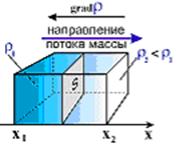 Если в начальный момент времени имеет место неоднородное распределение плотности вещества r вдоль только одной оси (например, ОХ), тогда возникает одномерная диффузия, связанная с переносом массы М вдоль этой оси ОХ (см. рис. 1).
Если в начальный момент времени имеет место неоднородное распределение плотности вещества r вдоль только одной оси (например, ОХ), тогда возникает одномерная диффузия, связанная с переносом массы М вдоль этой оси ОХ (см. рис. 1).
|
|
Для двухкомпонентной системы (например, смеси двух газов) одномерная диффузия описывается первым законом Фика:
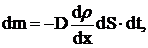 (2)
(2)
Рис. 1. Градиент плотности вещества по оси ОХ.
где dm – масса одного компонента (индексы для характеристик данного компонента пропущены), которая переносится за время dt через элементарную площадку, перпендикулярную оси ОХ, имеющую площадь dS, в направлении убывания плотности этого компонента, 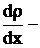 градиент плотности первого компонента, D – коэффициент диффузии, который определяет количество вещества, проходящего в единицу времени через участок единичной площади (при градиенте плотности равном 1), знак "минус" указывает на направление потока массы от больших концентраций к меньшим.
градиент плотности первого компонента, D – коэффициент диффузии, который определяет количество вещества, проходящего в единицу времени через участок единичной площади (при градиенте плотности равном 1), знак "минус" указывает на направление потока массы от больших концентраций к меньшим.
Для смеси «красных» и «зеленых» частиц, имеющих одинаковую массу m каждой частицы, dm = m·dN, r = m 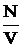 , а
, а 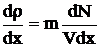 , где dN – количество частиц, проходящих через dS за время dt, которое равно
, где dN – количество частиц, проходящих через dS за время dt, которое равно 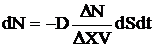 , где разность числа частиц в левом и правом сосудах DN = N2 - N1, N2 = N0 - N(t), N1 = N(t), DX = Lотв, объем сосуда V = 20 cм3, dS – площадь отверстия. Решаем уравнение методом разделения переменных:
, где разность числа частиц в левом и правом сосудах DN = N2 - N1, N2 = N0 - N(t), N1 = N(t), DX = Lотв, объем сосуда V = 20 cм3, dS – площадь отверстия. Решаем уравнение методом разделения переменных:
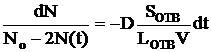 .
.
Интегрируем слева от 0 до N(t), а справа – от 0 до t и получаем зависимость числа частиц от времени диффузии:
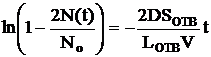 или
или 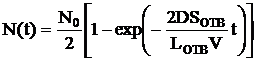 , (3).
, (3).
2. ЗАКОН ДИФФУЗИИ ГРЭМА: скорость диффузии газа обратно пропорциональна квадратному корню из его плотности (молярной массы). Скорость диффузии газов можно сопоставить, измеряя время, необходимое чтобы одинаковый объем газа при одинаковых условиях продиффундировал через пористую поверхность. Тогда времена диффузии двух газов соотносятся между собой как 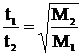 , т.е. легкие газы диффундируют быстрее тяжелых.
, т.е. легкие газы диффундируют быстрее тяжелых.
Процессы переноса приводят к выравниванию концентраций газов, в результате образуется равновесная газовая смесь, в которой потоки массы и энергии отсутствуют. Количественный состав газовой смеси можно охарактеризовать, указав для каждого компонента его массовую wi, объемную ji, мольную Xi доли или молярную концентрацию Ci. МОЛЯРНАЯ КОНЦЕНТРАЦИЯ – отношение количества молей данного вещества к общему объему смеси. Ci = ni / V. Единица измерения моль/л или М. Образующаяся смесь газов подчиняется тем же газовым законам, что и индивидуальные газы. МОЛЯРНАЯ МАССА СМЕСИ складывается из молярных масс ее компонентов с учетом их процентного содержания: Мсм = åji Mi, где M i – молярная масса компонента, а ji – его объемная доля.
|
|
Для смеси газов, не вступающих в химическое взаимодействие, справедлив ЗАКОН ДАЛЬТОНА: общее давление смеси газов равно сумме парциальных давлений ее компонентов Р = Sрi.. ПАРЦИАЛЬНОЕ ДАВЛЕНИЕ рi – давление, которое производил бы газ, если бы он один занимал весь объем смеси.
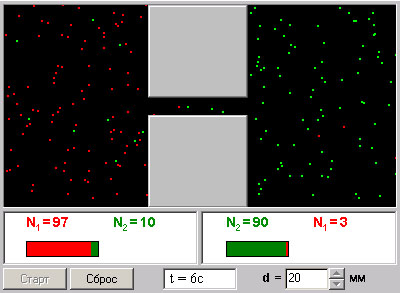
Рис. 2.
На рис. 2 изображена компьютерная модель смешивающихся газов. В этой модели представлены 2 системы частиц, которые в начальный момент находятся в левом (красные) и в правом (зеленые) объемах. Частицы абсолютно упруго сталкиваются друг с другом и со стенками сосуда. Количество частиц N0 каждого вида равно 100, и данная система является хорошей “механической” моделью идеального газа. Количество частиц подсчитывается автоматически и высвечивается над соответствующими столбиками.
МЕТОДИКА И ПОРЯДОК ИЗМЕРЕНИЙ:
1. Нажать кнопку «Сброс» и выставить с помощью регулятора значение диаметра трубки d, соединяющей два сосуда с газами, которое указано в таблице 1 для вашего варианта.
ТАБЛИЦА 1. (не перерисовывать)
|
|
|

Археология об основании Рима: Новые раскопки проясняют и такой острый дискуссионный вопрос, как дата самого возникновения Рима...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!