Равновесные соотношения при химических реакциях имеют важное значение для определения условий проведения процесса, термодинамически благоприятных для его реализации. Они необходимы при кинетическом описании реакции, ее моделировании и оптимизации. Исходным моментом при определении химических равновесий является нахождение константы равновесия. По константе равновесия рассчитывают состав равновесных смесей, равновесную степень превращения (равновесную конверсию). Константа равновесия химической реакции выводится на основании закона действующих масс (в современной трактовке – закона равновесных концентраций):
W1
А + В ↔ 2C. (4.16)
W-1
Скорость прямой реакции W1 пропорциональна произведению константы скорости прямой реакции k1 и активностей аi (моль/л, кмоль/м3) или концентраций Сi (моль/л, кмоль/м3) реагентов А и В, а скорость обратной реакции W-1 – произведению константы скорости обратной реакции k-1 и активности (концентрации) продукта С. Каждая активность (концентрация) возведена в степень, равную стехиометрическому коэффициенту компонента в химическом уравнении:
W1 = k1aAaB; W-1 = k-1a 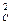 (4.17)
(4.17)
Из условия равенства скоростей прямой и обратной реакций в момент достижения химического равновесия можно записать
W1 = W-1; k1aAaB = k-1a 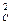 . (4.18)
. (4.18)
Отношение констант скоростей прямой и обратной реакций называется константой равновесия Ка :
k1 a 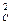
── = ── = Кa (4.19)
k-1 aAaB
k1 С 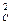
Для разбавленных водных растворов ── = ─── = Кс (4.20)
k-1 СAСB
k1 Р 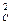
Для идеальных газовых смесей ── = ── = Кр (4.21)
k-1 РAРB
Уравнения (4.19) - (4.21) – разные формы представления закона равновесных концентраций.
Константа равновесия связывает активности (концентрации, парциальные давления) всех компонентов реакционной смеси. Изменение любой из этих величин при постоянной температуре ведет к изменению всех других, кроме константы равновесия, которая постоянна при постоянной температуре. Таким образом, основное значение закона равновесных концентраций состоит в том, что он устанавливает связь между равновесными концентрациями всех реагирующих веществ.
Числовое значение и размерность константы равновесия зависят от способа написания стехиометрического уравнения. Для расчетов равновесия принято написание уравнения с получением 1 моль целевого продукта.
Константа равновесия может быть найдена расчетными и экспериментальными методами. Для расчета в основном используется следующее уравнение:
∆G 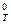 ∆H
∆H 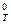 −T∆S
−T∆S 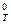
ln Ka = − ─── = ──────, (4.22)
RT RT
где ∆G 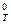 - изменение энергии Гиббса, кДж/моль; ∆H
- изменение энергии Гиббса, кДж/моль; ∆H 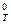 - энтальпия образования вещества, кДж/моль; ∆S
- энтальпия образования вещества, кДж/моль; ∆S 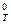 - энтропия системы, Дж/(моль∙К); R –универсальная газовая постоянная; Т – температура, К.
- энтропия системы, Дж/(моль∙К); R –универсальная газовая постоянная; Т – температура, К.
В химической технологии обратимые процессы широко распространены. Выбирая условия проведения таких процессов, нужно в первую очередь руководствоваться требованием смещения равновесия в сторону образования продукта реакции. При этом следует учитывать, что для повышения равновесного выхода необходимо:
Ø снижать температуру для экзотермической реакции;
Ø повышать температуру для эндотермической реакции;
Ø повышать давление в реакциях, протекающих с уменьшением объема;
Ø понижать давление в реакциях, идущих с увеличением объема;
Ø повышать концентрацию исходных реагентов;
Ø снижать концентрацию продуктов реакции.
Контрольные вопросы:
1. Как рассчитывается скорость химической реакции?
2. От каких факторов зависит размерность константы скорости?
3. Что такое «частный порядок реакции по компоненту»?
4. Какова взаимосвязь между общим порядком реакции и частными порядками реакции по компонентам?
5.Что такое «лимитирующая стадия реакции» и для чего необходимо ее знать?
6. Какие факторы влияют на скорость химической реакции?



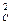 (4.17)
(4.17) ∆H
∆H 


