

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
Топ:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Характеристика АТП и сварочно-жестяницкого участка: Транспорт в настоящее время является одной из важнейших отраслей народного хозяйства...
Интересное:
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
 и увеличение радиуса:
и увеличение радиуса:
Адсорбируемость этих ионов при прочих равных условиях совпадает с увеличением радиуса и уменьшением толщины гидратной оболочки. Аналогичный ряд имеет место и в случае двухзарядных катионов второй группы:
Mg2+ Ca2+ Sr2+ Ba2+.
Анионы галогенов также могут быть расположены в лиотропный ряд, совпадающий с их положением в группе периодической системы Д. И. Менделеева. Однако если к ним добавить другие часто применяемые в лабораторной практике однозарядные анионы, например, нитрат NO3-, ацетат СН3СОО-, тиоцианат SCN- и др., то ряд по адсорбируемости получается более сложным
Адсорбционная способность ионов в большой степени зависит и от величины их заряда. Чей больше заряд иона, тем лучше он адсорбируется. Так, катионы с примерно одинаковыми радиусами располагаются в такой ряд:
Na+ << Са2+ << А13+ << Тi4+
 Увеличение адсорбируемости:
Увеличение адсорбируемости:
Объединяя катионы с различным зарядом, можно получить ряд по увеличению адсорбционной способности, впервые описанный К. К. Гедройцем:
Al3+ > Ba2+ > Ca2+ > Mg2+ > K+ > NH4+ > Na+ > Li+.
Влияние природы адсорбента
Адсорбции электролитов в гораздо более высокой степени, чем молекулярной, свойственна избирательность,особенно проявляющаяся в случае адсорбентов с кристаллической поверхностью. При этом адсорбция приобретает некоторые черты хемосорбции и её можно рассматривать как достройку кристаллической решётки ионами адсорбата. Согласно правилу Ф. А. Пáнета - К. Фáянса (1913)
Адсорбироваться на поверхности кристалла в первую очередь будут те ионы, которые способны достроить кристаллическую решётку.
Образование двойного электрического слоя
|
|
Ионы являются носителями электрического заряда, поэтому их адсорбция сопровождается возникновением электрического поля в области поверхностного слоя. Например, переход катионов из объёма жидкой фазы на поверхность твёрдой приводит к тому, что последняя заражается положительно и приобретает соответствующий электрический потенциал. Поэтому ионы, непосредственно связанные с твёрдой поверхностью адсорбента (в рассмотренном примере – катионы), называются потенциалобразующими (или потенциалопределяющими)ионами. Для нейтрализации этого заряда к поверхности подходит эквивалентное количество ионов противоположного знака (в данном примере – анионов), называемых противоионами, которые удерживаются у поверхности в основном электростатическими силами (" эквивалентная адсорбция "). При этом прилегающая к поверхности область жидкой фазы приобретает отрицательный заряд. В результате такого перераспределения зарядов на поверхности адсорбента возникает двойной электрический слой (ДЭС), подобный конденсатору с двумя противоположно заряженными обкладками.
Обменная адсорбция
Если на поверхности адсорбента уже адсорбирован электролит, то при контакте его с другим электролитом почти всегда в той или иной степени наблюдается обменная адсорбция, или правильнее, ионный обмен между двойным электрическим слоем адсорбента и жидкой средой. Ионный обмен представляет собой обратимый процесс стехиометрического обмена ионами между раствором электролита и твёрдой поверхностью адсорбента. Это явление происходит также и на поверхности веществ, поверхностные атомы или функциональные группы которых при контакте с водой подвергаются диссоциации. Такие вещества называются ионообменниками или ионитами (см. п. 3.5.6.1). При диссоциации ионогенной группы ионита образуется ионная пара, один из ионов которой соединён ковалентной связью с твёрдой основой (матрицей) ионита, а подвижный ион находится вблизи поверхности и играет роль противоиона.
|
|
Первые сообщения об ионном обмене были сделаны в 1850 г. независимо друг от друга английскими учеными Томпсоном и Уэем. Изучая способность почв к поглощению удобрений и их вымывание дождём, они обнаружили явление обмена ионов между почвами и водными растворами солей. Впоследствии ионный обмен в почвах исследовал академик К. К. Гедройц. Практический интерес к ионообменной адсорбции обусловил широкие теоретические исследования этого явления и разработку методов синтеза специальных ионообменных сорбентов.
При обменной адсорбции адсорбент, поглощая определённое количество каких либо ионов, одновременно выделяет в раствор другие ионы того же знака, вытесняемые с его поверхности (противоионы). Благодаря эквивалентности обмена ионами в течение всего процесса сохраняется электронейтральность обеих фаз.
Сродство ионитов к ионам возрастает с ростом их заряда, т. е., например, из имеющихся в окружающем растворе одно-, двух- и трехзарядных и ионов ионит в первую очередь «выберет» трёхзарядные. При равных зарядах обменивающихся ионов сродство ионитов возрастает к ионам с бóльшим атомным номером, т. е. в соответствии с их лиотропным рядом. Например, для катионов:
Li+ < Na+ < K+ < Rb+
или Mg2+ < Ca2+ < Sr2+ < Ba2+.
Сродство к органическим катионам и анионам тем больше, чем больше размер ионов, точнее, чем больше размер углеводородных радикалов, соединённых с функциональной группой, или их число. Например, для ряда аминов:
NH4+ < CH3NH3+ < (CH3)2NH2+ < (CH3)3NH+ < (CH3)4N+
Ионный обмен сопровождается экзотермическим тепловым эффектом. Однако обычно этот эффект невелик (4 – 8 кДж/моль) и поэтому константа ионообменного равновесия практически не зависит от температуры. Скорость установления равновесия при ионном обмене, как правило, определяется скоростью диффузии обмениваемых ионов. Поэтому процесс может быть ускорен перемешиванием.
Ионный обмен обычно рассматривается как гетерогенная химическая реакция, которую можно характеризовать константой равновесия (константой обмена) К. Если в обмене участвуют два вида ионов, обозначаемые как 1 и 2, константа обмена может быть выражена уравнением Б. П. Никольского
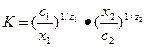 ,
,
где с1 и с2 – концентрации или активности противоионов 1 и ионов 2 в равновесном растворе; х1 и х2 – концентрации или активности противоионов 1 и ионов 2 в равновесной фазе ионита; z1 и z2 – заряды ионов. Константа обмена определяет соотношение ионов 1 и 2 в равновесном растворе и поэтому эффективность обмена тем больше, чем больше К отличается от единицы.
|
|
В фармации ионообменная адсорбция используется при очистке воды для инъекционных растворов, при выделении биологически активных и лекарственных веществ из растительного сырья (например, алкалоидов, таких как атропин, скополамины, пилокарпин, платифиллин, лобелии), при очистке и выделении антибиотиков из культуральных жидкостей (например, стрептомицин, тетрациклин, ауромицин, террамицин). В медицине тромборезистентные иониты (гемосорбенты) применяют для очистки крови и лимфы от токсичных веществ.
Кроме того, ионный обмен лежит в основе такого важного метода разделения и анализа лекарственных веществ, как ионообменная хроматография.
Водоподготовка(очистка, умягчение и обессоливание)имеет также большое значение для питания котлов высокого давления и, кроме того, в ряде химических производств (например, в химии чистых реактивов, в производстве фотоматериалов) и в пищевой промышленности. Так, с помощью ионитов очищают патоку в сахароварении, а в виноделии производят удаление излишков ионов Fe3+, Cu2+, Ca2+, вызывающих помутнение вина. В молочной промышленности иониты применяют для изменения солевого состава молока, в частности, для детского питания. Удаляя из коровьего молока избыток ионов кальция, его минеральный состав можно приблизить к составу женского молока, что существенно для искусственного вскармливания грудных детей.
С помощью ионообменной адсорбции можно извлекать из сточных вод ценные металлы, (например, уран, золото, серебро, медь и др.), а также металлы-загрязнители окружающей среды (например, кадмий, цинк, ртуть и др.).
Иониты
Ионитыили ионообменники– это вещества, способные к ионному обмену при контакте с растворами электролитов. Большинство ионитов являются твёрдыми, нерастворимыми в воде веществами.
Классификация ионитов:
- По знаку заряда обмениваемых ионов иониты подразделяют на катиониты (способные обмениваться катионами), аниониты (способные обмениваться анионами)и амфолиты (в зависимости от рН среды могут обмениваться или катионами, или анионами);
|
|
- По степени диссоциации катиониты могут быть сильнокислотными (они всегда диссоциированы и способны к ионному обмену при любых значениях рН) и слабокислотными (которые работают только в нейтральных и щелочных средах). Активными группами сильнокислотных катионитов обычно являются сульфогруппы -SO3H, слабокислотных – группы -ОН, -СООН. Аниониты соответственно подразделяются на сильнооснόвные и слабооснόвные (работающие только в нейтральных и кислых средах). Активными группами сильноосновных анионитов являются аминогруппы (первичные -NH 2, вторичные =NH и третичные ºN), слабоосновных – остатки четвертичных аммониевых оснований, например, N+(CH3)3Cl-.
- По химической природе каркаса катиониты и аниониты могут быть неорганическими, органическими и минерально-органическими (состоящими из органического полиэлектролита на неорганическом носителе или, реже, из неорганического ионита, диспергированного в полимерном связующем);
- По происхождению иониты могут быть природными и синтетическими
К природным ионитам относятся неорганические (например, цеолиты, минералы глин – каолинит, монтмориллонит и др.) и органические (например, целлюлоза, торф, шерсть, шёлк, гумусовые вещества почвы). К синтетическим - неорганические (SiO2, например, в виде аэросила, силикагель, Al2O3, сульфоуголь, пермутит Na2O · Al2O3 · 3SiO2 · 2H2O) и органические (ионообменные смолы, являющиеся важнейшими из всех ионитов в практическом отношении). Выпускаются иониты в виде зёрен различной формы, порошков, паст, тканей и других изделий, например, мембран. Применяются иониты для очистки, разделения и концентрирования веществ (например, сахара, лекарственных средств), для водоподготовки, очистки сточных вод. Кроме того, иониты используются в качестве носителей в хроматографии и гетерогенных катализаторов. В зависимости от целей исследования или другого процесса, связанного с использованием ионитов, они могут применяться в различных формах, называемых по виду ионов, обмениваемых с контактирующим раствором. Чаще всего катиониты применяют в Н- или Na-форме, аниониты – в ОН- или Cl-форме.
Главными физико-химическими характеристиками ионитов являются обменная ёмкость, механическая прочность и химическая стойкость. У органических, кроме того, немаловажным свойством является способность к набуханию (см. п. 10.4). Обменной ёмкостью называется число ммоль ионогенных групп, содержащихся в 1 г сухого ионита. Иными словами, обменная ёмкость показывает, какое количество ионов в миллиэквивалентах способен обменять на своей поверхности 1 грамм сухого ионита. Природные иониты имеют сравнительно малую обменную ёмкость, обычно не превышающую 0,2 – 0,3 мэкв/г. У синтетических ионитов она на порядок выше (3 – 5 мэкв/г), а у некоторых ионообменных смол может достигать 10 мэкв/г и более.
|
|
Проиллюстрируем механизм действия ионитов на примере умягчения и обессоливания воды.
 Карбонатная жёсткость природной воды обусловлена содержанием в ней гидрокарбонатов кальция и магния. Для извлечения ионовCa2+ и Mg2+ и замены их на ионы Na+, воду пропускают через колонку (например, стеклянную или чугунную трубу), заполненную катионитом в Na-форме. При этом на нём происходит реакция ионного обмена:
Карбонатная жёсткость природной воды обусловлена содержанием в ней гидрокарбонатов кальция и магния. Для извлечения ионовCa2+ и Mg2+ и замены их на ионы Na+, воду пропускают через колонку (например, стеклянную или чугунную трубу), заполненную катионитом в Na-форме. При этом на нём происходит реакция ионного обмена:
Na Na + Ca2+ + 2HCO3- =
= ==Ca + 2Na+ + 2HCO3-
Аналогично происходит замена ионами Na+ и ионов Mg2+ и из колонки выходит мягкая вода.
Для полного обессоливанияводу пропускают поочерёдно через колонки с катионитом в Н-форме и с анионитом в ОН-форме (или через одну колонку с амфолитом).
|
|
 H + Na+ + Cl- =
H + Na+ + Cl- =
 = Na + H+ + Cl-,
= Na + H+ + Cl-,
 а анионит – все анионы, например, хлорид-ионы:
а анионит – все анионы, например, хлорид-ионы:
OH + H+ + Cl- =
= Cl + H2O.
Таким образом, из колонки с анионитом выходит уже практически чистая вода. Современные иониты позволяют получать обессоленную воду, содержание солей в которой бывает даже меньше, чем в дистиллированной.
После того, как обменная ёмкость ионита будет исчерпана, т. е. все способные к обмену ионы будут заменены другими ионами того же знака, ионит теряет работоспособность. Для приведения его в исходное состояние требуется регенерация,которая проводится выдерживанием отработанного ионита в растворе соответствующего вещества. Катиониты регенерируются в Н-форму длительным выдерживанием в достаточно концентрированном растворе кислоты (обычно HCl), в Na-форму – в растворе хлорида натрия. Аниониты регенерируются в ОН-форму выдерживанием в растворе щёлочи (сильноосновные - в растворе NaOH, слабоосновные - в растворе аммиака), в Cl-форму – в растворе NaCl.
Хроматография
|
|
|

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

Наброски и зарисовки растений, плодов, цветов: Освоить конструктивное построение структуры дерева через зарисовки отдельных деревьев, группы деревьев...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!