Фундаментальным вкладом в учение об адсорбции явилась теория И. Лэнгмюра(1914 – 18), основой которой являются следующие положения:
- на поверхности адсорбента имеются энергетически эквивалентные активные адсорбционные центры;
- молекулы адсорбтива адсорбируются на всей поверхности, а только на этих активных центрах (при этом они локализуются, т. е. не перемещаются по поверхности адсорбента);
- каждый активный центр взаимодействует только с одной молекулой адсорбата, так что при адсорбции образуется мономолекулярный слой;
- адсорбированные молекулы, находящиеся на каждом данном центре, не влияют на адсорбцию на других активных центрах, т. е. взаимодействием молекул адсорбата друг с другом можно пренебречь.
Наличие активных центров на твёрдых поверхностях подтверждается экспериментальными данными, полученными, в частности, при изучении гетерогенного катализа. А именно: даже при достижении максимальной адсорбции число молекул, располагающихся на поверхности, намного меньше, чем, если бы они покрывали всю поверхность плотным слоем. Более того, адсорбционные центры занимают, как правило, лишь очень небольшую долю поверхности адсорбента. В качестве адсорбционных центров могут выступать неровности, в особенности микроскопические выступы, а также участки с определённым взаимным расположением атомов в кристаллической решётке.
Исходя из указанных положений, Лэнгмюр вывел уравнение, описывающее изотерму адсорбции. Согласно предложенной им модели, процесс адсорбции - десорбции можно представить в виде обратимой квазихимической реакции между молекулами адсорбата (обозначенными Ÿ) и адсорбционными центрами (обозначенными ¡):
Ÿ + ¡ Û ¤.
(¤ - активный центр с адсорбированной на нём молекулой).
По мере увеличения концентрации адсорбирующегося вещества в соответствии с принципом Ле-Шателье равновесие в этой реакции сдвигается в сторону образования адсорбционного комплекса и свободных адсорбционных центров становится меньше. Константа адсорбционного равновесия К (без учета коэффициентов активности) равна
Переходя от этих условных обозначений к терминам учения об адсорбции, можно принять число активных центров, занятых молекулами адсорбата на единице поверхности, равным величине адсорбции А (т. е. С ¤ = А), число оставшихся свободными активных центров С ¡ равным разности А ¥ - А, где А¥ - ёмкость адсорбционного монослоя или величина предельной адсорбции. Заменим эти эквивалентные величины друг на друга, а также примем, что C Ÿ = С (С - равновесная концентрация адсорбтива в объёме газа):
 .
.
Решая это уравнение относительно величины адсорбции, получим уравнение Лэнгмюра:

Так как концентрации газов и паров пропорциональны парциальным давлениям соответствующих компонентов, то уравнение Лэнгмюра может быть выражено и через равновесное парциальное давление адсорбирующегося вещества р:

На практике часто используется другая форма уравнения Лэнгмюра, получаемая из выведенной выше путём деления правой части на К:
 (3.1)
(3.1)
и, соответственно
 , (3.2)
, (3.2)
где b – т. н. адсорбционный коэффициент (b = 1/ K).
Из уравнений (3.1) и (3.2) следует, что адсорбционный коэффициент имеет размерность концентрации или, соответственно, адсорбции. Чтобы выяснить физический смысл этой концентрации, заменим в уравнении (2.1) b на C:

и решим его относительно А:
 . (3.3)
. (3.3)
Таким образом, адсорбционный коэффициент b численно равен такой равновесной концентрации (или равновесного парциального давления) адсорбтива, при которой величина адсорбции составляет половину предельного значения.
Уравнение Лэнгмюра в принципе является строгим в термодинамическом отношении и в принципе может хорошо описывать все участки изотермы адсорбции. Так, при очень малых концентрациях (давлениях) адсорбтива, когда C << b (или р << b), величиной С (р) в знаменателе уравнений (2.1) и (2.2) можно пренебречь. Тогда эти уравнения переходят в уравнения прямой, проходящей через начало координат, т. е. превращаются в уравнения Генри и пригодны для описания начального участка изотермы. При очень больших значениях равновесных концентрации или давления, когда C >> b (или р >> b), в знаменателе можно пренебречь величиной b. При этом уравнения приобретают вид
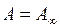
и, таким образом, соответствуют третьему участку изотермы, когда адсорбция достигает предельного значения и перестаёт зависеть от концентрации (давления) адсорбтива.
Вместе с тем уравнение Лэнгмюра из-за того, что оно основано на идеализированной модели, не всегда соответствует реально наблюдаемым величинам адсорбции. Иными словами, построенная на его основе теоретическая изотерма адсорбции (т. н. изотерма Лэнгмюра) может заметно отличаться от экспериментальной. Лучше всего уравнение Лэнгмюра подходит для описания адсорбции на сравнительно гладких поверхностях.
Интересно отметить, что в полярографии отмечается зависимость высоты так называемых адсорбционных пиков от концентрации, идеально подчиняющаяся уравнению Лэнгмюра. Это говорит о том, что уравнение пригодно для описания адсорбции даже на жидкой поверхности, какой является идеально гладкая поверхность ртутной капли.
В уравнение Лэнгмюра входят две константы: А¥ и К (или b), являющиеся индивидуальными характеристиками процесса адсорбции каждого отдельного вещества на каждом адсорбенте. Для того, чтобы можно было с помощью этого уравнения теоретически рассчитывать величину адсорбции, необходимо заранее вычислять значения констант. Это делается на основе сравнительно небольшого числа экспериментальных данных, полученных при заданной температуре. Вычисление констант обычно проводится графическим путём. При этом используется то обстоятельство, что уравнение Лэнгмюра может быть преобразовано в линейную форму путём деления единицы на обе его части:

или  (3.4)
(3.4)
Таким образом, оно превращается в уравнение прямой, не проходящей через начало координат (вида y = ax + b).
По нескольким экспериментальным данным строится график зависимости 1/ А от 1/ С (или от 1/ р) (рис. 3.3). Усредняющая прямая, соединяющая точки, экстраполируется на ось ординат. При этом от неё отсекается отрезок OМ, равный 1/ А¥. Отсюда следует, что А¥ = 1/0М. Константа b может быть определена различными способами. Так, тангенс угла
Рис. 3.3. Графическое определение констант уравнения Лэнгмюра
наклона графика к оси абсцисс равен b / A¥. Значит, определяя тангенс, можно с помощью уже известной А¥ вычислить и b.
Можно также с учётом уравнения (3.3) сделать дополнительное построение – отложить на оси ординат отрезок МК, равный 0М. Тогда отрезок 0К окажется равным 2/ А¥. Интерполяцией находится соответствующая ему точка L, а отрезок 0L при этом равен 1/ b. Значит, b = 1/0L.
Константы А¥ и b можно легко определить и по экспериментальной изотерме адсорбции (рис. 3.4).
А¥ определяется по положению горизонтального участка изотермы. А затем с учётом уравнения (3.3) на оси ординат откладывается отрезок 0К, равный 1/ А¥. Затем на оси абсцисс интерполяцией находится точка, соответствующая значению b. Однако такой способ определения констант возможен лишь при наличии данных для построения полной изотермы адсорбции.
Рис. 3.4. Определение константы b уравнения Лэнгмюра
с помощью изотермы адсорбции
Уравнение Фрёйндлиха
Существует еще одно уравнение, описывающее изотерму адсорбции, называемое уравнением Г. Фрёйндлиха (1906):
 или
или 
где k и 1/ n – константы. (Константа, являющаяся показателем степени, обычно записывается в виде 1/ n, а не n, чтобы подчеркнуть, что равновесная концентрация или равновесное давление возводится в степень, которая всегда бывает меньше единицы).
Уравнение Фрёйндлиха является эмпирическим, т. е. за ним не стоит строгой теории. Оно было выбрано среди других уравнений как уравнение параболы, по виду напоминающей изотерму адсорбции. Потому теоретическая изотерма, построенная с его помощью, совпадает с экспериментальной только в области средних концентраций. В области же малых и, в особенности, очень больших концентраций (давлений) наблюдаются значительные расхождения между экспериментом и теоретически предсказанными величинами адсорбции. Однако в практической деятельности редко приходится иметь дело с такими областями концентраций. Поэтому уравнение Фрёйндлиха в силу его простоты и лёгкости определения констант, используется очень широко. Особенно часто его используют при исследовании адсорбции на пористых и порошкообразных адсорбентах.
Уравнение Фрейндлиха линеаризуется с помощью логарифмирования:
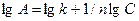
или  .
.
С учётом этого для графического определения констант по нескольким экспериментальным данным строится логарифмическая изотерма адсорбции в координатах lg A - lg C или, соответственно lg A - lg р (рис. 3.5). В этом случае график при экстраполяции отсекает от оси ординат отрезок ОМ, равный lg k (т. е. k = 100М), а тангенс угла наклона его к оси абсцисс равен 1/ n.
Рис. 3.5. Графическое определение констант уравнения Фрёйндлиха



 .
.

 (3.1)
(3.1) , (3.2)
, (3.2)
 . (3.3)
. (3.3)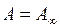

 (3.4)
(3.4)

 или
или 
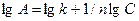
 .
.


