

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...
Топ:
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Устройство и оснащение процедурного кабинета: Решающая роль в обеспечении правильного лечения пациентов отводится процедурной медсестре...
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Лечение прогрессирующих форм рака: Одним из наиболее важных достижений экспериментальной химиотерапии опухолей, начатой в 60-х и реализованной в 70-х годах, является...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Абсорбция.
Абсорбция - процесс поглощения газов из газовых смесей жидким поглотителем (абсорбентом).
1 Физическая – поглощаемый газ (абсорбтив) химически не взаимодействует с абсорбентом.
2 Хемосорбция - химическое взаимодействие между абсорбентом и поглощаемым компонентом газовой смеси.
В большинстве случаев абсорбция – процесс обратимый. Обратный процесс-десорбция. Это позволяет многократно использовать абсорбент и выделять поглощаемый компонент в чистом виде.
Процесс используют для:
1. Извлечения ценных компонентов из газовых смесей;
2. для очистки газов от вредных примесей.
Равновесие при абсорбции определяется законом Генри (см. лекции),согласно которому парциальное давление компонента в состоянии равновесия пропорционально его состоянию в жидкой фазе:

На полноту абсорбции влияют внешние условия - температура и давление(P и T).

 >
>  >
> 
 <
<  <
< 
Где Е - константа Генри. С увеличением температуры величина Е тоже увеличивается.
Чем выше температура, тем меньше растворимость газа. Поэтому абсорбцию выгоднее проводить при низких температурах. Давление влияет на растворимость газов в жидкости в соответствии с принципом Ле-Шателье. Растворимость газов в жидкости сопровождается уменьшением объема. Поэтому повышенное давление приводит к сдвигу равновесия в сторону увеличения растворимости
 =
=  x=mx,
x=mx,
Где m- коэффициент распределения (см. выше).
Замечание: закон Генри выведен для идеальных систем. Однако он может быть использован при расчетах процессов абсорбции, если концентрация растворенного вещества в жидкости, а так же в газе не значительны. В противном случае линия равновесия строится по опытным данным и является кривой линией.
|
|
Кинетика абсорбции.
Процесс передачи массы вещества в жидкость сопровождается:
I. Подходом газа из ядра потока к границе раздела фаз, т.е. массоотдача
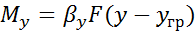 ;
;
II. Растворение газа в пленке жидкости
Перенос вещества от границ в ядро потока
 ;
;
Кинетика процесса абсорбции (скорость) будет определяться:
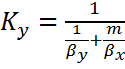 ;
;

где  и
и 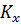 - коэффициенты массопередачи.
- коэффициенты массопередачи.
 ;
;
1.  - коэффициент массоотдачи находится из критерия Нусельта.
- коэффициент массоотдачи находится из критерия Нусельта.
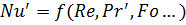 (см. выше)
(см. выше)
2. Движущая сила абсорбции
А) если линия равновесия прямая, то
 или
или 
Б) если линия равновесия кривая, то движущая сила процесса рассчитывается через число единиц переноса (ЧЕП)
ЧЕП находят либо графическим способом, либо графическим методом Бейкера.
Для абсорбции взаимное расположение рабочей линии и линией равновесия выглядит:

Рабочая линия всегда выше линии равновесия и они никогда не пересекаются.
Материальный баланс абсорбции. Расход абсорбента.


Типы насадок.
1) Седла

2) Хордовая насадка.

3) Кусковая насадка. Навалены куски кокса, кварца, пемзы.
4) Кольца Рашига.
5)  Плавающая насадка.
Плавающая насадка.

Перераспределяющее устройство.
Важный элемент насадочного абсорбера- распределяющее устройство.
 Эффект отдавливания жидкости к стенке приводит к резкому уменьшению поверхности смоченной насадки. Чтобы исключить этот эффект аппарат имеет в середине перераспределительное устройство.
Эффект отдавливания жидкости к стенке приводит к резкому уменьшению поверхности смоченной насадки. Чтобы исключить этот эффект аппарат имеет в середине перераспределительное устройство.
Гидродинамику см. выше.
По типу пробулькивания.
Через центральную трубу подается газ. Он побулькивает через слой жидкости, образуя сплошной пузырчатый слой.
Чем интенсивнее псевдокипение, тем больше поверхность массопередачи.
Достоинства: простота конструкции и обслуживания
Недостатки: низкие коэффициенты массопередачи, невозможно осуществить противоточный режим.
Используют в виде реакторов для осуществления реакций в системе газ-жидкость. Наиболее широкое распространение имеют процессы окисления.
|
|
Наиболее широкое распространение в химической промышленности получили тарельчатые абсорберы. В таких аппаратах колонного типа на определенном расстоянии друг от друга расположены горизонтальные перегородки (тарелки)
По типу тарелок различают:
Тарелки с переливными устройствами. К таким тарелкам относятся: колпачковые, сетчатые, клапанные, пластинчатые, с S-образными элементами.

Выбор тарелок зависит от выбранного процесса.
Тарельчатые аппараты всегда работают в режиме противотока.
Газ через прорези пробулькивает слой жидкости
1. Пузырьковый режим (скорость газа мала). При дальнейшем увеличении скорости газа 2. Пленочный режим. Жидкость и газ примерно в равном объеме – наиболее выгодный режим работы тарелки (максимальная поверхность контакта фаз). Наступает режим когда газ разрушает пену и наступает 3. Струйный режим работы- снижается поверхность контакта фаз. 4. Подвисание с последующим захлебыванием(газ не пропускает жидкость вниз)
Помимо барботажа на тарелках осуществляется горизонтальное движение жидкости.
При больших диаметрах колонных аппарата вместо круглых колпачков используются туннельные.
Достоинства: высокая поверхность массопередачи чему способствует направленное движение на тарелке.
Недостатки: часть полезной площади тарелки не используется. Необходимость высокой точности монтажа тарелки.
Тарелки с S-образными элементами.
Направление движения жидкости на тарелке создается за счет одностороннего входа газа.
Достоинства: дешевизна, нет необходимости точной настройки
 Ситчатые.
Ситчатые.

В тарелке просверлены отверстия диаметром от 1 до 2 мм. Газ проходит через отверстие образуя пенный слой. Обеспечивается вход газа через отверстия и выход жидкости через сливные устройства. В рабочем режиме не должно быть провала жидкости через отверстия.
Достоинства: очень высокоразвитая поверхность (пена равномерна). Эффективность работы выше чем у колпачковых и собирать и настраивать легче.
Недостатки: очень чувствительны к скорости газа. Скорость не должна превышать 1 м/с на полное сечение аппарата.
Пластинчатые.

Скорость движения газа между пластинами 20-30 м/с
Достоинства: каждая тарелка работает по принципу прямотока. Сопротивление снижается. Можно значительно увеличить нагрузку по жидкой и газовой фазе. Слабо чувствительны к загрязненным жидкостям
|
|
В целом работает противотоком
Недостатки: резкое падение эффективности при малых плотностях орошения.
Клапанные тарелки.

Достоинства: автоматическое регулирование зазора для прохода газа, что позволяет иметь высокий коэффициент массопередачи в широком диапазоне нагрузок.
Тарелки без переливных устройств.
Принципиальные отличия провальной тарелки заключается в названии. Жидкость и газ идут по одним и тем же отверстиям.
При малых скоростях газа сначала идет небольшой рост газа(жидкости на тарелке мало)

Точка А, когда жидкость начинает скапливаться на тарелке сопротивление возрастает, т. В начало режима подвисания. Т. С- точка захлебывания(жидкость практически не стекает по стенке тарелке).
Расчет абсорбера.
1. Насадочные.
2.Ступенчатые. Диаметр колонны из уравнения расхода. Высота через число теоретических тарелок и КПД или число действительных тарелок.
Распыливающие абсорберы.
Такие аппараты используются вследствие простоты.
Полая колонна. Газ подается в колонну. А жидкость разбрызгивается сверху.

Распыливающие устройство должно быть тонко настроено, т.к. если капли крупные, то поверхность контакта фаз минимальна. Быстрее пройдут через аппарат, минимальное время прохождения- снижается эффективность. Чем меньше частички разбрызгивания, тем больше брызго унос.
Применяется, когда наряду с абсорбцией идет хемосорбция или газ хорошо растворим в жидкости.
Абсорбер Вентури.
Жидкость подается и смешивается с газом. Аппарат работает в режиме прямотока. Резкое сужение приводит к тому, что в горловине появляются очень большие скорости и жидкость дробится в пыль. Там жидкость смешивается с газом. Резкое расширение приводит к снижению скорости и происходит разделение. Применяется в основном для процесса хемосорбции.

Схемы абсорбционных установок.
Промышленные схемы абсорбционных установок разделяют на:
1) Противоточные (жидкость и газ движутся на встречу друг другу) – такой тип контактирования применяют для насадочных, пленочных, тарельчатых, и других колоннах.
|
|


2) Прямоточные.
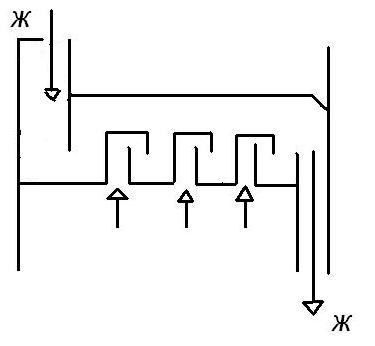
Жидкость и газ подаются в верхнюю часть колонны.
Одноступенчатые с рециркуляцией жидкости.


Жидкость частично возвращается в аппарат.
n-кратность циркуляции. Это отношение количества жидкости протекающей через аппарат к количеству жидкости первоначально подаваемой.
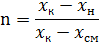
Рециркуляцию делают для того, что бы увеличить площадь орошения колонны – это приводит к наибольшему смачиванию насадки. Осуществляется промежуточное охлаждение жидкости (чтобы понизить температуру процесса абсорбции).
Как правило, в промышленности абсорбционные установки представляют собой последовательно соединенные аппараты (батареи абсорберов).
Жидкость которая стекает из первого абсорбера насосом подается охлажденная, как жидкость орошающая второй аппарат.
Многоступенчатая схема без рециркуляции.
Многоступенчатая схема с рециркуляцией.

Схемы с рециркуляцией более эффективны. Но приводят к увеличению расходов электроэнергии при перекачивании и к усложнению установки.
Перегонка жидкости.
- является одним из распространенных методов разделения однородных жидких смесей, состоящих из двух и большего числа летучих компонентов.
Различают два способа перегонки:
1. Простая перегонка или дистилляция.
2. Ректификация.
В широком смысле перегонка-это процесс частичного испарения разделяемой смеси и последующей конденсации образующихся паров. В простой перегонке этот процесс однократный.
Ректификация – многократное испарение. Образующийся конденсат имеет другой состав, отличающийся от первоначального.
Изменение состава жидкости после конденсации происходит вследствие разной летучести (фугитивности) компонентов смеси.
Легколетучий компонент будем называть низкокипящий компонент (НК).
Высококипящий (ВК) или низколетучий испарить труднее чем НК.
В ходе процесса перегонки паровая фракция обогащается НК компонентом. Конденсат этих паров – дистиллат, т.к. пары летят вверх, то дистиллат забирают сверху. То что осталось (остаток) обогащается по ВК.
Простая перегонка представляет собой процесс однократного испарения с последующей конденсацией пара обогащенного по НК. испарение идет в том случае, когда летучести компонентов существенно различаются. Процесс применяют на первичной стадии разделения (например перегонка нефти).
Ректификация – процесс разделения путем многократного испарения и многократной конденсации. Для того чтобы процесс был многократным необходимо на верх колонны подать жидкость, в качестве которой используется часть дистиллата – этот поток называется флегма.
|
|
Процессы перегонки и ректификации осуществляются либо в периодическом, либо в непрерывном режиме. Мы будем рассматривать самый простой вариант перегонки – разделение бинарных смесей (ВК и НК). Даже при такой простой перегонки существует несколько вариантов.
Идеальные смеси.
Если смесь бинарная, то при изменении трех параметров ( можно построить фазовую диаграмму типа:
можно построить фазовую диаграмму типа:
1. При постоянной температуре 
2. 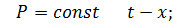
3. 
Идеальные смеси – такие бинарные смеси, которые подчиняются закону Рауля.
При постоянной температуре парциальное давление компонента в паре пропорционально мольной доле этого компонента в жидкости. Коэффициент пропорциональности – это давление насыщенного пара данного компонента при этой температуре.
а – НК
в – ВК

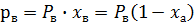
В процессах перегонки и ректификации все расчеты выполняются в мольных долях по НК. Закон Рауля выражают графически в виде  , зафиксировав постоянную температуру.
, зафиксировав постоянную температуру.

Пользуясь диаграммой  (при
(при  ) можно определить температуры кипения смеси различного состава.
) можно определить температуры кипения смеси различного состава.
 парциальное давление ВК.
парциальное давление ВК.
Если построить так же линии для более высоких температур. То соответственно 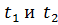 будут выглядеть:
будут выглядеть:
Отмечаем на оси  внешнее давление и проводим на оси х горизонтальную линию MN – линия внешнего давления в системе. Жидкость состава
внешнее давление и проводим на оси х горизонтальную линию MN – линия внешнего давления в системе. Жидкость состава 
В точке А сумма парциальных давлений равна общему давлению в системе, эта точка при которой система данного состава будет кипеть. 


По кипению жидкой фазы можно определить температуру кипения – это позволит построить еще одну диаграмму ( .
.

 - смесь, обогащенная по НК,
- смесь, обогащенная по НК,
 - смесь, обогащенная по ВК.
- смесь, обогащенная по ВК.
На этой же диаграмме построим зависимость  , т.е. состав пара – температура конденсации пара.
, т.е. состав пара – температура конденсации пара.



где  давление насыщенного пара компонента
давление насыщенного пара компонента  ;
;
 - мольная доля компонента
- мольная доля компонента  в жидкой фазе;
в жидкой фазе;
 - общее давление в системе (внешнее);
- общее давление в системе (внешнее);
 - мольная доля компонента
- мольная доля компонента  в паровой фазе.
в паровой фазе.
Эта диаграмма позволяет найти по составу жидкой фазы при ее температуре кипения состав пара при этой же температуре.

Мольная доля НК в паре больше чем в кипящей жидкости, т.е. пар обогащается по НК компоненту.

Диаграмма х-у (состав жидкости – состав пара).

Эта диаграмма строится при 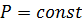 . Линия равновесия определяется уравнением:
. Линия равновесия определяется уравнением:

Где  -коэффициент летучести (определяется экспериментально). Поэтому линию равновесия и строят исходя из экспериментальных данных. Расположение
-коэффициент летучести (определяется экспериментально). Поэтому линию равновесия и строят исходя из экспериментальных данных. Расположение  и
и  определяется первым законом Коновалова: пар обогащается тем компонентом, при добавлении которого к жидкости, повышается давление пара над ней, т.е. снижается ее температура кипения.
определяется первым законом Коновалова: пар обогащается тем компонентом, при добавлении которого к жидкости, повышается давление пара над ней, т.е. снижается ее температура кипения.
Для идеальной жидкости линия равновесия – парабола.
Закон Коновалова дополняется первым законом Вревского, согласно которому при повышении температуры кипения раствора двух жидкостей, в парах возрастает относительное содержание того компонента, переход которого в парообразную фазу потребует большей затраты тепла.
Реальные смеси (РС).

1. С неограниченной взаимной растворимостью (спирт-вода);
2. С ограниченной взаимной растворимостью (20-30%);
3. Взаимно не растворимые (бензол-вода).
РС имеют отклонение от закона Рауля.
Если линия выпуклая по отношению к прямой, то такие смеси с положительным отклонением от закона Рауля. Если вогнутая - с отрицательным отклонением от закона Рауля.
Для  диаграмма х-Р, ху-t и ху строится по опытным данным.
диаграмма х-Р, ху-t и ху строится по опытным данным.
Для ряда смесей количественное отклонение от закона Рауля настолько велики, что приводят к качественным изменениям в свойствах этой смеси: при определенном составе жидкой фазы такие смеси имеют определенную температуру кипения. Причем эта температура может быть либо выше температуры кипения ВК, либо ниже температуры кипения НК. Такие смеси называют азеотропными.


Сдвинуть азеотропную точку в ту или иную сторону можно путем изменения внешнего давления в системе.
Направление сдвига определяется вторым законом Вревского: при повышении температуры азеотропной смеси, обладающей максимумом давления пара, в смеси увеличивается относительное содержание того компонента, парциально-мольная теплота которого больше - ВК. Для смеси с минимумом давления пара возрастет содержание того компонента, парциально-мольная теплота которого меньше – НК.
Перегонка с водяным паром.
- используется для понижения температуры кипения смеси с целью исключения термического разрушения нестойких веществ.
Суть: один из компонентов смеси образует с водой азеотропную смесь, как правило взаимно не растворимую, температура кипения образующегося азеотропа постоянна и ниже температуры кипения чистых компонентов.

Исходная смесь загружается в куб и нагревается с помощью глухого пара. Затем подается острый пар, который является дополнительным греющим агентом и образует азеотроп с НК в смеси. При температуре кипения азеотропа пары отводятся в конденсатор, далее в сепараторе происходит разделение двух несмешивающихся слоев жидкости.
Ректификация.
С ее помощью возможно значительно более четкое разделение смеси на НК и ВК.

Физическая сущность
Ректификация может осуществляться либо в периодическом, либо в непрерывном режиме.
Схема периодической ректификации.

После конденсации паров, часть возвращается в аппарат. В куб загружается смесь, за счет нагрева смеси в кубе происходит образование паров, которые образуют восходящий поток. Флегма является практически чистым НК и создает нисходящий поток по колонне. Т.к. процесс периодический, значит смесь изменяет свой состав, образуется несколько фракций.
Наиболее широкое распространение в химической технологии получила непрерывная ректификация.

В отличии от периодической ректификации, исходная смесь поступает в среднюю часть аппарата на тарелку питания. Это позволяет снизить теплоту нагревания на куб и увеличить эффективность разделения смеси вверху колонны до практически чистого НК. Тарелка питания делит аппарат на две части: исчерпывающую и укрепляющую часть колонны.
Принцип работы
Исходная смесь подается в колонну при температуре кипения. Обогрев колонны происходит в кубе, используются пары создающие восходящий поток пара. На каждой ступени контакта(в тарелке) происходит конденсация и последующее испарение жидкости другого состава. Тем самым пар обогащается по НК на каждой ступени все больше. Поток флегмы создает нисходящий поток жидкости. Т.к. флегма практически чистый НК, то в верхней части происходит укрепление паров по НК. Затем в дефлегматоре происходит конденсация паров с последующим разделением на дистиллят и флегму (их концентрации равны).
Абсорбция.
Абсорбция - процесс поглощения газов из газовых смесей жидким поглотителем (абсорбентом).
1 Физическая – поглощаемый газ (абсорбтив) химически не взаимодействует с абсорбентом.
2 Хемосорбция - химическое взаимодействие между абсорбентом и поглощаемым компонентом газовой смеси.
В большинстве случаев абсорбция – процесс обратимый. Обратный процесс-десорбция. Это позволяет многократно использовать абсорбент и выделять поглощаемый компонент в чистом виде.
Процесс используют для:
1. Извлечения ценных компонентов из газовых смесей;
2. для очистки газов от вредных примесей.
Равновесие при абсорбции определяется законом Генри (см. лекции),согласно которому парциальное давление компонента в состоянии равновесия пропорционально его состоянию в жидкой фазе:

На полноту абсорбции влияют внешние условия - температура и давление(P и T).

 >
>  >
> 
 <
<  <
< 
Где Е - константа Генри. С увеличением температуры величина Е тоже увеличивается.
Чем выше температура, тем меньше растворимость газа. Поэтому абсорбцию выгоднее проводить при низких температурах. Давление влияет на растворимость газов в жидкости в соответствии с принципом Ле-Шателье. Растворимость газов в жидкости сопровождается уменьшением объема. Поэтому повышенное давление приводит к сдвигу равновесия в сторону увеличения растворимости
 =
=  x=mx,
x=mx,
Где m- коэффициент распределения (см. выше).
Замечание: закон Генри выведен для идеальных систем. Однако он может быть использован при расчетах процессов абсорбции, если концентрация растворенного вещества в жидкости, а так же в газе не значительны. В противном случае линия равновесия строится по опытным данным и является кривой линией.
Кинетика абсорбции.
Процесс передачи массы вещества в жидкость сопровождается:
I. Подходом газа из ядра потока к границе раздела фаз, т.е. массоотдача
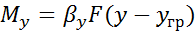 ;
;
II. Растворение газа в пленке жидкости
Перенос вещества от границ в ядро потока
 ;
;
Кинетика процесса абсорбции (скорость) будет определяться:
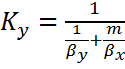 ;
;

где  и
и 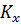 - коэффициенты массопередачи.
- коэффициенты массопередачи.
 ;
;
1.  - коэффициент массоотдачи находится из критерия Нусельта.
- коэффициент массоотдачи находится из критерия Нусельта.
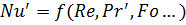 (см. выше)
(см. выше)
2. Движущая сила абсорбции
А) если линия равновесия прямая, то
 или
или 
Б) если линия равновесия кривая, то движущая сила процесса рассчитывается через число единиц переноса (ЧЕП)
ЧЕП находят либо графическим способом, либо графическим методом Бейкера.
Для абсорбции взаимное расположение рабочей линии и линией равновесия выглядит:

Рабочая линия всегда выше линии равновесия и они никогда не пересекаются.
Материальный баланс абсорбции. Расход абсорбента.


|
|
|

Своеобразие русской архитектуры: Основной материал – дерево – быстрота постройки, но недолговечность и необходимость деления...

Индивидуальные и групповые автопоилки: для животных. Схемы и конструкции...

Индивидуальные очистные сооружения: К классу индивидуальных очистных сооружений относят сооружения, пропускная способность которых...

Особенности сооружения опор в сложных условиях: Сооружение ВЛ в районах с суровыми климатическими и тяжелыми геологическими условиями...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!