

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...
Топ:
Генеалогическое древо Султанов Османской империи: Османские правители, вначале, будучи еще бейлербеями Анатолии, женились на дочерях византийских императоров...
Процедура выполнения команд. Рабочий цикл процессора: Функционирование процессора в основном состоит из повторяющихся рабочих циклов, каждый из которых соответствует...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Интересное:
Наиболее распространенные виды рака: Раковая опухоль — это самостоятельное новообразование, которое может возникнуть и от повышенного давления...
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Мероприятия для защиты от морозного пучения грунтов: Инженерная защита от морозного (криогенного) пучения грунтов необходима для легких малоэтажных зданий и других сооружений...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Цель работы: Проведите синтез и фильтрование под уменьшенным давлением осадка: а) гидроксида алюминия; б) гидроксида железа (III); в) гидроксида меди (II).
Реактивы: а) раствор хлорида, сульфата или нитрата алюминия, водный раствор аммиака; б) раствор хлорида железа(III), раствор гидроксида натрия; в) раствор сульфата меди(II), раствор гидроксида натрия.
Приборы и материалы: плоскодонная колба на 200 мл для синтеза, фильтровальная бумага, прибор для фильтрования под уменьшенным давлением.
Выполнение работы.
Для проведения синтеза вещества, указанного преподавателем, в плоскодонную колбу наливают растворы соответствующих реактивов до получения осадка и перемешивают содержимое вращением колбы или стеклянной палочкой. После этого собирают прибор для фильтрования под уменьшенным давлением, изображенный на рис. 45. Он состоит из фарфоровой воронки Бюхнера, вставленной через резиновую пробку в колбу Бунзена, вакуумный насос и предохранительной склянку (ее может и не быть), помещенной между колбой Бунзена и вакуумным насосом. В качестве вакуумного насоса можно использовать водоструйный насос, масляный вакуумный насос с электрическим приводом, ручной насос Комовского.

Рис. 45. Фрагмент прибора для фильтрования под уменьшенным давлением:
1 – воронка Бюхнера, 2 – колба Бунзена.
В воронку Бюхнера на перфорированную фарфоровую перегородку укладывают двойной слой фильтровальной бумаги. Для того чтобы наметить линию отреза, поверх воронки укладывают два листа фильтровальной бумаги и надавливают на них ладонью руки. По полученной отметке, отступив от нее внутрь круга несколько больше толщины стенки воронки, из первого листа фильтровальной бумаги вырезают кружок. Затем из второго листа вырезают кружок диаметром на 3 – 4 мм меньше первого. На перфорированное дно воронки вначале выкладывают фильтр меньшего диаметра, а затем большего. Уложенные друг на друга кружки фильтровальной бумаги не должны наслаиваться на боковые стенки воронки и отстоять от них примерно на 1 мм. Кружки смачивают дистиллированной водой и кратковременно включают насос. Листы фильтровальной бумаги в результате плотно прилягут к горизонтальной перегородке с отверстиями.
|
|
Приготовив взвесь для фильтрования и стеклянную палочку, включают вакуумный насос и по стеклянной палочке наливают суспензию, направляя поток вначале в центральную часть фильтра, а далее равномерно распределяя ее по всей поверхности фильтра. Откачивание прекращают, когда в колбу Бунзена из воронки Бюхнера с осадком перестанет поступать жидкость.
Уровень жидкости в колбе Бунзена во время фильтрования не должен доходить до бокового отростка. По мере ее накопления колбу периодически опорожняют, предварительно отключив насос и сняв воронку Бюхнера с осадком. Снятую воронку не кладут на стол, а ставят в вертикальном положении в фарфоровый стакан или в кольцо лабораторного штатива.
После окончания фильтрования колбу Бунзена отсоединяют от склянки и насоса и вынимают воронку из колбы. Осадок вместе с фильтровальной бумагой извлекают из воронки стеклянной палочкой или фарфоровым шпателем. Колбу Бунзена и воронку Бюхнера промывают водопроводной водой, ополаскивают дистиллированной водой и оставляют на рабочем месте.
В отчете отмечают цвет и консистенцию полученного осадка, а также отмечают наблюдения за процессом фильтрования. Записывают уравнение происходящей реакции.
Перекристаллизация
Цель работы: Проведите очистку 15 г: а) хлорида аммония, б) сульфата калия, в) сульфата аммония перекристаллизацией из водного раствора и рассчитайте выход очищенной соли.
|
|
Реактивы: дистиллированная вода, хлорид аммония, сульфат калия, сульфат аммония.
Приборы и материалы: плоскодонная колба на 100 мл, водяная баня, мерный цилиндр, электрическая плитка.
Выполнение работы.
Очистка твердых химических веществ перекристаллизацией позволяет отделить растворимую примесь от растворимого вещества. Процесс основан на различной растворимости основного вещества и загрязняющих его примесей в соответствующем растворителе или смеси растворителей. Для проведения очистки приготавливают горячий концентрированный раствор очищаемого вещества, близкий к насыщенному. Поскольку растворимость большинства веществ при уменьшении температуры снижается, то при охлаждении исходного раствора получится пересыщенный раствор основного вещества, из которого самопроизвольно выпадают кристаллы очищаемого вещества. Поскольку примесей в основном веществе немного, то по отношению к ним насыщенного раствора не образуется, так что примесь сможет остаться в растворе. Некоторая небольшая часть примеси на практике оказывается в очищаемом веществе за счет процессов сокристаллизации, адсорбции и окклюзии.
Перекристаллизация включает несколько стадий: приготовление концентрированного раствора очищаемого вещества, фильтрования горячего раствора для отделения нерастворимых примесей и оставшихся нерастворенными кристаллов, охлаждения раствора для достижения пересыщения, кристаллизации очищаемого вещества, отделения кристаллов от маточного раствора, удаления растворителя высушиванием. Часто перед фильтрованием горячий раствор обрабатывают активным углем с целью его обесцвечивания и удаления коллоидных взвесей. В ряде случаев необходимая очистка твердого вещества достигается лишь в результате повторной (многократной) перекристаллизации.
Для приготовления насыщенного раствора соли, указанной преподавателем, рассчитывают массу воды, которую необходимо добавить к 15 г исходной безводной соли для получения насыщенного при 80 °С раствора. Полученное значение массы нужно проверить у преподавателя. Растворимости некоторых солей приведены в табл. 3.
Табл. 3. Зависимость растворимости некоторых солей от температуры.
| Соль | Температура, °С | |||||
| Растворимость соли (в граммах безводной соли на 100 г воды) | ||||||
| NH4Cl | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 |
| K2SO4 | 7.35 | 11.11 | 14.76 | 18.17 | 21.4 | 24.1 |
| (NH4)2SO4 | 70.1 | 75.4 | 81.2 | 87.1 | 94.1 | 101.7 |
|
|
На техно-химических весах взвешивается заданное количество твердого вещества, которое переносят в химический стакан и добавляют отмеренный мерным цилиндром рассчитанный объем дистиллированной воды. Стакан с раствором помещают на песчаную баню и нагревают при перемешивании практически до кипения. Нагревание прекращают при появлении на поверхности жидкости небольшой корочки мелких кристаллов. Если вещество полностью не растворится, то добавляют дополнительную порцию дистиллированной воды. Если и после этого количество нерастворившегося вещества не уменьшится, то следует прибегнуть к горячему фильтрованию.
Горячее фильтрование проводят, используя металлическую воронку с двойными стенками (рис. 46), внутрь которой вставлена стеклянная воронка с фильтром. За счет нагревания отростка газовой горелкой либо съемным электронагревателем в металлической рубашке во время фильтрования находится постоянно подогреваемый теплоноситель, например, поддерживается кипение воды. Нагретую взвесь наливают по стеклянной палочке на фильтр. Отфильтрованный раствор стекает в приемник.


Рис. 46. Проведение горячего фильтрования: 1 – металлическая воронка с двойными стенками, 2 – обогреваемый отросток, 3 – стеклянная воронка с бумажным фильтром.
Стакан с отфильтрованным раствором охлаждают сначала на воздухе, а далее в сосуде с холодной водой. Выпавшие кристаллы отделяют от маточного раствора при помощи фильтрования на складчатом фильтре, промывают несколькими порциями охлажденной дистиллированной воды и высушивают на воздухе до рассыпчатого состояния. После высушивания определяют массу очищенной соли и рассчитывают выход продукта.
Перегонка
Цель работы: Проведите очистку 50 мл водопроводной воды перегонкой и рассчитайте выход дистиллята.
Реактивы: водопроводная вода с добавкой одной капли раствора FeCl3, раствор роданида калия KNCS или роданида аммония NH4NCS.
Приборы и материалы: прибор для перегонки, кипелки, электрическая плитка.
|
|
Выполнение работы.
Простая перегонка сводится к частичному испарению кипящей жидкой смеси, полному отводу и конденсации образовавшихся при этом паров. Как правило, простую перегонку применяют для разделения термически устойчивых жидких веществ от нелетучих примесей и веществ, сильно отличающихся по температуре кипения, для отделения жидкости от растворенных в ней твердых веществ, для концентрирования растворов, для очистки сжиженных газов.
Для проведения перегонки собирают прибор, изображенный на рис. 47. Он состоит из колбы Вюрца с трубкой для отвода паров кипящей жидкости в холодильник, термометром, нисходящим холодильником, аллонжем и приемником дистиллята.

Рис. 47. Установка для простой перегонки.
В колбу Вюрца емкостью 100 мл через отверстие для термометра с помощью воронки с длинным носиком наливают 50 мл водопроводной воды, измерив ее объем мерным цилиндром. Затем в ту же колбу помещают кипелки - кусочки фарфора или стеклянные капилляры. Они, касаясь изнутри внутренней поверхности колбы Вюрца, образуют центры парообразования и обеспечивают равномерное кипение содержимого колбы (перегонного куба) без толчков и внезапного вскипания жидкости. Кипелки обычно используют один раз.
При сборке прибора термометр устанавливают так, чтобы верхняя часть его ртутного резервуара находилась на уровне нижнего края отверстия отводной трубки колбы. В этом случае ртутный резервуар хорошо омывается парами перегоняемой жидкости, и показания термометра соответствуют температуре кипения жидкости. На конце ртутного резервуара термометра при перегонке должна удерживаться и периодически падать вниз капля конденсата. Ее отсутствие в ходе перегонки указывает на то, что пар перегрет, и термометр показывает температуру, превышающую температуру кипения жидкости.
Движение охлаждающей воды в холодильнике всегда направляют снизу вверх, к более горячей части внутренней его трубки. При подаче охлаждающей воды в обратном направлении она стекает по наружной трубке, не охватывая внутреннюю трубку, подлежащую охлаждению. В лучшем случае такой холодильник работает менее эффективно, чем воздушный той же длины. В худшем случае от механических напряжений, вызванных перепадом температуры, холодильник растрескивается.
Колбы с перегоняемой жидкостью нагревают в колбонагревателях, газовыми горелками, в жидкостных банях и песчаных банях. Скорость перегонки считают нормальной, если из холодильника стекает примерно одна капля конденсата за 2 – 3 с. До конца перегонять жидкость не рекомендуют, чтобы не допустить растрескивания куба и разложения кубового остатка. Перегонку прекращают, когда в колбе остается немного жидкости.
|
|
Полученный дистиллят собирают, и при помощи мерного цилиндра измеряют его объем. По этим данным рассчитывают выход. Отделение примеси ионов железа от воды перегонкой подтверждают качественной реакцией с роданид-ионами. Сравнивают интенсивность окраски, вызываемой добавлением роданид-ионов к исходной воде до перегонки и к полученному дистилляту.
В отчете отмечают внешний вид исходной жидкости и полученного дистиллята, формулируют заключение об эффективности очистки воды от ионов железа на основании качественной реакции, приводят расчет выхода очищенной воды и примерную скорость перегонки, выраженную числом капель дистиллята в минуту.
Возгонка
Цель работы: Проведите очистку 0.5 г бензойной кислоты методом сублимации и рассчитайте выход продукта.
Реактивы: бензойная кислота.
Приборы и материалы: фарфоровая чашка, стеклянная воронка, фильтровальная бумага, песчаная баня.
Выполнение работы.
Возгонка (сублимация) – процесс превращения твердого вещества в пар, минуя жидкое состояние. Процесс, обратный возгонке, называется десублимацией. Возгонка позволяет очистить летучее твердое вещество от нелетучей примеси.
Для проведения возгонки взвесьте на техно-химических весах 0.5 г бензойной кислоты и поместите ее в фарфоровую чашку, закрытую листком фильтровальной бумаги с несколькими отверстиями в нем. Далее поверх бумаги поместите воронку широким концом книзу, диаметр которой несколько меньше диаметра чашки (рис. 48).

Рис. 48. Прибор для возгонки:
1 – стеклянная воронка, 2 – фильтровальная бумага, 3 – фарфоровая чашка.
После сборки прибора аккуратно поместите его на песчаную баню под тягу и продолжайте нагревать до тех пор, пока основная масса вещества из чашки не возгонится. Далее, захватив пинцетом или зажимом за чашку, перенесите прибор в сборе на керамическую плитку для его охлаждения. После полного охлаждения аккуратно снимите воронку и лист бумаги, так, чтобы возгон с воронки не попал обратно в чашку. Стеклянной палочкой соберите на фильтровальную бумагу очищенное вещество со стенок воронки и взвесьте его на техно-химических весах. Исходя из значений масс исходной навески и возгона, рассчитайте выход продукта.
В отчете отразите цвет исходной и полученной в результате сублимации бензойной кислоты, а также форму очищенных кристаллов. Отметьте время, необходимое для выполнения возгонки.
Титрование
Цель работы: Определите концентрацию раствора кислоты или щелочи, выданного инженером практикума, методом титрования и рассчитайте доверительный интервал полученного значения.
Реактивы: раствор кислоты либо щелочи, раствор кислоты либо щелочи с известной концентрацией (0.1 н.), раствор индикатора (фенолфталеин, метиловый оранжевый или лакмус).
Приборы и материалы: бюретка для титрования, пипетка Мора объемом 10 или 20 мл, груша, воронка, стаканчик на 50 мл, плоскодонная коническая колба для титрования на 150 мл.
Выполнение работы:
Определение концентрации раствора кислоты или щелочи выполняется при помощи титрования. Он применяется, если известны объемы растворов реагирующих веществ и концентрация одного из реагентов.
В плоскодонную колбу или стакан на 200 мл у инженера практикума получите раствор кислоты либо щелочи, концентрацию которого следует определить. Также получите у инженера раствор щелочи либо кислоты с известной концентрацией, т.е. стандартный (титрованный) раствор.
Приготовьте к работе бюретку для титрования, установив зажим или закрыв кран. Ополосните бюретку небольшим объемом стандартного раствора, после чего вылейте этот раствор в слив через нижний конец бюретки, открыв зажим или кран.
Укрепите бюретку в штативе и через воронку залейте в нее титрованный раствор несколько выше нулевого деления. Снимите воронку, исключая таким образом попадание капель стандартного раствора в бюретку в ходе титрования.
Удалите пузырьки воздуха из нижнего кончика бюретки. Попробуйте полностью открыть зажим бюретки и получить сильную струю жидкости в подставленный стакан или колбу. Если вытеснить воздух таким способом не удается, то погрузите оттянутый кончик бюретки в стакан со стандартным раствором, присоедините резиновую грушу через резиновую трубку и пробку к верхнему отверстию бюретки и, приоткрыв кран, засосите немного жидкости. Пузырек воздуха при этом выйдет внутрь бюретки и далее в атмосферу. Для бюретки, оборудованной резиновой трубкой и краном, достаточно отвести от себя и соседей по лаборатории кверху стеклянный наконечник и, осторожно приоткрывая кран, вытеснить воздушный пузырек стандартным раствором.
Доведите уровень жидкости в бюретке до нуля, выпуская раствор по каплям через нижний конец бюретки и стараясь не оставлять капли на стенках бюретки. Отсчет уровня нужно вести по нижнему краю мениска (рис. 49). При этом глаз наблюдателя должен находиться на одной высоте с уровнем жидкости в бюретке.
Убедитесь в отсутствии течи раствора через кран или зажим. На кончике бюретки не должны образовываться капли. Бюретка готова к работе.
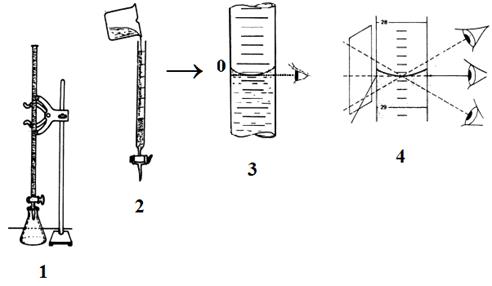
Рис. 49. Подготовка бюретки к титрованию:
1 – закрепление бюретки в штативе, 2 – заполнение бюретки титрованным раствором, 3 – доведение объема жидкости до нуля, 4 – иллюстрация неточности отсчета показаний, связанных с положением глаз наблюдателя.
Следующий этап – отбор точного объема раствора неизвестной концентрации пипеткой. Ополосните вымытую пипетку раствором, который нужно оттитровать. Для этого к верхнему отверстию пипетки присоедините сжатую резиновую грушу, погрузите нижний конец пипетки в раствор и наберите в пипетку жидкость выше метки. Следите за тем, чтобы нижний конец пипетки постоянно был погружен в жидкость. В противном случае попавший воздух забросит набранный раствор в резиновую грушу. Отсоедините грушу и вылейте содержимое пипетки в слив.
Отберите ополоснутой пипеткой точный объем раствора для титрования. С помощью груши наполните пипетку через нижнее отверстие на 2 – 3 см выше метки. Снимите грушу и закройте указательным пальцем верхнее отверстие пипетки, удерживая ее между большим пальцем с одной стороны и средним и безымянным пальцами той же руки с другой стороны (рис. 50). Для достижения герметичности указательный палец рекомендуется смочить водой, коснувшись выжатой мокрой тряпки. Избыток жидкости, находящийся выше метки, медленно сливают из пипетки, ослабив слегка нажим указательного пальца либо наклонив его. Хорошие результаты дает также вращение пипетки большим, средним и безымянным пальцами. Как только нижний край мениска коснется метки, расположенной на уровне глаз, отверстие пипетки вновь плотно закрывают, усилив нажим пальце на верхнее отверстие, и переносят кончик пипетки в предварительно ополоснутую дистиллированной водой колбу для титрования.
Вылейте содержимое пипетки в колбу для титрования, открыв верхнее отверстие пипетки. Во время сливания жидкости пипетку держат вертикально или слегка наклонив ее. Вытекание жидкости продолжается около одной минуты, причем на внутренней стенке пипетки не должно оставаться капель жидкости. Для обеспечения точности отбора объема выполните однократное длительное (в течение 10 – 15 секунд) касание дна колбы для титрования выше уровня жидкости, наклонив ее. Выньте пипетку из колбы, оставив каплю жидкости в носике.

Рис. 50. Порядок действий при отборе пробы с помощью пипетки.
Перед началом титрования в колбу для титрования с раствором неизвестной концентрации добавьте 2 – 3 капли раствора индикатора. Их окраска в различных средах и интервалы рН перехода указаны в табл. 4.
Табл. 4. Интервалы перехода важнейших кислотно-основных индикаторов.
| Индикатор | Окраска | Интервал перехода рН | |
| Кислотной формы | Щелочной формы | ||
| Фенолфталеин | Бесцветная | Малиновая | 8.2 – 10.0 |
| Лакмус | Красная | Синяя | 5.0 – 8.0 |
| Метиловый оранжевый | Розовая | Желтая | 3.0 – 4.4 |
После этого проводят ориентировочный опыт. Для этого небольшими порциями (по 0.5 мл) приливают титрованный раствор из бюретки в колбу с раствором неизвестной концентрации до изменения окраски индикатора. Раствор в колбе во время опыта следует все время перемешивать легким круговым движением (рис. 51). Как только индикатор изменит свою окраску, добавление реактива из бюретки нужно прекратить и произвести отсчет объема израсходованной жидкости с точностью до десятых долей миллилитра.

Рис. 51. Положение рук при титровании.
Повторите титрование еще три раза, более точно (по каплям) дозируя стандартный раствор вблизи конечной точки титрования (примерно за 0.5 ─ 0.7 мл перед ее достижением в ориентировочном или предшествующем опытах). Резкое изменение окраски индикатора от одной капли титрованного раствора является показателем конца реакции. При повторном титровании нужно, чтобы скорость добавления раствора из бюретки была по возможности одинаковой, т.е. в одно и тоже время вытекало бы определенное количество жидкости. Определить объем израсходованного реагента с точностью до сотых долей миллилитра.
Перед каждым очередным титрованием колбу необходимо вымыть и ополоснуть дистиллированной водой, а уровень жидкости в бюретке довести до нуля.
Полученные значения объемов заносят в лабораторный журнал и рассчитывают нормальную концентрацию раствора по формуле:
 ,
,
где Сн1 – нормальная (эквивалентная) концентрация неизвестного раствора, V1 – объем раствора с неизвестной концентрацией, равный объему пипетки, Сн2 – нормальная (эквивалентная) концентрация стандартного (титрованного) раствора, V2 – объем стандартного раствора, израсходованный на титрование и отсчитанный по бюретке.
Рассчитанные значения нормальной концентрации проверьте в препараторской практикума. В отчете отразите наблюдения по ходу титрования, а также приведите расчет доверительного интервала вычисленной нормальной концентрации.
|
|
|

Таксономические единицы (категории) растений: Каждая система классификации состоит из определённых соподчиненных друг другу...

Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰)...

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Состав сооружений: решетки и песколовки: Решетки – это первое устройство в схеме очистных сооружений. Они представляют...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!