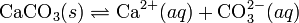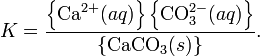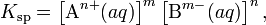Механизм гидролиза солей определяется взаимодействием ионов с их гидратной оболочкой. В молекуле воды (их гидратной оболочке) ослабляется связь между О и Н за счёт появления связи Э-О (при гидратации катионов) или О-Н (при гидратации анионов). Ослабленная связь легко разрывается и в раствор уходят либо гидроксид-ионы, либо протоны. В большинстве случаев гидролиз сопровождается изменением рН.
Виды гидролиза:
1.Соль образована слабой кислотой и слабым основанием (гидролиз протекает совместно) рН=7
К+А- <-> К+ + А-
К+А- + HOH <-> К+OH + HА-
2.Соль образована сильным основанием и сильной кислотой (гидролиз не протекает) рН=7
3.Соль образована слабым основанием и сильной кислотой (гидролиз протекает по катиону)
рН < 7 кислая среда
К+А- + HOH <-> КОН + Н+ + А-
4.Соль образована сильным основанием и слабой кислотой (гидролиз протекает по аниону) рН > 7
К+А- + HOH <-> HА- + К+ + ОН-
Степень гидролиза (h) – отношение числа молекул соли подвергшихся гидролизу е числу молекул растворённых.
h = hгид. / hраст.
Процесс гидролиза – обратимый процесс; протекает до тех пор, пока не образуется молекула. Гидролиз всегда протекает по слабому!
Произведение растворимости (ПР, Ksp) — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
При постоянной температуре в насыщенных водных растворах малорастворимых электролитов устанавливается равновесие между твердым веществом и ионами, образующими это вещество. Например, в случае для CaCO3 это равновесие можно записать в виде:
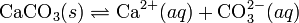
Константа этого равновесия рассчитывается по уравнению:
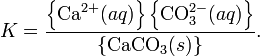
В приближении идеального раствора с учетом того, что активность чистого компонента равна единице, уравнение упрощается до выражения:

Константа равновесия такого процесса называется произведением растворимости.
В общем виде, произведение растворимости для вещества с формулой AmBn, которое диссоциирует на m ионов An+ и n ионов Bm-, рассчитывается по уравнению:
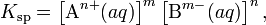
где [An+] и [Bm-] — равновесные молярные концентрации ионов, образующихся при электролитической диссоциации.
Из произведений растворимости можно рассчитать концентрации катионов и анионов в растворе малорастворимого электролита. Значения произведений растворимости приведены в справочниках.
Окислительно-восстановительные процессы.
Окислительно-восстановительные реакции, их виды. Методы составления уравнений окислительно-восстановительных реакций. Электродный потенциал, количественная оценка окислительной и восстановительной способности веществ. Гальванический элемент. Электролиз.
Эти реакции широко распространены в природе. Реакции горения, коррозия металлов, дыхание. В основе ОВР лежат реакции с переносом заряда. Переносчики зарядов – электроны.