Условия, необходимые для протекания химической реакции в форме горения или взрыва
Установлено 4 основных условия, которым должна удовлетворять химическая реакция, протекающая в режиме взрыва:
1. Экзотермичность реакции;
2. Образование газообразных продуктов;
3. Высокая скорость протекания реакции;
4. Способность к самораспространению.
Нужно заметить, что все эти условия не являются абсолютными и независимыми друг от друга. Например, отсутствие или наличие газов в продуктах реакции в известной степени обусловлено тепловым эффектом; способность к самораспространению в сильной степени зависит от скорости протекания реакции и теплового эффекта и т.д. [Андреев, Беляев ТВВ, 1960].
Первое условие. Экзотермичность реакции
При сопоставлении определений явлений горения и химического взрыва можно отметить, что химические реакции при горении и взрыве имеют некоторые общие характерные особенности.
Их протекание сопровождается выделением тепла. Если в результате химической реакции не выделяется заметного количества тепла, то такая реакция не может протекать в форме взрыва. Так, французский учёный Марсель Бертло (1827-1907 гг.) изучал разложение при нагревании оксалатов (солей щавелевой кислоты) различных металлов [1]. Результаты этих опытов представлены в табл. 1.1.
Таблица 1.1
Влияние теплового эффекта химической реакции на взрывчатость
Оксалатов металлов
| Уравнение химической реакции
| Тепловой эффект, кДж/моль
| Наличие взрывчатых свойств
оксалата
|
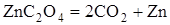
| -205,6
| Невзрывчатый
|
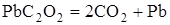
| -69,9
| Невзрывчатый
|

| +24,7
| Взрывчатость сомнительна
|
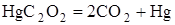
| +72,4
| Взрывчатый
|
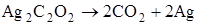
| +123,5
| Взрывчатый
|
Из приведенных данных видно, что реакции разложения, протекающие с поглощением тепла, не дают взрыва. Напротив, реакции, при которых выделяется значительное количество тепла, протекают со взрывом.
Отсюда следует, что первым необходимым условием того, чтобы химическая реакция могла протекать в форме горения или взрыва, является её экзотермичность, т.е. положительный тепловой эффект реакции.
Экзотермичность превращения ЭМ (ВВ) в продукты взрыва имеет различные причины.
Из табл. 1.1 видно, что теплóты образования продуктов реакции равны. Во всех реакциях образуется по два моля 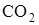 , а теплота образования элементов в виде простых веществ равна нулю, в тоже время тепловые эффекты реакций различны.
, а теплота образования элементов в виде простых веществ равна нулю, в тоже время тепловые эффекты реакций различны.
Это объясняется тем, что тепловой эффект реакции представляет собой разность между теплóтами образования из элементов продуктов реакции и исходного реагирующего вещества (реагента):
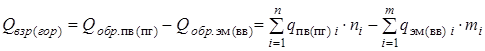 .
.
где
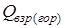
- теплота взрыва (горения) ЭМ (ВВ), кДж/моль (ккал/моль);
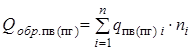 - суммарная теплота образования продуктов взрыва (горения) с учетом числа их грамм-молей -
- суммарная теплота образования продуктов взрыва (горения) с учетом числа их грамм-молей -  , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь  - теплота образования i -го продукта взрыва или горения;
- теплота образования i -го продукта взрыва или горения;
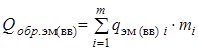 - суммарная теплота образования компонент ЭМ (ВВ) с учетом числа их грамм-молей -
- суммарная теплота образования компонент ЭМ (ВВ) с учетом числа их грамм-молей - 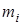 , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь 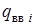 - теплота образования i -ой компоненты ЭМ (ВВ.
- теплота образования i -ой компоненты ЭМ (ВВ.
Например, взрывчатое превращение азида свинца протекает в соответствии с уравнением реакции
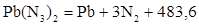 кДж.
кДж.
Разложение азида свинца протекает со взрывом, т.к. теплота образования азида свинца равна минус - 483,6 кДж/моль, а теплота образования продуктов взрыва равна нулю.
Хлористый азот распадается со взрывом по реакции
 .
.
Таким образом, если химическое соединение (реагент или ЭМ) является эндотермическим, т.е. образовалось из элементов с поглощением тепла, то при обратном процессе – распаде соединения на элементы (взрывчатом превращении) выделяется соответствующее количество тепловой энергии.
Теплота образования ЭМ (ВВ) или их компонент может быть эндотермичной, а ПВ (ПГ) - экзотермичной (например: гексоген 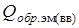 = - 93,4 кДж/моль, тетрил
= - 93,4 кДж/моль, тетрил 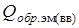 = - 55,7 кДж/моль).
= - 55,7 кДж/моль).
Теплота образования реагента ЭМ (ВВ) может быть положительна (например нитроглицерин: 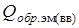 = 344,5 кДж/моль), но гораздо меньше, чем суммарная теплота образования ПВ (ПГ)
= 344,5 кДж/моль), но гораздо меньше, чем суммарная теплота образования ПВ (ПГ) 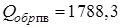 кДж/г-моль,
кДж/г-моль,
Откуда
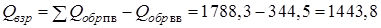 кДж/моль.
кДж/моль.
Поскольку продукты горения и взрыва в основном имеют положительные теплóты образования, то вещества с отрицательными теплóтами образования, способные к быстрой реакции с выделением тепла, с большой вероятностью могут оказаться взрывчатыми. Например, жидкая окись азота (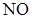 ), имеющая теплоту образования минус 90,4 кДж/моль (3014,5 кДж/кг), детонирует в стальной трубе со скоростью 5,62 км/с.
), имеющая теплоту образования минус 90,4 кДж/моль (3014,5 кДж/кг), детонирует в стальной трубе со скоростью 5,62 км/с.
Поэтому, когда теплота образования реагента велика, тепловой эффект реакции будет мал, или даже будет отрицательным (т.е. протекание данной реакции возможно лишь при подводе тепла извне).
Когда же теплота образования исходного вещества (ВВ или его компонент) невелика или имеет отрицательное значение, тепловой эффект реакции будет положительным, что делает возможным протекание реакции в форме горения или взрыва.
Чем больше выделяемая при взрыве теплота реакции и скорость ее распространения, тем больше энергия разрушения зарядов ВВ. Таким образом, теплота реакции взрывчатого превращения является критерием работоспособности ВВ – важнейшей его характеристикой.
Э кзотермичность реакции зависит от химической структуры вещества.
Экзотермичность превращения определяется тем, что прочность связей между атомами в продуктах превращения значительно больше, чем в самом ЭМ (ВВ).
Эндотермическими оказываются соединения в котором связаны атомы одного и того же элемента, т.н. эксплозофорные атомные группировки (Вант-Гофф [ФВ]).
В табл.1.2 приведены некоторые атомные группировки, сообщающие соединению взрывчатость (по Вант-Гоффу)
Таблица 1.2
| Группа
| Химические соединения
|
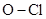
| хлораты и перхлораты
|
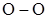
| озон, перекиси
|

| нитраты, нитриты, нитросоединения
|
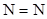
| азиды (азид свинца) и др.
|
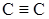
| ацетилен и его производные
|
Самораспространение реакции взрывчатого превращения является четвертым условием, определяющим взрывчатость ЭМ (ВВ).
Реакция взрывчатого превращения (детонация) распространяется с постоянной, характерной для данного ЭМ (ВВ) и условий взрывания (диаметр заряда, плотность и др.) скоростью, т.е. имеет место самораспространяющийся процесс, не требующий дополнительной энергетической подпитки.
Говоря проще, если с использованием инициирующего воздействия в небольшой части заряда ЭМ (ВВ) возбуждается химическая реакция, то она распространяется по всему заряду. При отсутствии способности химического превращения к такому самораспространению или при утрате ее ЭМ (ВВ) не может быть использовано в практических целях т.е в режиме нормальной детонации нормальной детонации (НД).
Например:
- при наличии в ЭМ (ВВ) значительного количества инертных добавок (пламегасители в предохранительных ВВ);
- при диаметре заряда менее критического;
- при чрезмерном уплотнении порошкообразных аммонитов;
- при старении нитроэфирных ВВ (экссудация нитроэфиров).
 Изменение скорости при прочих равных условиях значительно сказывается на эффекте действия взрыва. Так нитроглицерин в зависимости от некоторых условий детонирует со скоростью 8000 м/с и 2000 м/с.
Изменение скорости при прочих равных условиях значительно сказывается на эффекте действия взрыва. Так нитроглицерин в зависимости от некоторых условий детонирует со скоростью 8000 м/с и 2000 м/с.
На рис. 1.1. приведен результат оценки деформации свинцового столбика при испытаниях на бризантность (Проба Гесса).
Способность реакции взрывчатого превращения с самораспространению зависит не только от термохимических характеристик вещества (теплоты и скорости реакции), но определяется возможностью создания высокой концентрации энергии в слоях ЭМ (ВВ), соседних с первоначальным очагом реакции. Эта возможность зависит от других факторов, влияющих на развитие реакции и рассеивание энергии (давление, наличие и прочность оболочки, физико-механическая структура ЭМ (ВВ) и т.д.).
При самораспространении реакции значительную роль играет устойчивость молекул, точнее их реакционная способность, характеризуемая энергией активации (Е) – минимальной энергии, которую должна получить молекула, чтобы прореагировать (рассматривается позднее в разделе «Кинетическая теория газов»).
Необходимо заметить, что речь идет не об абсолютной величине энергии активации, а ее величины в соотношении с тепловой энергией реакции.
Современные ЭМ (ВВ) в большинстве своем являются сравнительно устойчивыми соединениями – они трудно воспламеняются и взрываются.
Как пример, можно привести пикриновую кислоту, которая на протяжении 100 лет использовалась как краска, прежде чем выяснилось, что это мощное ВВ! Тротил поджечь гораздо труднее, чем бумагу и тем более бензин. Аммиачная селитра и ее смеси с тротилом невозможно поджечь спичкой.
Особенностью явления взрыва является высокая концентрация энергии. При взрыве ВВ практически вся энергия взрыва (4¸6 МДж/кг) выделяется в объеме, занимаемом самим ВВ. Это обуславливает высокую концентрацию энергии, которая не достижима в условиях протекания обычных химических реакций.
Применяемые в промышленности конденсированные ВВ (твердые, жидкие или их смеси) плотностью 0,85÷1,5 г/см3 имеют наиболее высокую концентрацию энергии в единице объема.
В то же время по общему запасу энергии (при равных весовых количествах) ВВ не превосходят по энергии обычные горючие вещества таких как нефтепродукты, уголь, торф и др. Горение этих горючих веществ протекает сравнительно медленно, что приводит к значительному расширению продуктов реакции и к существенному рассеиванию выделяемой энергии путем теплопроводности и излучения. Только при взрыве достигается несравненно более высокая объемная концентрация или плотность энергии, особенно при взрыве конденсированных (твердых или жидких) ВВ.
В табл. 1.3 приведены значения объемной плотности энергии некоторых ВВ и горючих смесей [Ф.А.Баум, К.П.Станюкович, Б.И.Шехтер, Физика взрыва, 1959].
Таблица 1.3
| Наименование ВВ или горючей смеси
| Объемная плотность энергии, отнесенная к 1 л ВВ или горючей смеси, ккал/л
|
| Нитроглицерин
|
|
| Пироксилин (13,3 % N)
|
|
| Смесь углерода с кислородом
| 4,1
|
| Смесь водорода с кислородом
| 1,7
|
Из приведенных данных видно, что объемная плотность энергии конденсированных ВВ превосходит в сотни и тысячи раз плотность энергии горючих смесей.
Таким образом, способность химических систем в т.ч. ВВ к горению и взрыву определяется четырьмя основными факторами:
- экзотермичностью процесса;
- большой сверхзвуковой скоростью его распространения;
- выделением значительного количества газообразных (парообразных) продуктов взрыва (ПВ);
- самораспространение химической реакции.
Условия, необходимые для протекания химической реакции в форме горения или взрыва
Установлено 4 основных условия, которым должна удовлетворять химическая реакция, протекающая в режиме взрыва:
1. Экзотермичность реакции;
2. Образование газообразных продуктов;
3. Высокая скорость протекания реакции;
4. Способность к самораспространению.
Нужно заметить, что все эти условия не являются абсолютными и независимыми друг от друга. Например, отсутствие или наличие газов в продуктах реакции в известной степени обусловлено тепловым эффектом; способность к самораспространению в сильной степени зависит от скорости протекания реакции и теплового эффекта и т.д. [Андреев, Беляев ТВВ, 1960].



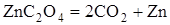
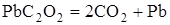

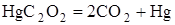
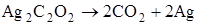
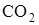 , а теплота образования элементов в виде простых веществ равна нулю, в тоже время тепловые эффекты реакций различны.
, а теплота образования элементов в виде простых веществ равна нулю, в тоже время тепловые эффекты реакций различны.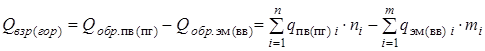 .
.
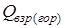 - теплота взрыва (горения) ЭМ (ВВ), кДж/моль (ккал/моль);
- теплота взрыва (горения) ЭМ (ВВ), кДж/моль (ккал/моль);
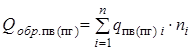 - суммарная теплота образования продуктов взрыва (горения) с учетом числа их грамм-молей -
- суммарная теплота образования продуктов взрыва (горения) с учетом числа их грамм-молей -  , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь  - теплота образования i -го продукта взрыва или горения;
- теплота образования i -го продукта взрыва или горения;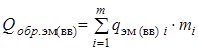 - суммарная теплота образования компонент ЭМ (ВВ) с учетом числа их грамм-молей -
- суммарная теплота образования компонент ЭМ (ВВ) с учетом числа их грамм-молей - 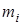 , кДж/моль (ккал/моль). Здесь
, кДж/моль (ккал/моль). Здесь 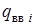 - теплота образования i -ой компоненты ЭМ (ВВ.
- теплота образования i -ой компоненты ЭМ (ВВ.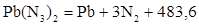 кДж.
кДж. .
.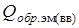 = - 93,4 кДж/моль, тетрил
= - 93,4 кДж/моль, тетрил 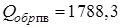 кДж/г-моль,
кДж/г-моль,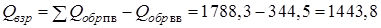 кДж/моль.
кДж/моль. ), имеющая теплоту образования минус 90,4 кДж/моль (3014,5 кДж/кг), детонирует в стальной трубе со скоростью 5,62 км/с.
), имеющая теплоту образования минус 90,4 кДж/моль (3014,5 кДж/кг), детонирует в стальной трубе со скоростью 5,62 км/с.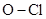
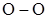

 Изменение скорости при прочих равных условиях значительно сказывается на эффекте действия взрыва. Так нитроглицерин в зависимости от некоторых условий детонирует со скоростью 8000 м/с и 2000 м/с.
Изменение скорости при прочих равных условиях значительно сказывается на эффекте действия взрыва. Так нитроглицерин в зависимости от некоторых условий детонирует со скоростью 8000 м/с и 2000 м/с.

