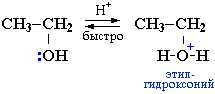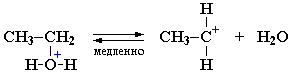Наличие полярной связи углерод—галоген сказывается на общем распределении электронной плотности в молекуле. Например, в молекуле 1-хлорпропана атом хлора, являясь электроноакцептором, оттягивает электронную плотность от связанного с ним атома углерода С-1. Атом С-1, потерявший часть своей электронной плотности, стремится восполнить ее недостаток, оттягивая в свою очередь электронную плотность от соседних с ним атомов С-2 и С-3. В результате происходит передача электронного влияния атома хлора по цепи а-связей, т.е. возникает индуктивный эффект. Электроноакцепторный атом хлора проявляет отрицательный индуктивный эффект (-/-эффект), а углеводородный радикал — положительный индуктивный эффект (+/-эффект). В результате перераспределения электронной плотности, возникающего под влиянием атома хлора, в молекуле 1-хлорпропана появляется электрофильный Центр — атом углерода С-1, имеющий наибольший частичный положительный заряд.
2-бромбутана. В ароматических галогенопроизводных атом галогена связан с лр2-гибридизованным атомом углерода бензольного кольца. Связь углерод — галоген в галогенаренах более прочная, чем в галоге-налканах, поэтому химическая активность галогена в этих соединениях резко снижается.
Вопрос 7 «Конформация алканов»
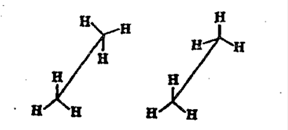
Различные положения углеродной цепи называются конформациями. В нормальных условиях конформации алканов свободно переходят друг в друга с помощью вращения С-С связей, поэтому их часто называют поворотными изомерами. Существует 2 основные конформации – «заторможенное» (энергетически более выгодна и молекула находятся в этой форме больше времени) и «заслоненное»:

Вопрос 8 «Реакция нуклеофильного замещения спиртов»
Механизм нуклеофильного замещения в спиртах (катализатор - кислота).
Сильные кислоты – это доноры протонов (H+):
H2SO4 = H+ + HSO4–
Спирты являются слабыми основаниями (акцепторами протона) за счет неподеленной пары электронов атома кислорода. Поэтому в присутствии сильной минеральной кислоты происходит протонирование спирта (образование донорно-акцепторной связи Н–О):
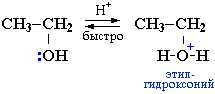
Далее возможно протекание реакции по одному из двух возможных механизмов.
Механизм I.
I стадия. Катион алкилгидроксония, отщепляя воду, превращается в карбокатион:
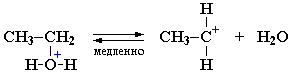
Роль кислоты, таким образом, заключается в превращении ОН-группы в Н2О, которая отщепляется легче, чем анион НО–.
II стадия. Карбокатион вызывает гетеролитический разрыв связи в галогеноводороде и присоединяет галогенид-анион с образованием конечного продукта:

Или


Освободившийся H+ идет на протонирование новых молекул спирта.
Механизм II.
Другой возможный механизм нуклеофильного замещения заключается в практически одновременном отщеплении воды и присоединении галогена (без образования карбокатиона) и идет в одну стадию.

Механизм замещения зависит от строения реагентов и условий реакции. Для третичных спиртов предпочтительней первый механизм, а для первичных - второй.
На стадии, определяющей скорость реакции (так называемой, лимитирующей стадии), в механизме I образуется карбокатион. Чем стабильнее этот катион, тем легче он образуется. Третичный катион стабильнее, чем первичный (три +I-эффекта алкильных групп в третичном катионе и один - в первичном). С другой стороны, энергия переходного состояния в механизме II тем ниже, чем меньше стерические препятствия, т.е. чем меньше алкильных групп у атакуемого атома углерода.