К конъюгационным относятся процессы биосинтеза, в результате которых из ксенобиотиков или их метаболитов и эндогенных продуктов (глюкуроновой кислоты, ацетилсульфата, глицина и др.) образуются сложные вещества.
Схематически реакцию конъюгации можно представить в следующем виде:
фермент
RX + эндогенное соединение (донорное в-во) ¾¾¾® конъюгат.
Как и большинство биосинтетических реакций, это энергозависимые процессы, подразделяющиеся на две группы. В основу классификации положена природа активных промежуточных продуктов реакций. Первую группу составляют процессы, в результате которых образуются активированные конъюгирующие агенты:
энергия субстрат
конъюгирующий ¾¾¾¾® активированный ¾¾¾¾® продукт
агент конъюгирующий агент конъюгации.
Для второй группы характерно образование активированного субстрата:
энергия конъюгирующий агент
субстрат ¾¾¾¾® активированный ¾¾–––––¾¾® продукт
субстрат конъюгации.
К первому типу относятся реакции метелирования, ацетилирования, образование глюкуронидов, гликозидов и сульфатов, к второму – аминокислотная конъюгация.
Реакции конъюгации катализируются ферментами трансферазами, переносящими заместитель в другое соединение. Реакции конъюгации считаются высокоэффективными путями снижения токсичности некоторых ксенобиотиков. Наиболее изучены реакции конъюгации, в которых участвуют следующие молекулы:
1. Ацетат конъюгируется при участии ацетил-КоА с некоторыми ароматическими аминами и сульфонамидами. Ацетилирование катализируется соответствующими ацетил-трансферазами.
2. Глицин. Его конъюгация с бензойной кислотой – одна из первых изученных реакций биотрансформации.
Глицин служит также конъюгирующим агентом при метаболизме никотиновой кислоты.
3. Глутатионовая конъюгация. Трипептид глутатион – эффективный конъюгирующий агент для конденсирования кольцевых систем – нафталина, антрацена, фенантрена. Катализирует реакции глутатион-S-трансфераза. Глутатион принимает участие в реакциях биотрансформации таких устойчивых ксенобиотиков, как нафталин.
4. Алкилирование с участием метионина и этионина.
5. Орнитин используется при детоксикации бензойной кислоты в организме рептилий и птиц, а аргинин – в организме членистоногих.
6. Глутамин у приматов используется для конъюгации фенилуксусной кислоты и некоторых ее гетероциклических аналогов.
7. Рибоза и глюкоза. Оба соединения часто используются для конъюгации; конъюгаты глюкозы особенно широко представлены в растениях, у моллюсков и насекомых. Гликозирование является основным путем детоксикации растениями чужеродных фенолов. Среди млекопитающих глюкозидная конъюгация встречается в организмах кролика, мышей, крыс и человека.
8. Конъюгация ксенобиотиков с глюкуроновой кислотой (образование глюкуронидов) – наиболее важный механизм детоксикации ксенобиотиков. В реакции участвует активная форма
глюкуроновой кислоты – УДФГ. Катализирует процесс уридиндифосфатглюкуронозилтрансфераза (УДФГТ), локализованная в мембранах ЭР гепатоцитов, легких, кожи, кишечника, почек. Конъюгации подвергаются спирты, фенолы, карбокислоты, амины, гидроксиламины, карбамиды, сульфонамиды и тиолы. При переносе глюкуроновой кислоты из донорной молекулы – уридиндифосфоглюкуроновой кислоты (УДФГ) – в акцепторное вещество путем ферментативной реакции образуются глюкурониды.
9. Лигнин. В последнее время в растениях удалось обнаружить новый тип конъюгата – нерастворимые конъюгаты с лигнином. С ним могут ковалентно связываться молекулы пестицидов 2,4-Д (дихлорфеноксиуксусная кислота), пентахлорфенола, а также 3,4-ди-хлоранилина.
10. Сульфатная конъюгация (сульфатирование) – эволюционно один из древних видов биотрансформации. В нее вступают фенолы, спирты, ароматические амины, гидроксиламины, некоторые стероиды. Происходит с участием сульфат-аденилтрансферазы, аденил-сульфаткиназы, возможно, и других ферментов группы сульфотрансфераз, локализованных в цитоплазме гепатоцитов и других клеток. В этом случае донорной молекулой является 3'-фосфоадено-5'-фосфосульфат (ФАФС).
22) Антагонизм, аддитивность и синергизм биологического действия ксенобиотиков. Примеры синергизма и схема антагонистических взаимодействий.
Механизм развития биологической реакции под действием двух ксенобиотиков возможно три ситуации: аддитивность, синергизм и антагонизм.
Аддитивность – отсутствие влияния одного ксенобиотика на характер действия другого, т. е. биологическая реакция является суммой эффектов, вызываемых каждым веществом.
Синергизм – усиление биологического ответа при совместном действии ксенобиотиков по сравнению с эффектами, вызываемыми каждым веществом в отдельности.
Антагонизм – наоборот, ослабление или подавление биологического эффекта при совместном действии по сравнению с влиянием отдельных агентов.
По месту воздействия на цепь событий, начинающихся с применения агониста и заканчивающихся наблюдаемым биологическим эффектом, антагонисты могут быть разделены на несколько классов:
1)Химический антагонизм, или антагонизм через нейтрализацию, проявляется при непосредственном взаимодействии антагониста с агонистом: представим в виде обратимой бимолекулярной реакции образования неактивного комплекса Е:
 А + В Е
А + В Е
с константой диссоциации КВ = СА · СВ / СЕ,
где СА, СВ и СЕ – концентрация агониста, антагониста и продукта реакции соответственно. ХА вляется конкурентным взаимодействием, снижающим кажущуюся константу диссоциации агонист-рецепторного комплекса вследствие «конкуренции» между антагонистом и рецепторами за связывание с агонистом.
2)Конкурентный антагонизм проявляется, когда антагонист взаимодействует с теми же сайтами, что и агонист, но в отличие от агониста - антагонист не вызывает биологической реакции.
 ZА =, (3.2)
ZА =, (3.2)
СА + (1 + СВ/КВ)КА
где Q – наличие мест связывания; СА, СВ – концентрации эффектора; КА и КВ – константы диссоциации комплексов агониста и антагониста соответственно. Важным частным случаем взаимодействия двух лигандов с одним типом рецепторов являются конкурентные отношения между частичным и полным агонистами. Пусть лиганд А2 так же, как и агонист А1, способен вызывать определенную биологическую реакцию, но обладает более низкой внутренней активностью, т. е. равные концентрации лиганд-рецепторных комплексов ZА1 и ZА2 вызывают неравные реакции: ρ (ZА1) > ρ (ZА2). Очевидно, что образование дополнительных комплексов ZА2 усиливает реакцию при относительно низких концентрациях агониста А1.
Однако при высоких концентрациях полного агониста А1 реакция снижается вследствие вытеснения А1 с части мест связывания менее эффективным агонистом А2. Таким образом, частичный агонист проявляет во взаимодействии с полным агонистом конкурентный дуализм: усиливает влияние низких концентраций полного агониста, а высоких – ослабляет.
3)Неконкурентный антагонизм. Взаимодействие неконкурентного антагониста с собственными рецепторами не приводит к независимому биологическому эффекту, а снижает эффект при образовании комплекса агонист-рецептор. Обычно НА уменьшает стимул, вызванный образованием агонист-рецепторных комплексов, или снижает способность эффекторной системы реагировать на данный стимул.
4) Функциональный и физический антагонизмы, между которыми не существует принципиальных различий. Условное разграничение функционального и физического антагонизмов может основываться на изменении знака наблюдаемого эффекта с увеличением концентрации агониста. (при различных сочетаниях концентраций вазодилитатора и сердечного стимулятора может быть в принципе достигнуто как понижение, так и повышение давления крови.) Функционал. характеризуется взаимодействием двух агентов (агонист и антагонист) с независимыми рецепторными системами, причем вызывается противоположное влияние в одной и той же эффекторной системе.Сходным образом определяется понятие физического антагонизма, который вызывается противоположным физиологическим действием эффекторов, активирующих полностью независимые рецептор-эффекторные системы.
 Агонист А + R1 ¾¾® АR1 ¾¾® ρА
Агонист А + R1 ¾¾® АR1 ¾¾® ρА

 ρАВ ¾¾® ρАВ, (3.4)
ρАВ ¾¾® ρАВ, (3.4)
Антагонист В + R2 ¾¾® ВR2 ¾¾® ρВ

 где R1 и R2 – рецепторы агониста и антагониста; ρА и ρВ – результатирующие субэффекты в рецептор-эффекторных цепях А и В; ρАВ – первый субэффект, величина которого зависит от стимула в обоих цепях; ρАВ – наблюдаемый эффект.
где R1 и R2 – рецепторы агониста и антагониста; ρА и ρВ – результатирующие субэффекты в рецептор-эффекторных цепях А и В; ρАВ – первый субэффект, величина которого зависит от стимула в обоих цепях; ρАВ – наблюдаемый эффект.
5) Бесконкурентный антагонизм предполагает инактивацию комплекса агонист-рецептор лигандом, не способным образовывать комплекс с рецептором, не занятым агонистом. Бесконкурентный антагонизм, таким образом, предполагает наличие двух процессов:
кА
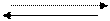 А + АR ¾¾® ρ, (3.5)
А + АR ¾¾® ρ, (3.5)
кА'
кВ
 АR + B ARB. (3.6)
АR + B ARB. (3.6)
кВ'
Бесконкурентный антагонист в равной мере снижает количество рецепторов, способных образовывать эффективный комплекс с агонистом и снижает константу диссоциации этого комплекса (т. е. увеличивает сродство агониста к рецепторам, оказывая действие, противоположное конкурентному антагонизму).
6) Смешанный антагонизм представляет собой более общую схему взаимодействия агониста А и антагониста В с рецепторами, допускающую комплексообразование рецепторов с обоими лигандами, а также образование тройного комплекса. Смешанный антагонизм формально эквивалентен действию смеси конкурентного и бесконкурентного антагонистов в равных концентрациях.
23) Образование хелатных комплексов. Характеристика лиганд (хелатирующих агентов). Сродство, коэффициент устойчивости.
Известно много веществ (лигандов), способных связываться с металлами. Они часто образуют с ними хелатные соединения. Если металл оказывается заключенным в лиганде между такими элементами, как N, O или S, то образуется хелатное кольцо.В зависимости от количества вступивших во взаимодействие атомов металлов и лиганд могут образовываться комплексы 1:1, 1:2 и др. ТРИ основных вида лигандов, образующих одно кольцо в комплексе 1:1 (бидентатные лиганды):
При содержании двух электронодонорных групп заряд катиона металла при образовании хелатного соединения не меняется (этилендиамин). Лиганды могут содержать также одну электронодонорную и одну анионную группы, как в глицине-заряд металла уменьшается на 1. И наконец, лиганд может содержать две анионные группы (например, щавелевая кислота)- уменьшается на 2. Образование хелатных связей атомами кислорода и азота происходит обычно лишь в тех случаях, когда при этом получаются пяти- и шестичленные циклы.
Для оценки прочности связей применяют константы устойчивости, характеризующие равновесие между одним или несколькими лигандами и одним ионом металла, подчиняющееся закону действия масс.
[MeX
q = –––––––,
[Me][X]
где в числителе находится концентрация комплекса, а в знаменателе – концентрация образующих его компонентов. Часто необходимо знать общую константу устойчивости (b), представляющую собой произведение частных констант. Произведение двух частных констант обозначают как b2 (b2 = q1×q2 в случае соединения катиона металла с двумя молекулами лиганда. Понятие «лиганд» относится только к части, находящейся в соответствующей форме, которая может связывать катион металла.
По сравнению с ферментами, обладающими высокой специфичностью в отношении определенного металла, среди синтетических металлосвязывающих агентов подобная избирательность встречается значительно реже. Металлы по своему сродству к большинству хелатирующих агентов располагаются примерно в следующем порядке (от наибольшего сродства к наименьшему):
Fe3+, Hg2+, Cu2+, Al3+, Ni2+, Pb2+, Co2+, Zn2+, Fe2+, Cd2+, Mn2+, Mg2+, Ca2+, Li+, Na+, K+.
Некоторые из приведенных двухвалентных металлов расположены друг за другом в периодической системе следующим образом (в скобках указаны атомные номера): Mn (25), Fe (26), Co (27), Ni (28), Cu (29), Zn (30). В этом ряду, называемом первым рядом переходных элементов, сродство к хелатирующим агентам последовательно увеличивается, достигая максимума у меди (Cu2+). Повышение сродства к хелатирующим агентам является следствием уменьшения ионного радиуса.
Хелатообразование зависит от степени ионизации хелатообразующих агентов. Вещество, обладающее меньшим сродством к металлу (низ конст.уст-ти), может присоединить большее количество катионов металла, чем вещества, у которых это сродство больше. Это объясняется тем, что для хелатообразования необходимо не только наличие сродства между лигандом и металлом, но также быстрое образование анионов лиганда из агента (или молекул лиганда). Таким образом, существует своего рода конкуренция между константами устойчивости и константами ионизации.
24) Концепция рецепторов. Критерии отнесения молекулы к рецептору. Регуляция внутриклеточных процессов с участием вторичных мессенджеров.
Ксенобиотик – чужеродное организму вещество. Поэтому он взаимодействует с местами связывания на мембране или выполняет роль антагониста. Биологически активные соединения обычно подразделяют на агонисты-вещества, связывающиеся с рецепторами и индуцирующие биологический ответ, и антагонисты-соединения, препятствующие взаимодействию агониста и не вызывающие или ослабляющие биологическую реакцию.
Истоки теории рецепторов принято обычно искать в работах Лэнгли и Эрлиха. Последний на рубеже XIX–XX вв сформулировал знаменитый принцип: вещества не действуют, не будучи связанными.
Дальнейшее развитие теория рецепторов получила при изучении действия различных гормонов. Установленные факты по влиянию гормонов позволили предположить, что последние связываются с расположенными на поверхности специальными структурами – рецепторами, т. е. молекулами, способными «узнавать» гормон, взаимодействовать с ним и передавать информацию о его присутствии. Однако достоверно доказать наличие рецепторов на мембранах не так-то просто. Это связано, с одной стороны, с чрезвычайно низкой концентрацией, их лабильностью и неоднородностью. С другой стороны, на поверхности любой клетки имеются мембранные компоненты, неспецифически связывающие тот или иной гормон (эффектор), т. е. не все места, связывающие гормон, являются рецепторами.
Рецептор – мембранный центр связывания, взаимодействие которого с молекулой ксенобиотика инициирует реакцию клеточных мембран.
К основным критериям, по которым можно судить о наличии рецепторов относят следующие.
1. высокое сродство, характеризующееся тем, что агент действует при низкой концентрации;
2. кривая, описывающая процесс взаимодействия эффектора с местами связывания на мембране от концентрации, должна выходить на плато, поскольку количество рецепторов (мест связывания) ограничено;
3. различная биологическая активность пар оптических изомеров (стереоспецифичность);
4. тканевая специфичность биологического действия веществ.
Далее следует отметить, что взаимодействие возможно только при строгом соответствии пространственных и зарядовых геометрий. Необходимо учитывать и то, что связывание эффектора с рецептором должно быть обратимым.
Молекула любого рецептора состоит из двух частей. Одна из них, наружная, служит для связывания вещества (гормона). Вторая, менее полярная часть молекулы рецептора, служит для ее закрепления в липидном бислое и передачи принятого сигнала внутрь клетки. Взаимодействие между связывающими и передающими участками осуществляется благодаря конформационным перестройкам, происходящим в результате «посадки» эффектора (агониста) на связывающий участок рецептора.В этом случае происходят небольшие изменения на отдельных участках мембран, результаты которых передаются внутрь клетки, усиливаясь с помощью определенного («релейного») механизма, и в конце концов определяют течение внутриклеточных процессов. В основе передачи в ряде случаев лежит активация и инактивация фермента – аденилатциклазы (АЦ), расположенного в мембране. Этот фермент отвечает за синтез нуклеотида – цАМФ.В нормальном состоянии активность аденилатциклазы подавлена.
Но при взаимодействии агониста с рецептором Р аденилатциклаза активируется. В результате усиливается синтез цАМФ, увеличивается концентрация последнего внутри клетки и активируется один или несколько ферментов, расположенных внутри клетки. Таким образом, химический сигнал передается от одного посыльного к другому. Первичным посыльным является эффектор (гормон, медиатор), через ГТФ-связывающий G-белок и аденилатциклазу он передает сообщение внутрь клетки.
Вторичные посредники не только способствуют передаче внешнего сигнала во внутриклеточный, но и обеспечивают значительное усиление первоначального сигнала.Однако постоянная активация АЦ не только не нужна, поэтому цАМФ регулируется также с помощью фосфодиэстеразы (ФДЭ).
Циклический АМФ регулирует внутриклеточные реакции.Действие его основано на активации специфических ферментов цАМФ зависимых протеинкиназ, которые формируют многие белки, в частности белки рибосом, ряд ферментов, транспортные мембранные белки и др. Фосфорилирование белков – это их активации. В неактивированное состояние они возвращаются путем дефосфорилирования с помощью фосфопротеинфосфотазы (ФПФ).
Признанными вторичными мессенджерами являются ионы кальция. Кальций участвует в регуляции внутриклеточных процессов в комбинации с двумя другими вторичными посредниками: инозитолтрифосфатом и диацилглицеролом.
Эффектор (медиатор) связывается с рецептором Р, который через ГТФ-связывающие белки (G) активирует фосфодиэстеразу фосфатидилинозитолтрифосфата (ФИФ2). При ращеплении ФИФ2 образуется инозитолтрифосфат (ИФ3) и диацилглицерол (ДАГ). ИФ3 растворим в воде, поэтому он диффундирует в цитоплазму, где вызывает высвобождение Са2+ из внутриклеточного депо – эндоплазматического ретикулума (ЭПР). Высвобожденный Са2+ активирует кальмодулинзависимую протеинкиназу (Са2+/КаМ киназа), фосфорилирующую белки-мишени, вызывая клеточный ответ. ДАГ, будучи гидрофобным, остается в мембране, где активирует Са2+ – фосфолипидзависимую протеинкиназу, которая фосфорилирует другие белки, вызывая также клеточный ответ.
25) Амфифильные ксенобиотики, их классификация (на примере ПАВ). Характеристика этапов их взаимодействия с биологическими мембранами, характер изменения селективности мембраны.
Амфифильные вещества стремятся сконцентрироваться на границах раздела несмешивающихся жидкостей: располагаются на границе раздела масло–вода таким образом, что гидрофильная «головка» находится в воде, а липофильные углеводородные цепи размещаются в масле, взаимодействуя с подобными себе цепями растворителя. Молекулы этих веществ обычно состоят из длинных углеводородных цепей, связанных с короткой полярной «головкой». В большинстве случаев полярность «головки» обусловлена наличием атомов азота или кислорода, не обобществленные пары электронов которых образуют водородные связи с молекулами воды. С другой стороны, для попадания в воду углеводородная цепь должна разорвать водородные связи между молекулами воды, которые энергически препятствует этому разрыву.
Типичными представителями амфифильных ксенобиотиков являются поверхностно-активные вещества (ПАВ). По характеру диссоциации все ПАВ делятся на:
– анионные, функциональные группы, молекулы которых в результате ионизации в растворе образуют отрицательно заряженные ионы, обусловливающие поверхностную активность;
– катионные ПАВ, функциональные группы молекул которых в результате ионизации в растворе образуют положительно заряженные ионы, обусловливающие поверхностную активность;
– неионогенные, практически не образующие в водном растворе ионов;
– амфолитные ПАВ, образующие в водном растворе в зависимости от условий (рН, растворимость и др.) катионные или анионные соединения.
При обработке клеток поэтапно увеличивающейся концентрацией детергента ПАВ выявлены четыре различные стадии: связывание детергента с мембраной, лизис, диссоциация мембраны на смесь комплексов липид–детергент, протеин–липид–детергент и высвобождение из комплексов чистых белков.
Эти стадии могут быть описаны следующим образом:
1. При низких концентрациях молекулы детергента связываются с мембранами, посредством внедрения во внешнюю фазу липидного бислоя без существенного изменения его структуры.
2. При повышении концентрации мономеров до определенной величины количество молекул детергента становится достаточным для дестабилизации мембраны. ПАВ, встраиваясь в мембрану, могут образовывать поры, размеры и физико-химические свойства которых зависят от типа и концентрации детергента в растворе. В зависимости от вида ПАВ эти поры деформируются в виде связанных каналов или в виде выемок на поверхности мембраны. В ряде случаев при значительных концентрациях детергента образующиеся в мембране поры имеют очень крупные размеры, через них могут проходить сахара и макромолекулы.
3. При еще больших концентрациях вся мембрана перемешивается с молекулами детергента, что приводит к фазовому переходу – мембрана распадается на смесь мицелл, содержащих комплексы детергент–липид или детергент–липид–протеин.
4. При последующем увеличении концентрации ПАВ отношение липид–белок уменьшается до тех пор, пока не происходит полное разделение фракций белков и липидов.



 А + В Е
А + В Е ZА =, (3.2)
ZА =, (3.2) Агонист А + R1 ¾¾® АR1 ¾¾® ρА
Агонист А + R1 ¾¾® АR1 ¾¾® ρА
 ρАВ ¾¾® ρАВ, (3.4)
ρАВ ¾¾® ρАВ, (3.4)
 А + АR ¾¾® ρ, (3.5)
А + АR ¾¾® ρ, (3.5) АR + B ARB. (3.6)
АR + B ARB. (3.6)


