

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...

История развития пистолетов-пулеметов: Предпосылкой для возникновения пистолетов-пулеметов послужила давняя тенденция тяготения винтовок...

Семя – орган полового размножения и расселения растений: наружи у семян имеется плотный покров – кожура...
Топ:
Эволюция кровеносной системы позвоночных животных: Биологическая эволюция – необратимый процесс исторического развития живой природы...
Когда производится ограждение поезда, остановившегося на перегоне: Во всех случаях немедленно должно быть ограждено место препятствия для движения поездов на смежном пути двухпутного...
Оценка эффективности инструментов коммуникационной политики: Внешние коммуникации - обмен информацией между организацией и её внешней средой...
Интересное:
Инженерная защита территорий, зданий и сооружений от опасных геологических процессов: Изучение оползневых явлений, оценка устойчивости склонов и проектирование противооползневых сооружений — актуальнейшие задачи, стоящие перед отечественными...
Средства для ингаляционного наркоза: Наркоз наступает в результате вдыхания (ингаляции) средств, которое осуществляют или с помощью маски...
Национальное богатство страны и его составляющие: для оценки элементов национального богатства используются...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Класс на 2021-2022 учебный год
(2 ч в неделю, всего 66 ч + 2 ч резервное время)
| № | Дата | Раздел | Практические работы | Контроль ные работы |
Раздел 1. Первоначальные химические понятия (уровень атомно-молекулярных представлений) (22 ч)
Раздел 2.Кислород.Водород (9 ч)
|
|
Раздел 3. Вода. Растворы (5 часов)
Раздел 4. Количественные отношения в химии (6 часов)
|
|
Раздел 6. Периодический закон и периодическая система химических элементов Д.
Контрольно- измерительные материалы. Химия.8 класс.
Контрольная работа №1 по теме «Первоначальные химические понятия» I вариант
1. Соотнесите:
| Понятия: | Примеры: | |
| 1. Тело; | А) гвоздь; | Г) стекло; |
| 1. Вещество. | Б) ваза; | Д) монета; |
| В) железо; | Е) медь. | |
2. К химическим явлениям относятся:
А) приготовление пищи
Б) падение предмета с высоты
В) горение бумаги
Г) таяние льда
10.
Вставьте пропущенные слова (из следующего набора: фильтрование, перегонка, отстаивание, упаривание, дистилляция; плотность, температура кипения, температура плавления) в необходимом падеже в предложение.
Сливки и обезжиренное молоко можно отделить друг от друга
……………………………………., так как эти вещества имеют разную ……………………………
11.. На каком рисунке показано:
а) разделение смеси твердое – жидкое фильтрованием;
б) разделение смеси жидкое – жидкое;
в) освобождение жидкости от растворенных в ней примесей путем дистилляции.
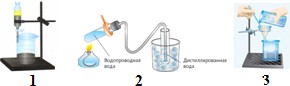
12. Укажите способы разделения следующих веществ:
а) вода и сахар ();
б) медные и железные опилки ();
|
|
в) подсолнечное масло и вода ();
г) вода и уксусная кислота ().
13. Химия-это….
14. Кристаллическая решетка-это…….
15. Атомы-это……
Ответы и критерии оценивания по вводной контрольной работе в 8 классе
Вариант 1
1. №1(АБВ), №2 (ВГЕ) 2.А, В
3.А, В
4. Б, Г
5. А, Г
6. 6. 1
7. 1
8. 2
9. 3
10. отстаивание, плотность
11. 1-Б, 2-В, 3-А
12. выпаривание, действие магнитом, делительная воронка или отстаивание, дистилляция
13.Химия-
14.Кристаллическая решетка-
15.Атомы-
Вариант 2
1. №1(БГД), №2 (АВЕ) 2.3
3.4
4. Е, Ж 5.3
6.3
7.4
8.А
9.2
10. 1-Б, 2-В, 3-А
11. жидкости, отстаивание
12. отстаивание, фильтрование или отстаивание, фильтрование или отстаивание, перегонка или дистилляция
13. Свойства веществ-
14.Молекулы-
15.Вещества-немолекулярного строения-
Контрольная работа №2
Вариант 1
1. К кислотам относится каждое из 2-х веществ:
а) H2S, Na2CO3 б) K2SO4, Na2SO4 в) H3PO4, HNO3 г) KOH, HCl
2. Гидроксиду меди (II) соответствует формула:
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфата натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидрид магния б) гидрокарбонат натрия
в) гидроксид кальция г) гидроксохлорид меди
5. Какой из элементов образует кислотный оксид?
а) стронций б) сера в) кальций г) магний
6. К основным оксидам относится
а) ZnO б) SiO2 в) BaO г) Al2 О3
7. Оксид углерода (IV) реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и оксидом серы (IV)
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и водородом
8. Установите соответствие между формулой исходных веществ и продуктами реакций
| Формулы веществ | Продукты взаимодействия |
| а) Mg + HCl → | 1) MgCl2 |
| б) Mg(OH)2 + CO2 → | 2) MgCl2 + H2 |
| в) Mg(OH)2 + HCl → | 3) MgCl2 + H2O |
| 4) MgCO3 + H2 | |
| 5) MgCO3 + H2O |
9. Осуществите цепочку следующих превращений:
а) Fe→Fe2O3→FeCl3→Fe(OH)3 → Fe2O3
б) S → SO2 → SO3 → H2SO4 → ZnSO4
10. Какая масса сульфата калия образуется при взаимодействии 49 г серной кислоты с гидроксидом калия?
Вариант 2
1. К основаниям относится каждое из 2-х веществ:
а) H2O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl
2. Оксиду меди (II) соответствует формула:
|
|
а) Cu2O б) Cu(OH)2 в) CuOH г) CuO
3. Формула сульфита натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидроксид бария б) гидроксокарбонат калия
в) гидрокарбонат меди г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) алюминий
6. К основным оксидам относится
а) MgO б) SO2 в) B2O3 г) Al2 О3
7. Оксид натрия реагирует с каждым из двух веществ:
а) водой и оксидом кальция б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
| Формулы веществ | Продукты взаимодействия |
| а) Fe + HCl → | 1) FeCl2 |
| б) Fe(OH)2 + CO2 → | 2) FeCl2 + H2 |
| в) Fe(OH)2 + HCl → | 3) FeCl2 + H2O |
| 4) FeCO3 + H2 | |
| 5) FeCO3 + H2O |
9. Осуществите цепочку следующих превращений:
а) Mg → MgO→MgCl2→Mg(OH)2 → MgO
б) C → CO2 → Na2CO3 → Na2SO4 → BaSO4
10. Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты?
Часть 3
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
 P —> P2O5 —> H3PO4 —> Na3PO4
P —> P2O5 —> H3PO4 —> Na3PO4
С2. Определите массу карбоната кальция CaCO3, если при его термическом разложении выделяется 45 литров углекислого газа.
Контрольная работа №3 по темам: «Периодический закон Д. И. Менделеева», «Строение атома», «Строение вещества». Вариант 2
Часть 1 Внимательно прочитайте каждое задание (А1 – А8), из четырех предложенных вариантов ответов выберите один правильный и отметьте его.
А1. Активный металл натрий имеет схему строения атома:
1) 2,1; 2) 2,2; 3) 2,8,1; 4) 2,8,2
А2. Вид химической связи у вещества, имеющего формулу Na2S:
1) ковалентная неполярная, 2) ковалентная полярная,3) металлическая, 4) ионная
2) А3. Металлические свойства по группе:
1) увеличиваются, 2) уменьшаются
3) уменьшаются, а затем увеличиваются,
4) не изменяются
А4. Заряд ядра химического элемента равен:
1) номеру периода, 2) номеру группы, 3) порядковому номеру, 4) номеру ряда
А5. Атомы элементов, имеющие одинаковое число электронов на внешнем
энергетическом уровне, расположены:
1) в одной группе, 2) в одной подгруппе,
3) в одном периоде, 4) по диагонали.
А6. Число электронов на внешнем энергетическом уровне в атоме фосфора равно:
1) 3, 2) 5, 3) 15, 4) 3 1
А7. Атомы элементов, имеющие одинаковое число энергетических уровней, расположены:
1) в одной группе периодической системы, 2) в одном периоде периодической системы;
3) в одной подгруппе периодической системы, 4) все варианты верны.
А8. Степень окисления брома в соединениях Br2O7 и MgBr2 соответственно равны: 1) +4 и +2, Б2) -1 и +2, 3) +7 и -1, 4) +7 и -7.
|
|
А9. Распределению электронов по электронным слоям в атоме фтора соответствует схема:
1) 2; 8; 8; 2) 2; 8; 7; 3) 2; 7; 4) 2; 8;
Часть 2
В1. Составьте схемы строения атома и распределите электроны по орбиталям для элемента № 13
В2. Как в группе изменяются радиусы атомов и их электроотрицательность?
| А (Ков.полярная) | Б (Ков.неполярная) | В Металлическая | С Ионная |
В3. Распределите вещества по 4 колонкам в зависимости от типа химической связи:
1) H2S, 2) CH4, 3)N2, 4) SiO2, 5)Ag, 6) N2O5 7), К, 8)K2S.
Часть 3
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
S —> SO3 —> К2SO4 —> BaSO4
С2. Вычислите массу оксида кальция, полученного при обжиге 250 г карбоната кальция.
Вариант 2
Часть 1
Внимательно прочитайте каждое задание (А1 – А6), из четырех предложенных вариантов ответов выберите один правильный и запишите его.
А1. Активный металл натрий имеет схему строения атома:
1) 2,1; 2) 2,2;
3) 2,8,1; 4) 2,8,2
А2. Металлические свойства по группе:
1) увеличиваются, 2) уменьшаются
3) уменьшаются, а затем увеличиваются,
4) не изменяются
А3. Заряд ядра химического элемента равен:
2) номеру периода, 2) номеру группы, 3) порядковому номеру, 4) номеру ряда
А4. Атомы элементов, имеющие одинаковое число электронов на внешнем
энергетическом уровне, расположены:
1) в одной группе, 2) в одной подгруппе,
3) в одном периоде, 4) по диагонали.
А5. Число электронов на внешнем энергетическом уровне в атоме фосфора равно: 1) 3, 2) 5, 3) 15, 4) 3 1
А6. Атомы элементов, имеющие одинаковое число энергетических уровней, расположены:
1) в одной группе периодической системы, 2) в одном периоде периодической системы;
3) в одной подгруппе периодической системы, 4) все варианты верны.
Часть 2
В1. Составьте схемы строения атома и распределите электроны по орбиталям для элемента № 13
В2. Как в группе изменяются радиусы атомов и их электроотрицательность?
Часть 3
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
S —> SO3 —> К2SO4 —> BaSO4
Ключ.
Каждое правильно выполненное задание части 1 (с выбором ответа) оценивается в 1 балл. Правильным считается, если обведен только один номер верного ответа.
Задание части 2 (Полный правильный ответ оценивается 2 баллами, за неполный правильный ответ – 1 балл, за неверный ответ (или его отсутствие) – 0 баллов.
Задание части 3 (с развѐрнутым ответом) считается выполненным верно, если правильно записаны три уравнения реакций (3 балла). Правильно записаны 2 уравнения реакций – 2 балла. Правильно записано одно уравнение реакции – 1 балл. Правильно решенная задача-3 балла.
Максимальное количество баллов представлено в таблице 1.
Таблица 1
|
Вид работы | Максимальное количество баллов | |||
| Часть 1 | Часть 2 | Часть 3 | Итого | |
| Контрольная работа | 9 | 6 | 6 | 21 |
Оценивание работы Оценивание работы представлено в таблице 2.
| Вид работы | Количество баллов | % выполнения работы | Оценка |
| Контрольная работа | Менее 5 | Менее 30 | «2» |
| 10– 12 | 30–52 | «3» | |
| 13– 18 | 53–82 | «4» | |
| 19 – 21 | 83–100 | «5» |
Итоговая контрольная работа за курс химии 8 класса. Вариант 1
Часть 1
Внимательно прочитайте каждое задание (А1 – А7), из четырех предложенных вариантов ответов выберите один правильный
А1. К неметаллам относится:
1) 2,8,2; 2) 2,8,3; 3) 2,8,8,2; 4) 2,8,7
А2. К химическим явлениям относится:
1) плавление парафина; 2) дробление горной породы;
3) скисание молока; 4) замерзание воды
А3. С соляной кислотой реагируют каждое из пары веществ:
1) медь, гидроксид меди (2); 2) натрий, гидроксида натрия;
3) серная кислота, оксид серы (4); 4) вода, гидроксид калия
А4. Ковалентная полярная связь в соединении: 1) СН4; 2) H2; 3) Са; 4) AlCl3
А5. Верны ли следующие суждения:
А. Лакмус в растворе кислоты краснеет
Б. Кислород собирают вытеснением воздуха, держа пробирку вверх дном
1) верно только А; 2) верно только Б; 3) верны оба суждения; 4) оба суждения неверны.
А6. (решение оформить) Масса соли, находящейся в растворе массой 300 г.с массовой долей растворѐнного вещества 50%, равна: 1) 6 г.; 2) 160 г.; 3) 150 г.; 4) 600 г.
А7. (решение оформить) Масса гидроксида натрия, вступившего в реакцию с 2 моль серной кислоты равна: 1) 1,6 г.; 2) 80 г.; 3) 120 г.; 4) 160 г.
Часть 2
Ответом к заданию В1 является последовательность цифр, которая соответствует номерам правильных ответов.
В1. Выберите реакции замещения из данных уравнений реакций:
1) К2 S + H2 SO4 = H2S + К2SO4; 2) Zn + FeCI2 = ZnCI2 + Fe;
3) 2NH3 = 3H2 + N2; 4) H2 + Ca = CaH2
5) H2 S O4 + Ca = Ca S O4 + H2;
В задании В2 на установление соответствия запишите в таблицу цифры выбранных вами ответов.
В2. Установите соответствие между уравнениями реакций и ошибками в их написании.
| Уравнения реакций | Ошибки |
|
| А) CaO + 2 НSO4= СaSO4+ H2O | 1) в 1 формуле и расстановке коэффициентов | |
| Б) HCI + NaOH = NaCI + H2O | 2) в 2 формулах и расстановке коэффициентов | |
| В) HPO4 + Al(OH)3 = AlPO4 + H2O | 3) в расстановке коэффициентов | |
| 4) ошибок нет |
Часть 3С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
P —> P2O5 —> H3PO4 —> Na3PO4
Вариант 2
Часть 1
Внимательно прочитайте каждое задание (А1 – А7), из четырех предложенных вариантов ответов выберите один правильный и отметьте его.
А1. Самый активный металл имеет схему строения атома:
1) 2,1; 2) 2,2; 3) 2,8,1; 4) 2,8,2
А2. Чистое вещество – это:
1) глина; 2)соль; 3) варенье; 4) молоко
А3. С гидроксидом натрия реагируют каждое из пары веществ:
1) медь, гидроксид меди (2); 2) натрий, гидроксида натрия;
3) вода, гидроксид калия; 4) серная кислота, оксид серы (IV)
А4. Ионная связь в соединении:
1) O2; 2) P2O5; 3)Ag; 4) СаSO4
А5. Верны ли следующие суждения о правилах безопасной работы в химической лаборатории?
А. При нагревании вещества не касаться дном пробирки фитиля спиртовки.
Б. Не направлять пробирку с нагреваемой жидкостью в сторону соседа
1) верно только А; 2) верно только Б;
3) верны оба суждения; 4) оба суждения неверны.
А6. (решение оформить) Массовая доля кислорода в нитрате алюминия равна:
1) 80%; 2) 67%; 3) 58%.; 4) 1%;
А7. (решение оформить) Масса воды, полученной при взаимодействии 11,2 л. кислорода с водородом равна:
1) 18 г.; 2) 36 г.; 3) 201 г.; 4) 403 г.
класс на 2021-2022 учебный год
(2 ч в неделю, всего 66 ч + 2 ч резервное время)
| № | Дата | Раздел | Практические работы | Контроль ные работы |
|
|
|

Биохимия спиртового брожения: Основу технологии получения пива составляет спиртовое брожение, - при котором сахар превращается...

История развития хранилищ для нефти: Первые склады нефти появились в XVII веке. Они представляли собой землянные ямы-амбара глубиной 4…5 м...

Поперечные профили набережных и береговой полосы: На городских территориях берегоукрепление проектируют с учетом технических и экономических требований, но особое значение придают эстетическим...

Папиллярные узоры пальцев рук - маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!