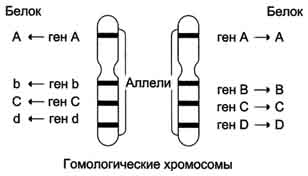
Существование в популяции 2 и большего числа аллелей одного гена называют "аллеломорфизм", или "полиморфизм", а белковые продукты, образующиеся в ходе экспрессии этих вариантов гена - "полиморфы". Разные аллели встречаются в популяции с разной частотой. К полиморфам относят только те варианты, распространённость которьж в популяции не меньше 1%.
В процессе эволюции отдельные гены амплифицируют с образованием копий, а их структура и положение могут изменяться в результате мутаций и перемещений не только внутри хромосомы, но и между хромосомами. Со временем это приводит к появлению новых генов, кодирующих белки, родственные исходному, но отличающиеся от него определёнными свойствами и занимающие в хромосомах разные генные локусы (или места).
К родственным белкам относят изобелки, представляющие собой варианты белков, выполняющие одну и ту же функцию и обнаруживаемые в пределах одного вида организмов. Так, в группе из 2000 генов человека, кодирующих факторы транскрипции и транскрипционные активаторы, идентифицировано 900, относящихся к семейству белков, имеющих "цинковые пальцы". Существует 46 генов фермента глицеральдегид-3-фосфатдегидрогеназы, осуществляющего единственную окислительную реакцию в метаболическом пути катаболизма глюкозы до пирувата.
Выявлены семейства родственных белков, возникшие в ходе эволюции из одного "предкового" гена, или гена-предшественника. Такие семейства составляют:
Гемоглобины человека
В ходе эволюции из единичных генов-предшественников возникли семейства генов α- и β-глобинов (рис. 4-60), на хромосомах 16 и 11 соответственно.
В процессе онтогенеза у людей образуются разные виды гемоглобинов, обеспечивающие наилучшую адаптацию к меняющимся условиям существования. НbЕ - эмбриональный, синтезируется у зародыша в первые месяцы развития, HbF - фетальный, обеспечивает дальнейшее внутриутробное развитие плода, а НbА и НЬA2 осуществляют транспорт кислорода в организме взрослого человека. Эти белки представляют собой тетрамеры, состоящие из полипептидных цепей двух видов: α и β в НbА (2α2β), α и ε в НbЕ (2α2ε), а у остальных гемоглобинов β-цепи заменены на γ-полипептиды в HbF (2α2γ) или на δ-цепи в HbА2 (2α2δ).
Полиморфизм гемоглобинов в популяции людей очень велик. Наряду с генами, кодирующими изобелки и занимающими разные локусы на хромосоме, обнаружено большое число вариантов гемоглобина А, являющихся продуктами аллельных генов. Некоторые варианты НЬА представлены в таблице 4-9.
Один из наиболее известных аллельных вариантов НЬА - HbS, образующийся в результате замены остатка глутамата в положении 6 β-цепи НbА на валин (β6 Глу→Вал). По аллелям НbА и HbS всех людей можно разделить на 3 генотипически различающиеся группы: АА, AS и SS. Распространённость аллеля S по земному шару неравномерна. Часто людей с этим аллелем можно встретить в малярийных районах Африки и Азии (до 35%). К настоящему времени описано свыше 300 вариантов НbА, на основании этого признака всех людей можно разделить на 600 генотипических групп по наиболее часто встречающимся аллелям.
Группы крови
Другой важный пример полиморфизма белков, связанный с проблемой переливания крови, - существование в популяции людей 3 аллельных вариантов гена фермента гликозилтрансферазы (А, В и 0). Этот фермент принимает участие в синтезе олигосахарида, локализованного на наружной поверхности плазматической мембраны и определяющего антигенные свойства эритроцитов. Варианты фермента А и В имеют разную субстратную специфичность: вариант А катализирует присоединение к олигосахариду N-ацетилгалактозамина, а вариант В - галактозы. Вариант О кодирует белок, лишённый ферментативной активности. В результате структура олигосахаридов,
Антитела к антигенам А и В обычно имеются в сыворотке крови людей, на поверхности эритроцитов которых отсутствует соответшвующий антиген, т.е. индивидуумы с антигенами А на поверхности эритроцитов продуцируют в сыворотку крови антитела к В-антигенам (анти-В), а люди с В-антигенами ~ антитела к антигенам А (анти-А). В сыворотке крови анти-А и анти-В обычно присутствуют в высоких титрах и при появлении соответствующих антигенов способны активировать ферменты системы комплемента.
При переливании крови руководствуются правилом, согласно которому кровь донора и реципиента не должна содержать антигены и антитела, реагирующие между собой: например, реципиенту, имеющему в сыворотке крови анти-А, нельзя переливать кровь от донора, содержащего на эритроцитах антигены А.
При нарушении этого правила происходит реакция антиген-антитело. Это вызывает агглютинацию (склеивание) эритроцитов и их разрушение ферментами комплемента и фагоцитами.
Как видно из табл. 4-10, у индивидуумовгетерозигот, имеющих группу крови АВ (IV), на эритроцитах присутствуют А- и В-антигены, функционируют 2 варианта глйкозилтрансферазы (А и В), а следовательно антитела не образуются. Этих людей можно рассматривать как "универсальных" реципиентов, которым безопасно вводить эритроциты от доноров, имеющих любые группы крови. Однако люди с группой крови IV не могут безопасно получать сыворотку крови от этих доноров, так как она содержит антитела к А- и/или В-антигенам. В то же время индивидуумы, имеющие 0 (I) группу крови, - гомозиготы по неактивному варианту гликозилтранеферазы 0, и поверхность их эритроцитов лишена антигенов. Такие люди являются "универсальными" донорами эритроцитарной массы, так как их эритроциты можно вводить людям с группами крови А, В, 0 или АВ. В то же время сыворотка крови этих доноров содержит антитела к А- и В-антигенам и может использоваться только для пациентов 0 (I) группы крови.
3. Белки главного комплекса гистосовместимости
и трансплантационная несовместимость
При формировании клеточного иммунного ответа узнавание Т-лимфоцитами чужеродного антигена происходит только если он расположен рядом с гликопротеинами, присутствующими на собственной клеточной мембране. Эти гликопротеины называют белками главного комплекса гистосовместимости, или МНС-белками (см. раздел 1). Существуют 2 класса этих белков: молекулы класса I и П. МНС-белки класса I обнаружены практически во всех содержащих ядро клетках, включая Т-киллеры, тогда как МНС-белки класса II найдены главным образом в клетках, участвующих в иммунном ответе, в антиген-представляющих В-клетках и Т-хелперах, но не в Т-киллерах и макрофагах.
Строение МНС-белков кодирует семейство генов, расположенных на коротком плече хромосомы
6 и занимающих участок ДНК длиной более 6000 пар нуклеотидов. Это семейство состоит из серии тесно сцепленных генов, ответственных за синтез МНС-белков и некоторых компонентов системы комплемента. Гены комплекса отличаются чрезвычайно высоким полиморфизмом. Число разных аллелей достигает нескольких миллионов. Белки МНС-системы считают самой полиморфной системой человека. Вариабельность МНС-белков обеспечивает трансплантационную несовместимость. Клетки трансплантата имеют набор этих белков, отличный от МНС-белков реципиента (во всех случаях, кроме генетически идентичных близнецов), и это приводит к развитию реакции клеточного иммунитета, в результате которой трансплантированная ткань отторгается.
Исследования показали, что полиморфизм различных белков настолько велик, что можно говорить о биохимической индивидуальности и уникальности каждого человека.
34. лакарственные препараты и тд. вещества ингибирующая синтез ДНК, РНК или белков нашли применение в лечении инфекционных болезней и опухолевых новообразований, а другие для человека оказались токсинами. Действие ингибиторов матричных биосинтезов как лекарственных препаратов основано на модификации матриц: ДНК, РНК, белоксинтезирующего аппарата или на инактивации ферментов.
А. Ингибиторы репликации - противоопухолевые препараты Антибиотики, взаимодействующие с ДНК, нарушают её матричную функцию и вызывают подавление процессов репликации и транскрипции. Эти противоопухолевые препараты используют для лечения злокачественных новообразований. Дауномицин взаимодействует с молекулой ДНК таким образом, что циклическая структура этих антибиотиков встраивается между парами оснований G≡C, а углеводный компонент занимает малую бороздку ДНК.
К препаратам, останавливающим репликацию, относят алкилирующие агенты и ингибиторы ДНК-топоизомеразы II.
Б. Ингибиторы транскрипции и трансляции - антибактериальные препараты. К ингибиторам матричных синтезов, оказывающим противобактериальное действие, относят блокаторы синтеза РНК или белка. Сюда относится рифампицин. Антибиотики из семейства рифамицинов ингибируют бактериальную ДНК-зависимую РНК-полимеразу, связываясь с β-субъединицей фермента и препятствуя инициации транскрипции. применяют для лечения туберкулёза.
ингибиторами трансляции является: тетрациклины, эритромицин, пуромицин, хлорамфеникол и аминогликозиды. стрептомицин ингибирует инициацию синтеза белка у прокариотов и вызывает ошибки в прочтении информации, закодированной в мРНК. назначают при лечении инфекционных заболеваний сердца.
В. Вирусы и токсины - ингибиторы матричных синтезов в эукариотических клетках. после заражения вирусом с высокой скоростью начинается синтез вирусных ДНК, РНК и белков с использованием ферментов и белков, источников энергии клетки хозяина. При этом в инфицированных клетках прекращается синтез нуклеиновых кислот и белков, свойственных организму хозяина. Репродукция вирусных частиц идёт вплоть до гибели заражённой клетки.
Токсины. при отравлении бледной поганкой является токсин - α -аманитин, который содержится в теле гриба и вызывает необратимую дисфункцию печени и почек. он ингибирует эукариотические РНК-полимеразы. токсичен белок рицин, выделенный из клещевины обыкновенной. Он представляет собой N-гликозилазу, которая удаляет один остаток аденина из 28S рРНК большой субъединицы рибосомы и ингибирует синтез белка у эукариотов.
Г. Интерфероны Интерфероны - гликопротеины, состоящие примерно из 160 аминокислотных остатков. секретируются в ответ на заражение вирусами и препятствуют распространению вирусной инфекции. является очень активным неспецифическим противовирусным агентом
двухцепочечная РНК индуцирует синтез 3 типов интерферонов. Связываясь с рецепторами на плазматической мембране заражённых клеток, интерфероны стимулируют синтез ферментов, способных разрушать мРНК вирусов, препятствуя экспрессии вирусных генов в клетках эукариотов.
Исследование механизма действия интерферонов показало, что они:
- рибонуклеазы - фермента, расщепляющего матричные и рибосомныеРНК;
- стимулируют синтез протеинкиназы, которая фосфорилирует иинактивирует фактор инициации eIF2.
интерфероны, полученные промышленным путём используют при лечении обычной простуды, гриппа, полиомиелита, ветряной оспы, герпеса, вируса гепатита, гемобластозов.
1.Общая схема синтеза и распада пиримидиновых нуклеотидов. Регуляция. Оротацидурия.
2.Общая схема синтеза и распада пуриновых нуклеотидов. Регуляция. Подагра.
3.Синтез дезоксирибонуклеотидов. Регуляция.
4.Общая схема распада нуклеиновых кислот, ферменты, субстраты, продукты.
5.Азотистые основания, входящие в структуру нуклеиновых кислот – пуриновые и пиримидиновые.
6.Нуклеотиды, содержащие рибозу и дезоксирибозу. Структура. Номенклатура.
7.Первичная структура нуклеиновых кислот. ДНК и РНК –черты сходства и различия состава, локализации в клетке, функции.
8.Вторичная структура ДНК (модель Уотсона и Крика). Связи, стабилизирующие вторичную структуру ДНК. Комплементарность. ПравилоЧаргаффа. Полярность. Антипараллельность.
9.Гибридизация нуклеиновых кислот. Денатурация и ренативация ДНК. Гибридизация (ДНК-ДНК, ДНК-РНК). Методы лабораторной диагностики, основанные на гибридизации нуклеиновых кислот.
10.Третичная структура ДНК. Роль гистоновых и негистоновых белков в компактиза-ции ДНК. Организация хроматина. Ковалентная модификация гистонов и ее роль в регуляции структуры и активности хроматина.
11.Репликация. Принципы репликации ДНК. Стадии репликации. Инициация. Белки и ферменты, принимающие участие в формировании репликативной вилки
12.Элонгация и терминация. Ферменты. Асимметричный синтез ДНК. Фрагменты Оказаки. Роль ДНК-лигазы в формировании непрерывнойотстающей цепи.
13.Теломерная ДНК. Синтез теломерной ДНК.
14.Повреждения и репарация ДНК. Виды повреждений. Способы репарации. Дефек-ты репарационных систем и наследственные болезни.
15.Транскрипция у прокариот. Характеристика компонентов системы синтеза РНК.
Структура ДНК-зависимой РНК-полимеразы: роль субъединиц (α2ββ′δ). Инициа-ция процесса.
16.Элонгация, терминация транскрипции (ρ-независимая, ρ-зависимая терминация)
17.Особенности транскрипции у эукариот. Структура белков, регулирующих процесс
транскипции.
18.Первичный транскрипт и его процессинг. Рибозимы какпример каталитической активности нуклеиновых кислот. Биороль.
19.Регуляция транскрипции у прокариот. Теория оперона,регуляция по типу индук-
ции и репрессии (примеры).
20.Механизмы регуляции экспрессии генов у эукариот.
21.Постранскрипционная регуляция у эукариот, обеспечивающая разнообразие бел-ков: альтернативный сплайсинг. Редактирование РНК.
22.Механизмы генетической изменчивости. Наследственныеболезни
23.Биосинтез белков (трансляция). Основные компоненты белоксинтезирующей системы: аминокислоты, т-РНК, рибосомы, источники энергии, белковые факторы, ферменты.
24.Строение и функции рибосом. Связывающие и каталитическик центры рибосом.
25.Активация аминокислот. Аминоацил-т-РНК синтетазы, субстратная специфичность.
26.Сборка полипептидной цепи на рибосоме. Образование инициаторного комплекса
у прокариот. Особенности стадии инициации у эукариот.
27.Элонгация: образование пептидной связи (р-ция транспептидации). Транслокация.
Транслоказа. Терминация. Роль белковых факторов на каждой из стадий трансляции.
28.Регуляция биосинтеза белков на уровне трансляции. Изменение скорости трансляции (на примере синтеза глобина, апоферритина).
29.Процессинг первичных полипептидных цепей после трасляции: частичный протеолиз, образование ковалентных связей, присоединение простетических групп, ковалентная модификация аминокислотных остатков (гликозилирование, метилирование, фосфорилирование, ацетилирование).
30.Фолдинг белков. Ферменты. Роль шаперонов в фолдинге белка. Фолдинг белковой молекулы с помощью шаперониновой системы. Болезни, связанные с нарушением фолдинга белка.
31.Особенности синтеза и процессинга секретируемых белков (на примере коллагена и инсулина).
32.Различия в продолжительности жизни белков. Убиквитинзависимая система протеолиза.
33.Полиморфизм белков и происхождение разнообразия антител.
34.Лекарственные препараты – ингибиторы матричных биосинтезов. Вирусы и токсины ингибиторы матричных синтезов в эукариотических клетках. Интерфероны







