Рис.18
Пируэтная тахикардия Рис.19. Тахикардия с неправильным ритмом и широкими полиморфными желудочковыми комплексами; характерна типичная синусоидальная картина, при которой группы из двух и более желудочковых комплексов с одним направлением сменяются группами комплексов с противоположным направлением. Наблюдается при удлинении интервала QT. ЧСС — 150—250 мин–1. Приступы обычно кратковременны, однако имеется риск перехода в фибрилляцию желудочков. Пароксизму часто предшествует чередование длинных и коротких циклов RR. В отсутствие удлинения интервала QT подобную желудочковую тахикардию называют полиморфной.
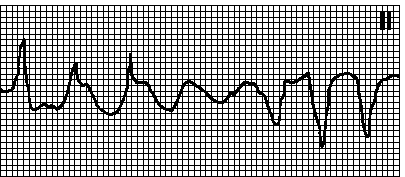
Рис.19
Фибрилляция желудочков (Рис.20). Хаотический неправильный ритм, комплексы QRS и зубцы T отсутствуют. В отсутствие СЛР фибрилляция желудочков быстро (в течение 4—5 мин) приводит к смерти.
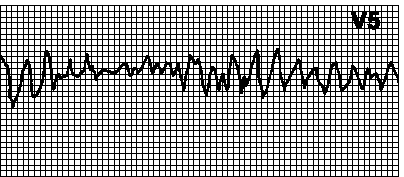
Рис.20
Аберрантное проведение (Рис.21). Проявляется широкими комплексами QRS вследствие замедленного проведения импульса от предсердий к желудочкам. Чаще всего это наблюдается, когда экстрасистолическое возбуждение достигает системы Гиса—Пуркинье в фазу относительной рефрактерности. Длительность рефрактерного периода системы Гиса—Пуркинье обратно пропорциональна ЧСС; если на фоне длинных интервалов RR возникает экстрасистола (короткий интервал RR) или начинается наджелудочковая тахикардия, то возникает аберрантное проведение. При этом возбуждение обычно проводится по левой ножке пучка Гиса, и аберрантные комплексы выглядят как при блокаде правой ножки пучка Гиса. Изредка аберрантные комплексы выглядят как при блокаде левой ножки пучка Гиса.
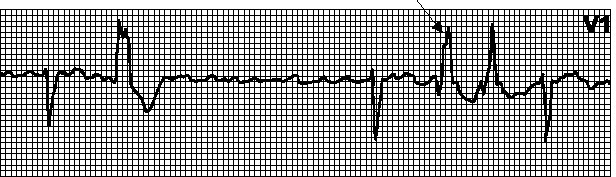
Рис.21
ЭКГ при тахикардиях с широкими комплексами QRS (дифференциальный диагноз желудочковой и наджелудочковой тахикардии с аберрантным проведением. Критерии желудочковой тахикардии:
а. АВ-диссоциация.
б. Отклонение электрической оси сердца влево.
в. QRS > 0,14 с.
г. Особенности комплекса QRS в отведениях V1 и V6.
Медикаментозное лечение аритмий сердца
Общие принципы
А. Начало терапии.Антиаритмические средства — одни из самых токсичных лекарственных средств. Почти все они обладают аритмогенным действием, то есть, способны усугублять имеющиеся аритмии или вызывать новые, в том числе угрожающие жизни. Нужно быть особенно осторожным, назначая антиаритмические средства классов Ia, Ic и III, нельзя также забывать, что риск их аритмогенного действия существенно повышается при ИБС и дисфункции левого желудочка. Так, препараты классов Ia и Ic раньше широко применяли для лечения не угрожающих жизни аритмий (мерцательная аритмия, трепетание предсердий, желудочковая и предсердная экстрасистолия), пока не оказалось, что (видимо, из-за аритмогенного действия) они повышают смертность. Начинать антиаритмическую терапию и менять дозы препаратов рекомендуют только в стационаре, тщательно следя за ЭКГ. Нужно, однако, помнить, что аритмогенное действие антиаритмических средств может проявиться далеко не сразу, а спустя длительное время после начала их приема.
Б. Оценка эффективности антиаритмической терапии. Выбор метода зависит от вида аритмии (например, фибрилляция желудочков несравненно более опасна, чем мерцательная аритмия, и надо полностью устранить возможность ее повторения) и от того, как больной ее переносит (например, желудочковую экстрасистолию лечить чаще всего не нужно, и если это все-таки делают, то ориентируются прежде всего на жалобы больного).
1. Холтеровский и постоянный(с записью на «бесконечную» ленту) мониторинг ЭКГ. Эти методы применяют, когда аритмия возникает часто и хорошо переносится, например, при экстрасистолии или неустойчивой желудочковой тахикардии. Однако для оценки того, в какой мере эффективна профилактика угрожающих жизни аритмий, мониторинг ЭКГ непригоден: во-первых, частота возникновения многих аритмий, в том числе неустойчивой желудочковой тахикардии, сильно меняется день ото дня, а, во-вторых, даже полное ее устранение не дает гарантии того, что устойчивая желудочковая тахикардия и фибрилляция желудочков у данного больного не повторятся.
2. Провокационные пробы
а. Нагрузочные пробы помогают оценить эффективность антиаритмической терапии, особенно если имеется явная связь между повышением симпатического тонуса и возникновением аритмии. Если наряду с устойчивой желудочковой тахикардией имеется частая желудочковая экстрасистолия (> 10 мин–1), то подбор терапии с помощью нагрузочных проб в сочетании с холтеровским мониторингом ЭКГ так же эффективен, как и с помощью электрофизиологического исследования сердца.
б. Электрофизиологическое исследование сердца:через эндокардиальные электроды записывают электрограммы из разных отделов сердца и проводят программируемую ЭКС, пытаясь вызвать пароксизмальные тахикардии. С появлением радиочастотной катетерной деструкции необходимость в электрофизиологических исследованиях для подбора терапии у больных с пароксизмальными наджелудочковыми тахикардиями резко уменьшилась, но при желудочковых тахиаритмиях значение данного метода по-прежнему велико. С помощью программируемой ЭКС можно вызвать устойчивую желудочковую тахикардию или фибрилляцию желудочков у большинства больных, переживших остановку кровообращения, и у 95% больных с устойчивой мономорфной желудочковой тахикардией. После того как в ходе исследования удалось вызвать желудочковую тахикардию, начинается подбор препарата, на фоне которого вызвать ее уже не удастся. Если же желудочковую тахикардию удается вызвать и на фоне лечения, то оно, скорее всего, данному больному не подходит. Недостатки такой тактики следующие: 1) у одного и того же больного и без лечения электрофизиологическое исследование в разное время дает разные результаты (недостаточная воспроизводимость), 2) с прогрессированием поражения сердца однажды подобранное лечение теряет эффективность, 3) длительный прием антиаритмических препаратов чреват осложнениями. В связи со всем этим антиаритмическая терапия все больше уступает место имплантации дефибрилляторов.
А. Класс Ia
1. Хинидинобладает средней эффективностью при предсердной и желудочковой экстрасистолии, при мерцательной аритмии и пароксизмальной наджелудочковой тахикардии (восстановление синусового ритма и предупреждение пароксизмов). Для предупреждения желудочковой тахикардии и фибрилляции желудочков в большинстве случаев неэффективен.
а. Дозы.Насыщающая доза хинидина сульфата — 600—1000 мг внутрь в несколько приемов в течение 6—10 ч, поддерживающая — 200 мг внутрь каждые 6 ч, максимальная — 2,4 г/сут. Препараты длительного действия — хинидина глюконат и хинидина полигалактуронат (в наименьшей степени раздражает слизистую желудка) — принимают каждые 8—12 ч. В/в введение хинидина почти не применяется, поскольку чревато падением АД.
б. Фармакокинетика.Хинидина сульфат и хинидина глюконат всасываются почти полностью. Концентрация хинидина в сыворотке достигает максимума через 90 мин после приема хинидина сульфата и через 3—4 ч после приема хинидина глюконата. T1/2 хинидина — 5—8 ч, у пожилых людей и при печеночной недостаточности он выводится значительно дольше, а при сердечной и почечной недостаточности его выведение почти не замедляется. Терапевтическая концентрация — 1,3—5 мкг/мл.
в. Побочные эффектынередко настолько выражены, что требуют отмены хинидина. Самые частые — тошнота, рвота, понос, боль в животе, снижение аппетита. Иногда наблюдаются симптомы отравления хинином — шум в ушах, снижение слуха, нарушения зрения, оглушенность, спутанность сознания, психоз. Аллергия проявляется сыпью, лихорадкой, тромбоцитопенией и гемолитической анемией. В 1—3% случаев хинидин оказывает аритмогенное действие, часто в виде пируэтной тахикардии; гипокалиемия, гипомагниемия, дисфункция левого желудочка еще больше увеличивают ее риск. Если интервал QT удлиняется более чем на 25% или QTc достигает 0,50 с, хинидин, как и все остальные препараты класса Ia, отменяют. Если же у больного уже были пароксизмы пируэтной тахикардии, препараты этого класса вообще не назначают. При имеющихся нарушениях проводимости сердца хинидин способен еще усугубить их, однако из-за своего парасимпатолитического действия он может и улучшить АВ-проведение, поэтому при мерцательной аритмии и трепетании предсердий надо сначала снизить ЧСС, а потом уже назначать хинидин.
г. Лекарственные взаимодействия: увеличивает концентрацию дигоксина в сыворотке почти вдвое, усиливает действие варфарина. Фенобарбитал и фенитоин заметно укорачивают действие хинидина.
2. Прокаинамид обладает сходным с хинидином электрофизиологическим и терапевтическим действием. Кроме того, для купирования желудочковой тахикардии в/в введение прокаинамида столь же эффективно, сколь и лидокаина. Основной метаболит, N-ацетилпрокаинамид, действует подобно средствам класса III.
а. Дозы.Насыщающая доза — 750—1000 мг внутрь, поддерживающая — 2—4 г/сут в несколько приемов. Препараты длительного действия принимают 2—4 раза в сутки.
б. В/в введение чревато падением АД, поэтому скорость его не должна превышать 50 мг/мин. Введение продолжают до восстановления синусового ритма либо до расширения комплекса QRS на 50%. Насыщающая доза — до 17 мг/кг, поддерживающая — 2—5 мг/мин.
в. Фармакокинетика.После приема внутрь концентрация препарата в сыворотке достигает максимума через 1 ч, после в/в введения — немедленно. Прокаинамид выводится печенью и почками. В печени прокаинамид подвергается ацетилированию, примерно 50% его превращается в N-ацетилпрокаинамид (который выводится почками в неизмененном виде), у лиц с низкой активностью ацетилирующих ферментов этот процесс резко замедлен, что ведет к накоплению прокаинамида и увеличивает риск побочного действия. T1/2 прокаинамида — 3 ч, при сердечной и почечной недостаточности он выводится значительно дольше. T1/2 N-ацетилпрокаинамида — 6—8 ч, при тяжелой почечной недостаточности — до 70 ч. Терапевтическая концентрация прокаинамида — 4—10 мкг/мл, а вместе с N-ацетилпрокаинамидом — 6—20 мкг/мл. Риск побочного действия резко возрастает при их суммарной концентрации выше 30 мкг/мл.
г. Побочные эффекты. У 30% больных (преимущественно у лиц с низкой активностью ацетилирующих ферментов) развивается волчаночный синдром,он проявляется лихорадкой, плевритом, перикардитом, гепатомегалией, артралгией; поражения почек при нем обычно нет. После отмены прокаинамида волчаночный синдром проходит. У 75% больных, длительно получающих прокаинамид, в крови появляются антинуклеарные антитела (титр их часто высокий), но отмены препарата это не требует. Возможен агранулоцитоз (аллергическая реакция замедленного типа). Аритмогенное действие и изменения ЭКГ — как у хинидина.
3. Дизопирамид обладает сходным с хинидином электрофизиологическим и терапевтическим действием. Возможно, дизопирамид способен предотвращать нейрогенные обмороки, но в клинических испытаниях это подтвердить не удалось.
а. Дозы.Поддерживающая доза — 100—300 мг внутрь каждые 6—8 ч, препараты длительного действия принимают каждые 12 ч. При печеночной и сердечной недостаточности и при умеренной почечной недостаточности (СКФ ³ 40 мл/мин) максимальная доза — 100 мг внутрь каждые 6 ч. При СКФ < 40 мл/мин начинают с насыщающей дозы, 200 мг внутрь, затем назначают по 100 мг внутрь 2 раза в сутки (если СКФ ³ 15 мл/мин) или 1 раз в сутки (если СКФ < 15 мл/мин).
б. Фармакокинетика.После приема внутрь концентрация препарата в сыворотке достигает максимума через 1 ч. T1/2 — 4—10 ч, терапевтическая концентрация — 2—5 мкг/мл.
в. Побочные эффекты. Дизопирамид обладает самым сильным из препаратов класса Ia отрицательным инотропным действием и способен вызвать или усугубить сердечную недостаточность. Дизопирамид обладает также выраженным парасимпатолитическим действием: вызывает сухость во рту, задержку мочи, запоры, нечеткость зрения, боль в животе, обострение глаукомы, угнетение бронхиальной секреции, при миастении — криз. Возможна также гипогликемия, особенно на фоне почечной недостаточности. Аритмогенное действие и изменения ЭКГ — как у хинидина.
Б. Класс Ib
1. Лидокаин эффективен при желудочковых тахиаритмиях, особенно у больных инфарктом миокарда. В прошлом лидокаин вводили при инфаркте миокарда и с профилактической целью, но сейчас это делать перестали.
а. Дозы.Сначала — 1 мг/кг в/в струйно, затем 0,5 мг/кг в/в струйно каждые 8—10 мин до достижения эффекта или общей дозы 3 мг/кг, затем переходят на в/в инфузию со скоростью 2—4 мг/мин. При сердечной, печеночной недостаточности, при шоке и у лиц старше 70 лет скорость в/в инфузии — 1—2 мг/мин. В ходе СЛР, пока не установлен венозный катетер, можно вводить препарат в/м (300 мг) или эндотрахеально (5 мг/кг).
б. Фармакокинетика.T1/2 у здоровых людей — 1—2 ч, при неосложненном инфаркте — 4 ч, при инфаркте миокарда, осложненном сердечной недостаточностью, — 10 ч, а при кардиогенном шоке — еще больше. Выведение лидокаина также замедляется при длительной инфузии, у пожилых, при печеночной недостаточности, при приеме пропранолола и циметидина. При длительной инфузии лидокаина необходимо следить за его концентрацией в сыворотке. Терапевтическая концентрация — 2—6 мкг/мл, но побочные эффекты возможны даже при более низкой концентрации.
в. Побочные эффекты. Токсическое действие на ЦНС проявляется судорогами, нарушениями сознания, изредка — остановкой дыхания и проходит после отмены препарата. Отрицательное инотропное действие может проявиться только при использовании высоких доз. Возможна остановка синусового узла, АВ-блокада и асистолия. Введение лидокаина при мерцательной аритмии и трепетании предсердий может вызвать увеличение ЧСС.
2. Мексилетин похож на лидокаин по химической структуре и обладает сходным с ним электрофизиологическим действием, но в целом менее эффективен. Монотерапия мексилетином для предотвращения устойчивой желудочковой тахикардии и фибрилляции желудочков малоэффективна, иногда мексилетин назначают в сочетании с препаратами класса Ia. Главная область применения мексилетина — предупреждение пируэтной тахикардии.
а. Дозы.Насыщающая доза — 400 мг внутрь, поддерживающая — 200 мг внутрь каждые 8 ч. Менять дозу можно не чаще чем каждые 2—3 сут. Применяя мексилетин в сочетании с препаратами классов Ia и III, можно каждый из них назначать в меньшей дозе.
б. Фармакокинетика.Концентрация в сыворотке достигает максимума через 2—4 ч после приема. Мексилетин выводится печенью (90%) и в неизмененном виде — почками (10%). T1/2 у здоровых людей — 10 ч, при печеночной недостаточности и инфаркте миокарда — 20 ч и более. Терапевтический диапазон узок: терапевтическая концентрация — 0,75—2 мкг/мл, токсическая — более 2 мкг/мл.
в. Побочные эффекты. Токсическое действие на ЦНС проявляется тремором, головокружением, нечеткостью зрения, при высокой сывороточной концентрации мексилетина могут появиться дизартрия, диплопия, нистагм и нарушения сознания. Часто встречаются тошнота и рвота. Аритмогенное действие (в частности, лекарственная пируэтная тахикардия) не столь выражено, как у препаратов классов Ia и III.
г. Лекарственные взаимодействия.Мексилетин нельзя применять в сочетании с лидокаином из-за усиления токсичности последнего. Мексилетин увеличивает концентрацию теофиллина в сыворотке. Рифампицин и фенитоин усиливают метаболизм мексилетина в печени, тем самым понижая его концентрацию в сыворотке.
3. Токаинид ранее назначали для предотвращения желудочковых тахиаритмий,в том числе в сочетании с препаратами класса Ia, но он оказался малоэффективен.
а. Дозы: 400—600 мг внутрь 3 раза в сутки.
б. Фармакокинетика.Концентрация в сыворотке достигает максимума через 2 ч после приема. T1/2 — 10—14 ч, при инфаркте миокарда выведение замедляется. Терапевтический диапазон узок: терапевтическая концентрация — 4—10 мкг/мл, токсическая — более 10 мкг/мл.
в. Побочные эффекты.Токсическое действие на ЦНС — как у мексилетина. Часто встречаются тошнота и рвота. Токаинид оказывает побочное действие на легкие (пневмонит, пневмосклероз, фиброзирующий альвеолит), может вызвать агранулоцитоз, лейкопению, апластическую анемию и тромбоцитопению (в 0,1—0,2% случаев), поэтому нужно следить за анализами крови: в первые 3 мес. их проводят еженедельно, а затем ежемесячно.
4. Фенитоинв основном применяют при гликозидной интоксикации, реже — при врожденном удлинении интервала QT. Дозы: насыщающая — 250 мг в/в в течение 10 мин (максимальная скорость введения — 50 мг/мин), затем (если позволяет АД) каждые 5 мин вводят по 100 мг до достижения эффекта или общей дозы 1 г, при этом тщательно следят за ЭКГ, АД и неврологическим статусом. Длительную в/в инфузию проводить не рекомендуется.
5. Морацизин по химической структуре похож на фенотиазины, по электрофизиологическому действию — одновременно на препараты классов Ia и Ib. Морацизин иногда используют для лечения желудочковых аритмий, но для предупреждения желудочковой тахикардии и фибрилляции желудочков он малоэффективен.
а. Дозы: 200—300 мг внутрь 3 раза в сутки.
б. Побочные эффекты. У 3% больных проявляется аритмогенное действие морацизина. Другие побочные эффекты: тошнота, рвота, понос, тремор, депрессия, головная боль, головокружение, дурнота, нистагм.
в. Лекарственные взаимодействия. Морацизин снижает концентрацию теофиллина в сыворотке.
В. Класс Ic
1. Флекаинид в целом более эффективен, чем другие препараты класса I, для лечения мерцательной аритмии, трепетания предсердий и пароксизмальных наджелудочковых тахикардий. Эффективен он и при желудочковых аритмиях, но тут его применение сильно ограничено опасностью аритмогенного действия и внезапной смерти.
а. Дозы.Начинают с 50—100 мг внутрь 2 раза в сутки, затем дозу увеличивают каждые 4 сут на 100 мг/сут до достижения эффекта или максимальной дозы 400 мг/сут. При использовании более высоких доз резко увеличивается риск побочного действия, особенно при сердечной и почечной недостаточности.
б. Фармакокинетика.Терапевтическая концентрация в сыворотке — 0,4—0,9 мкг/мл. T1/2 — 20 ч, при сердечной и почечной недостаточности он выводится дольше.
в. Побочные эффекты. Флекаинид сильно замедляет внутрисердечное проведение. Нормальным на фоне его приема считается удлинение интервалов PQ и QRS на 20%. Если же они удлиняются на 50%, то отменять флекаинид не надо, но необходимо тщательно следить за ЭКГ. Показания к отмене флекаинида или уменьшению дозы: PQ ³ 0,3 с, QRS ³ 0,2 с, двухпучковая блокада ножек пучка Гиса, АВ-блокада 2-й степени и полная АВ-блокада. Аритмогенное действиенаблюдается у 5%, чаще при желудочковых аритмиях, на фоне органических заболеваний сердца и при концентрации флекаинида в сыворотке выше 1 мкг/мл. При мерцательной аритмии и трепетании предсердий, прежде чем использовать флекаинид, надо снизить ЧСС: описаны случаи перехода мерцательной аритмии в трепетание предсердий с АВ-проведением 1:1. Из-за отрицательного инотропного действия флекаинид может усугубить сердечную недостаточность. Флекаинид увеличивает порог дефибрилляции и ЭКС, иногда вдвое, что вынуждает при его применении у больных с имплантированными дефибрилляторами и кардиостимуляторами менять ранее подобранную силу электрических импульсов. Другие побочные эффекты: оглушенность, нечеткость зрения, дурнота, тошнота, головная боль, раздражительность.
г. Лекарственные взаимодействия. Несколько увеличивает концентрацию дигоксина и пропранолола в сыворотке. Пропранолол, в свою очередь, увеличивает концентрацию флекаинида. Ее также увеличивает амиодарон, поэтому дозу флекаинида при их совместном использовании уменьшают на треть.
2. Пропафенон похож на флекаинид по химической структуре и обладает сходным терапевтическим действием. Электрофизиологические свойства — как у других препаратов класса Ic и, отчасти, — бета-адреноблокаторов.
а. Дозы. Начинают со 150 мг внутрь 3 раза в сутки, затем дозу увеличивают каждые 3—4 сут до достижения эффекта или максимальной дозы 900 мг/сут. На фоне почечной недостаточности необходима осторожность: активные метаболиты пропафенона выводятся почками. При печеночной недостаточности дозы на 20—30% ниже.
б. Фармакокинетика.Концентрация в плазме достигает максимума через 2—3 ч после приема. Препарат выводится печенью. Биодоступность растет с увеличением дозы: утроение дозы приводит к десятикратному повышению концентрации в плазме. Терапевтическая концентрация — 0,2—1,5 мкг/мл. Концентрация в плазме, однако, мало соответствует силе действия препарата.
в. Побочные эффекты. Аритмогенное действие — как у флекаинида. Пропафенон, кроме того, обладает некоторыми побочными эффектами бета-адреноблокаторов, в частности вызывает бронхоспазм. Из-за отрицательного инотропного действия может вызвать или усугубить сердечную недостаточность. Другие побочные эффекты: дурнота, тошнота, нарушение вкусовых ощущений, нечеткость зрения.
г. Лекарственные взаимодействия. Увеличивает концентрацию дигоксина в сыворотке, усиливает действие бета-адреноблокаторов и варфарина. Средства, понижающие активность микросомальных ферментов печени, замедляют метаболизм пропафенона и повышают его концентрацию в сыворотке.
Г. Класс II — бета-адреноблокаторы — конкурируют с катехоламинами за бета-адренорецепторы, тем самым снижая автоматизм синусового узла и замедляя АВ-проведение. Именно замедление АВ-проведения, в результате чего прерывается контур повторного входа волны возбуждения, — основной механизм антиаритмического действия бета-адреноблокаторов при пароксизмальных наджелудочковых тахикардиях. Благоприятное же действие их при желудочковых аритмиях объясняется в основном уменьшением потребления миокардом кислорода. Побочные эффекты: бета-адреноблокаторы обладают отрицательным инотропным действием (могут вызвать или усугубить сердечную недостаточность) и отрицательным хронотропным действием (могут вызвать синусовую брадикардию и АВ-блокаду). Способны также усугубить спазм коронарных артерий (из-за резкого увеличения альфа-адренергической активности). Резкая отмена бета-адреноблокаторов может спровоцировать стенокардию и аритмии, поэтому отменяют их постепенно, снижая дозу в течение нескольких суток. Бета-адреноблокаторы особенно эффективны в следующих случаях.
1. После инфаркта миокарда. Бета-адреноблокаторы снижают риск внезапной смерти и увеличивают продолжительность жизни.
2. Аритмии при тиреотоксикозе, феохромоцитоме и повышенном симпатическом тонусе (при физической и эмоциональной нагрузке, в послеоперационном периоде).
3. Мерцательная аритмия и трепетание предсердий. Бета-адреноблокаторы уменьшают ЧСС во время пароксизмов. Кроме того, они снижают вероятность мерцательной аритмии после операций на сердце.
4. Пароксизмальные наджелудочковые тахикардии.
5. Синусовая тахикардия (хотя лечения обычно не требуется либо оно направлено на устранение ее причины).
6. Врожденное удлинение интервала QT. Бета-адреноблокаторы предотвращают пируэтную тахикардию.
Д. Класс III
1. Амиодарон удлиняет реполяризацию и рефрактерный период предсердий и желудочков, снижает автоматизм синусового узла и замедляет АВ-проведение. Кроме того, амиодарон — неконкурентный альфа- и бета-адреноблокатор, он уменьшает ОПСС и АД, особенно при в/в введении. У больных с тяжелой сердечной недостаточностью амиодарон может еще усугубить ее. Амиодарон — сильное антиаритмическое средство, обладающее, однако, множеством побочных эффектов, особенно если принимать его в больших дозах. Эффективность амиодарона для предупреждения желудочковой тахикардии и фибрилляции желудочков составляет 60%. Антиаритмическое действие амиодарона проявляется через 5—15 сут и достигает максимума через 4—6 нед после начала его приема.
а. Желудочковые тахиаритмии. Оказалось, что при рецидивирующей желудочковой тахикардии без пульса и фибрилляции желудочков в/в введение амиодарона в ходе СЛР столь же эффективно, сколь и бретилия, причем в дальнейшем у больных, которым вводили амиодарон, артериальная гипотония была не столь выраженной, как после бретилия.
б. Предсердные тахиаритмии.Из-за высокой вероятности побочных эффектов амиодарон при предсердных тахиаритмиях применяют нечасто, хотя он и эффективен. Так, амиодарон способен и купировать пароксизмы мерцательной аритмии и трепетания предсердий, и предупреждать их. Кроме того, он снижает ЧСС при мерцательной аритмии, но делает это не так быстро, как антагонисты кальция, бета-адреноблокаторы и дигоксин.
в. Дозы
1) Прием внутрь:насыщающая доза — 800—1600 мг 1 раз в сутки в течение 1—2 нед, поддерживающая — обычно не более 400 мг/сут. Во избежание побочных эффектов нужно стараться подобрать минимальную эффективную дозу.
2) В/в введение: насыщающая доза — 150 мг струйно в течение 10 мин, затем со скоростью 1 мг/мин в течение 6 ч, далее — 0,5 мг/мин. Приведенные дозы эквивалентны приему 1000—1200 мг/сут внутрь. Более быстрое в/в введение чревато падением АД. При повторных пароксизмах можно повторно вводить по 150 мг в/в струйно.
г. Фармакокинетика.Всасывается около 50% принятой дозы, концентрация в плазме достигает максимума через 3—8 ч после приема. Препарат выводится печенью. Выведение амиодарона имеет две фазы: через 3—5 сут концентрация в плазме уменьшается вдвое (амиодарон выводится из хорошо перфузируемых тканей), затем выведение резко замедляется, и еще вдвое концентрация падает лишь через 26—107 сут после приема. Терапевтическая концентрация — 1—2,5 мкг/мл, измерять ее имеет смысл только для того, чтобы определить степень всасывания и проверить, принимает ли больной препарат.
д. Побочные эффекты появляются у 75% больных, получающих амиодарон в течение 5 лет, и требуют отмены препарата у 18—37%. Многие побочные эффекты имеют дозозависимый характер: при использовании низких доз (200—300 мг/сут) они возникают реже.
1) Пневмонит встречается у 1—15% больных, в зависимости от длительности приема амиодарона и дозы. Если доза ниже 300 мг/сут, то риск невелик. Проявления: сухой кашель, одышка, влажные хрипы, легочные инфильтраты на рентгенограмме грудной клетки, снижение диффузионной способности легких, положительный результат сцинтиграфии легких с 67Ga. Если пневмонит удалось обнаружить рано, то он обратим, в противном случае развивается пневмосклероз; в 10% случаев он приводит к смерти. Рентгенографию грудной клетки и исследование функции внешнего дыхания на фоне приема амиодарона проводят каждые 6 мес.
2) Фотосенсибилизация — частый побочный эффект. Открытые участки кожи становятся фиолетовыми; нормальный цвет кожи возвращается лишь через 12—24 мес. после отмены препарата.
3) Гипотиреоз и тиреотоксикоз.На фоне приема амиодарона вероятность их составляет 2—5% в год. Уровень тиреоидных гормонов проверяют, по крайней мере 1 раз в год. На гипотиреоз указывает резкое повышение уровня ТТГ, на тиреотоксикоз — повышение уровня T3. При гипотиреозе можно назначить левотироксин и продолжать прием амиодарона.
4) Микроотложения в роговице обнаруживают при осмотре со щелевой лампой почти у всех больных, принимающих амиодарон в течение 6 мес. Зрение обычно не нарушено, некоторые больные жалуются на появление ореола вокруг светящихся объектов. После отмены амиодарона микроотложения в роговице исчезают. Есть, однако, сообщения о возникновении неврита зрительного нерва, приведшего к слепоте.
5) Сердечно-сосудистые нарушения. Амиодарон часто вызывает бессимптомную синусовую брадикардию и замедление АВ-проведения, удлиняет интервалы PQ и QT, расширяет комплекс QRS. На фоне имеющихся нарушений проводимости может произойти резкое урежение ритма и развиться АВ-блокада. Аритмогенное действие амиодарона (включая пируэтную тахикардию) — редкость, тем не менее, другие препараты, удлиняющие интервал QT, принимать вместе с амиодароном не следует.
6) Другие побочные эффекты. Нередко встречаются тошнота и снижение аппетита, особенно на фоне насыщающих доз. В начале лечения часто наблюдается преходящее бессимптомное повышение активности печеночных ферментов. Если, однако, активность их выросла втрое (а при исходно повышенной активности — вдвое), то амиодарон отменяют или снижают его дозу.
е. Лекарственные взаимодействия.С началом приема амиодарона дозы варфарина и дигоксина уменьшают вдвое и следят за их концентрацией в сыворотке.
2. Соталол. У 40% больных соталол снижает частоту и длительность неустойчивых пароксизмов желудочковой тахикардии, у 70% предотвращает устойчивую желудочковую тахикардию и фибрилляцию желудочков, у 35% предотвращает индуцируемую при электрофизиологическом исследовании устойчивую желудочковую тахикардию. Эффективен он и для предупреждения мерцательной аритмии и трепетания предсердий, но тут его применение ограничено опасностью аритмогенного действия.
а. Дозы.Начинают с 80 мг внутрь 2 раза в сутки, при необходимости дозу увеличивают каждые 2—3 сут, обычно до 240—320 мг/сут. При угрожающих жизни желудочковых аритмиях иногда назначают 480—640 мг/сут.
б. Фармакокинетика.Концентрация в плазме достигает максимума через 2,5—4 ч после приема. Выводится в основном почками в неизмененном виде, T1/2 — 12 ч. При почечной недостаточности увеличивают интервал между приемами (и уменьшают дозы): при СКФ < 60 мл/мин — до 24 ч, при СКФ < 30 мл/мин — до 36—48 ч, при СКФ < 10 мл/мин — еще больше.
в. Побочные эффекты. Аритмогенное действие выражается в удлинении интервала QT и пируэтной тахикардии, оно имеет дозозависимый характер. Другие препараты, удлиняющие интервал QT, принимать вместе с соталолом не следует. Остальные побочные эффекты обусловлены тем, что соталол — бета-адреноблокатор. Часто наблюдаются брадиаритмии, особенно когда вместе с соталолом назначают другие средства, замедляющие синусовый ритм и АВ-проведение. При выраженной синусовой брадикардии, АВ-блокаде 2-й степени и полной АВ-блокаде соталол противопоказан. Соталол способен вызвать или усугубить сердечную недостаточность (в 3% случаев) и бронхоспазм.
3. Бретилия тозилат удлиняет потенциал действия и рефрактерный период волокон Пуркинье и миокарда желудочков. Бретилий действует на симпатические нервные окончания: сначала вызывает выброс норадреналина, а затем подавляет и его выброс, и обратный захват, поэтому сначала бретилий на короткое время повышает автоматизм. Действие бретилия, видимо, в основном обусловлено его влиянием на рефрактерность миокарда и на симпатический тонус. Его применяют только при угрожающих жизни желудочковых аритмиях. В ряде случаев он оказывается эффективен при остановке кровообращения, когда другие средства уже не помогают.
а. Дозы.Начальная доза при фибрилляции желудочков и желудочковой тахикардии без пульса — 5—10 мг/кг в/в струйно непосредственно перед дефибрилляцией, при необходимости — повторно каждые 5 мин до общей дозы 35 мг/кг. В случаях, не требующих дефибрилляции, быстро бретилий не вводят (во избежание падения АД, тошноты и рвоты): сначала в/в струйно в течение 10 мин вводят 5—10 мг/кг, затем проводят инфузию со скоростью 2 мг/мин.
б. Фармакокинетика.Действие начинается через несколько минут после введения и достигает максимума через 15—20 мин. T1/2 — 4—17 ч. Выводится в основном почками.
в. Побочные эффекты. Начальный выброс норадреналина может вызвать кратковременный подъем АД и синусовую тахикардию. Аритмогенное действие тоже, видимо, обусловлено выбросом норадреналина. При длительном введении часто наблюдаются артериальная гипотония, тошнота и рвота.
г. Лекарственные взаимодействия. Бретилий усиливает действие катехоламинов (добутамина, дофамина, норадреналина). Его применение на фоне диуретиков и вазодилататоров приводит к более выраженному снижению АД.
4. Ибутилид — новый антиаритмический препарат, он удлиняет потенциал действия и рефрактерный период в предсердиях и желудочках, почти не влияя на проведение. Ибутилид предназначен для купирования пароксизмов мерцательной аритмии и трепетания предсердий. По предварительным данным, в течение 4 ч после введения ибутилида синусовый ритм восстанавливается у 45% больных с мерцательной аритмией и у 60% — с трепетанием предсердий.
а. Дозы.При весе до 60 кг вводят 0,01 мг/кг, а при большем весе — 1 мг, в/в в течение 10 мин. Если через 10 мин после введения синусовый ритм не восстановился, ибутилид вводят повторно в той же дозе.
б. Фармакокинетика.Действие начинается сразу; у половины из тех, у кого ибутилид оказывается эффективен, синусовый ритм восстанавливается уже во время введения первой дозы, у остальных — в следующие 1—2 ч. T1/2 — 6 ч. Метаболизируется в печени, выводится почками.
в. Побочные эффекты.Ибутилид обладает выраженным аритмогенным действием, в частности в 4—5% случаев он вызывает пируэтную тахикардию, поэтому во время введения препарата надо иметь наготове дефибриллятор и другое реанимационное оборудование, а в следующие 4 ч внимательно наблюдать за больным. Опыт применения ибутилида невелик, особенно у тяжелых больных.
Е. Класс IV — антагонисты кальция — блокируют медленные кальциевые каналы. В качестве антиаритмических средств используют верапамил и дилтиазем. Они удлиняют фазу спонтанной диастолической деполяризации в синусовом и АВ-узле и участках предсердий и желудочков, обладающих патологической эктопической активностью. Антагонисты кальция подавляют автоматизм и замедляют внутрисердечное проведение, причем сила их действия зависит от концентрации.
1. Верапамил используют в основном для снижения ЧСС при мерцательной аритмии и трепетании предсердий и для купирования пароксизмальных наджелудочковых тахикардий. В/в введение верапамила и аденозина одинаково эффективно для купирования наджелудочковых тахикардий, но верапамил вызывает более длительную артериальную гипотонию.
а. Дозы. Начинают с 5—10 мг в/в струйно в течение 2—3 мин, тщательно следя за ЭКГ и АД. При необходимости через 15—30 мин введение повторяют в той же дозе. Длительную в/в инфузию почти не применяют.
б. Фармакокинетика.Антиаритмическое действие начинается через 1—2 мин после введения и достигает максимума через 10—15 мин. Замедление АВ-проведения сохраняется до 6 ч. Действие на гемодинамику начинается через 3—5 мин после введения и длится около 20 мин. После приема внутрь концентрация препарата в плазме достигает максимума через 1—2 ч. T1/2 — 4—12 ч. На 70% выводится почками. После приема внутрь большая часть верапамила инактивируется при первом прохождении через печень (только 20—35% препарата попадает в системный кровоток).
в. Побочные эффекты. Наибольшую опасность представляют брадиаритмии, включая полную АВ-блокаду и асистолию. Артериальная гипотония обычно не слишком опасна, она носит преходящий характер. Чтобы предотвратить ее, можно перед тем, как вводить верапамил, ввести препараты кальция (например, глюконат кальция, 1 г в/в). Верапамил противопоказан при синдроме слабости синусового узла, АВ-блокаде 2-й степени и полной АВ-блокаде, при синдроме WPW с пароксизмами мерцательной аритмии, при артериальной гипотонии и тяжелой сердечной недостаточности (при умеренной сердечной недостаточности его применяют с большой осторожностью). Побочное действие верапамила существенно усиливается при печеночной недостаточности. Сочетание верапамила с бета-адреноблокаторами сильно за









