Открытие цеолитных катализаторов, представляющих собой весьма нетипичные системы для окислительного катализа, поставило ряд вопросов фундаментального характера, среди которых вопрос о природе каталитической активности цеолитов вызывает наиболее оживленные дискуссии.
Для объяснения каталитической активности цеолитов были выдвинуты две гипотезы. Одна из них основана на традиционных представлениях о цеолитах как кислотных катализаторах, обладающих сильными бренстедовскими и льюисовскими кислотными центрами. Объяснение, исходящее из представлений о бренстедовских центрах, предполагает их способность протонировать молекулы закиси азота, что приводит к образованию гидроксил-катионов, которые далее атакуют молекулы бензола:
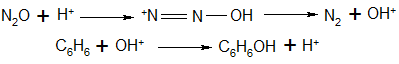 (40)
(40)
Эта гипотеза впервые была высказана в работе [42] и затем, с теми или иными оговорками, принята рядом других авторов [45,47]. Однако специальное исследование, выполненное позднее с привлечением инфракрасной спектроскопии, не подтвердило эту гипотезу [57].
Ряд исследователей связывают активность цеолитов с льюисовскими кислотными центрами, которые образуют координационно ненасыщенные атомы алюминия или галлия, вышедшие из кристаллической решетки [46,48,49,52]. Это объяснение основывается на том, что с увеличением жесткости условий высокотемпературной обработки цеолита, проводимой на воздухе [46,50], в вакууме [57] или в присутствии паров воды [52,58], возрастает как концентрация льюисовских кислотных центров, так и каталитическая активность цеолита в реакции окисления бензола в фенол. Однако авторы этих работ не приводят каких-либо количественных корреляций между кислотностью и каталитической активностью.
В работах Института катализа СО РАН развивается другой подход, основанный на представлениях окислительного катализа. Исходная позиция этого подхода заключается в том, что сама по себе алюмосиликатная матрица цеолита, независимо от её кислотных свойств, неспособна катализировать такую тонкую и трудную реакцию как окисление бензола в фенол. Причина каталитической активности, вероятнее всего, связана с примесью какого-либо переходного металла. Действительно, как выяснилось в дальнейшем, таким металлом оказалось железо - наиболее распространенная примесь, вносимая в основном с реагентами на стадии синтеза цеолита [41].
Роль железа была детально исследована на примере двух специально синтезированных Fe-содержащих цеолитных систем со структурой ZSM-5. Железо вводилось на стадии синтеза цеолитов и в одном случае его включали в Al-Si матрицу [59], а в другом - в чисто силикатную матрицу, синтезированную в отсутствие алюминия [60]. В обоих случаях самые чистые образцы, которые авторам удалось приготовить, принимая максимальные предосторожности против загрязнения железом (0,002-0,003 % масс. Fe), оказались неактивными. Активность появлялась только с введением железа, увеличиваясь по мере роста его концентрации. Это связано с тем, что железо в цеолите образует особые активные центры, названные a-центрами (их природа рассмотрена ниже), которые и обеспечивают протекание каталитической реакции. На рис. 3 показана зависимость концентрации каталитически активных центров от содержания Fe для обеих цеолитных систем. Несмотря на сходный характер, кривые существенно сдвинуты относительно друг друга по оси абсцисс. Так, введение в алюмосиликатную матрицу железа уже на уровне сотых долей процента приводит к образованию значительного количества a-центров, тогда как в случае силикатной матрицы для этого требуется ввести в 10-30 раз большее количество железа. Это говорит о том, что присутствие алюминия способствует образованию a-центров, хотя причина этого пока остается неясной. Одно из объяснений может заключаться в том, что активные комплексы Fe занимают катионнообменные позиции в цеолите и стабилизируются на атомах алюминия [49].
lg C a [центр/г]
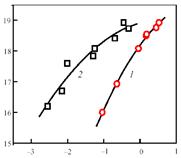
lg C Fe [% масс.]
Рис. 3. Зависимость концентрации a-центров от концентрации железа в цеолитах ZSM-5 состава Fe.Si (1) и Fe.Al.Si (2)
Интересно, что независимо от состава матрицы и количества введенного железа a-центры проявляют удивительную равноценность в своих каталитических свойствах. Это относится как к реакции разложения N2O [61], так и к реакции окисления бензола в фенол [41]. По отношению к последней реакции такой эффект хорошо виден из рис. 4, на котором приведена зависимость конверсии бензола от концентрации a-центров. Активность всех исследованных образцов описывается единой зависимостью и определяется только концентрацией a-центров. Согласно квантовохимическим расчетам [62], a-центры представляют собой биядерные комплексы железа, которые формируются на стадии выхода Fe из кристаллической решетки цеолита при его термических обработках. Аналогично внерешеточному алюминию, эти комплексы являются координационно ненасыщенными частицами и обладают льюисовской кислотностью. Учитывая сходный механизм образования внерешеточных частиц Fe и Al, естественно ожидать некоторую корреляцию между каталитической активностью и льюисовской кислотностью, что и наблюдали при различных высокотемпературных обработках одного и того же образца цеолита. Однако в случае образцов с различным химическим составом такая корреляция не должна существовать, что действительно и подтверждается [60]. Это объясняется тем, что в разных образцах неодинакова концентрация вне решеточных атомов Al, которые дают основной вклад в льюисовскую кислотность, но не дают вклада в каталитическую активность. Квантовохимические расчеты также не подтверждают каталитическую роль льюисовских центров [63].
Конверсия бензола,%
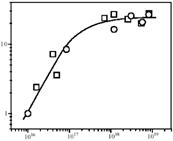
C a, a-центр/г
Рис. 4. Зависимость конверсии бензола от концентрации a-центров на цеолитах ZSM-5 состава Fe.Si  и Fe.Al.Si
и Fe.Al.Si  при 350 °С
при 350 °С
Каталитическая активность железа в реакциях окисления закисью азота подтверждена в ряде работ других авторов [50, 51, 64].
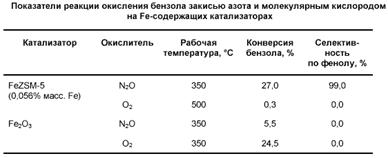
Интересно, что образование a-центров приводит к качественному изменению в состоянии железа по сравнению с атомами Fe на поверхности оксида Fe2O3. В составе a-центров атомы Fe теряют способность активировать молекулярный кислород, но приобретают повышенную способность к активации молекул N2O [61]. Это ярко проявляется в реакции окисления бензола с помощью этих молекул (табл. 1). Так, в присутствии закиси азота конверсия бензола составляет 27% при 350 0С, тогда как в присутствии О2. только 0,3% при 500 0С. Более того, при этом изменяется направление реакции: если при действии N2O с высокой селективностью образуется фенол, то в случае О2 регистрируются лишь продукты полного окисления. На оксиде железа ни один из окислителей не приводит к образованию фенола.
5. Специфика действия N2O как окислителя
Специфика закиси азота как окислителя - это один из наиболее важных вопросов, возникающих при исследовании реакции окисления бензола в фенол. Преимущества закиси азота по сравнению с O2 наглядно демонстрируют результаты, представленные в табл. 2. Естественно предположить, что столь сильное влияние природы окислителя связано с существенным изменением в состоянии поверхностного кислорода. Это предположение стимулировало постановку ряда работ по исследованию механизма реакции разложения закиси азота на цеолитах FeZSM-5, поскольку именно за счет этой реакции осуществляется поставка кислорода на поверхность катализатора.
Таблица 1
Исследования позволили установить, что разложение N2O протекает на a-центрах цеолита с образованием новой формы поверхностного кислорода, условно названной a-кислородом [65,66]. В низкотемпературной области реакция образования a-кислорода носит стехиометрический характер:
N2O + ()a = (O)a + N2 (41)
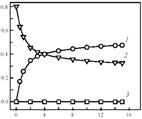
На рис. 5 приведена кинетическая кривая низкотемпературного разложения N2O в статической установке. Видно, что протекание реакции сопровождается выделением в газовую фазу только N2, тогда как образующийся кислород заполняет a-центры и остается полностью связанным на поверхности. По мере заполнения a-центров реакция прекращается.
Давление, мм.рт.ст.
Время, мин
Рис. 5. Изменение парциального давления N2 (1), N2O (2) и O2 (3) при разложении закиси азота на цеолите FeZSM-5 при 250 °С
До температуры 3000С a-кислород термически устойчив. Выше этой температуры он необратимо десорбируется в газовую фазу и реакция разложения N2O приобретает характер обычного каталитического процесса.
Для проведения дальнейших количественных исследований важно знать концентрацию a-кислорода. Существует несколько методов, позволяющих надежно определить данную величину. Это может быть выполнено как путем непосредственного измерения количества выделившегося N2 (или израсходованного N2O) в ходе реакции (41) или путем десорбции Оa в газовую фазу при нагревании образца выше 300 0С. Кроме того, удобно уже использовать реакцию изотопного обмена, в которую a-кислород легко вступает при комнатной температуре:
(16O)a + 18O2 = (18O)a + 16O18O (42)
В состоянии равновесия доли изотопа 18О в поверхностном a-кислороде и в кислороде газовой фазы равны, что позволяет рассчитать количество Оa, вступившего в обмен. Собственный кислород цеолита инертен в отношении изотопного обмена и не мешает измерению концентрации a-кислорода.
Исходя из максимального количества a-кислорода, которое может быть «посажено» на данном образце цеолита (уравнение 41), рассчитывается концентрация a-центров С a в предположении, что один атом кислорода занимает один центр. Значения С a, определенные разными методами, хорошо согласуются между собой [66]. Для наиболее активных образцов с достаточно высоким содержанием железа величина С a может достигать 100 мкмоль/г.
Изучению свойств a-кислорода посвящено значительное число работ, результаты которых рассмотрены в обзоре [67]. Особенно следует отметить низкую энергию связи Оa с поверхностью и очень высокую реакционную способность, благодаря которой он способен уже при комнатной температуре окислять различные углеводороды.
6. Стехиометрическая реакция бензола с a- кислородом
Установление специфической способности закиси азота генерировать a-форму поверхностного кислорода подводит нас к главному вопросу относительно механизма реакции, а именно, к вопросу об участии a-кислорода в образовании фенола.
Согласно общепринятой точке зрения, которая особенно ясно сформулирована в работах школы Борескова применительно к классическим оксидным катализаторам [69], поверхностный кислород, участвующий в парциальном окислении, не должен обладать низкой энергией связи с поверхностью и не должен иметь высокую реакционную способность, что находится в явном противоречии со свойствами a-кислорода. Поэтому идея соотнести образование фенола с генерацией a-кислорода требует серьезного экспериментального подтверждения.
Следует отметить, что идентификация поверхностных форм кислорода, принимающих участие в реакциях окисления, представляет собой очень трудную задачу. В условиях катализа при повышенных температурах происходят быстрые взаимные превращения различных форм кислорода [70,71], что делает результаты малоинформативными. При пониженной температуре, когда таких превращений нет, идентификацию поверхностных форм кислорода обычно также не удается провести либо из-за их низкой активности, либо из-за малой концентрации. В случае же a-кислорода ситуация кажется уникальной - высокая активность и большая концентрация этой формы кислорода, которую можно регулировать (путем введения Fe) в пределах нескольких порядков. Это обстоятельство позволило нам простым и надежным способом ответить на вопрос об участии a-кислорода в реакции окисления бензола [66].
Сущность экспериментов заключалась в титровании a-кислорода бензолом, которое проводилось по схеме, включающей «посадку» кислорода на a-центр, его взаимодействие с бензолом при комнатной температуре и экстракцию продукта метанолом:
N2O + ()a  (O)a + N2
(O)a + N2
C6H6 + (O)a  (C6H5OH)a (43)
(C6H5OH)a (43)
(C6H5OH)a  C6H5OH + ()a
C6H5OH + ()a
Как показали исследования, в пределах точности эксперимента выход фенола близок к теоретическому. Других продуктов реакции не обнаружено. Полученные результаты, несомненно, говорят об участии a-кислорода в образовании фенола. Позднее этот вывод был подтвержден дополнительными экспериментами с использованием a-кислорода, обогащенного изотопом 18О.
7. Биомиметические свойства a -кислорода
Факт образования фенола при комнатной температуре в рассматриваемой реакции наводит на мысль о вероятном сходстве a-кислорода с активным кислородом монооксигеназ, для которых гидроксилирование ароматических соединений является типичной реакцией [72]. Напомним, что монооксигеназами называют ферменты, способные при комнатной температуре селективно вести окислительные реакции, в ходе которых один атом кислорода, переведенный в активное состояние, присоединяется к неактивированной молекуле углеводорода-субстрата, давая ОН-содержащее соединение, а второй - расходуется на образование воды. Активация кислорода является наиболее трудной проблемой биомиметической химии, особенно в случае моделирования так называемых метанмонооксигеназ. Биядерные Fe-содержащие центры метанмонооксигеназ способны генерировать кислородные частицы, которые по активности значительно превосходят кислород других монооксигеназ. Вследствие этого, помимо способности гидроксилировать ароматические и другие соединения, метанмонооксигеназы обладают уникальной возможностью гидроксилировать даже метан - наиболее инертную органическую молекулу.
Изучение реакции a-кислорода с метаном [66,73] с использованием той же трехстадийной схемы титрования, что и в вышеприведенном случае с бензолом («посадка» Oa, его взаимодействие с метаном при комнатной температуре и экстракция продукта) показало, что реакция протекает очень быстро, с образованием только метанола, количество которого соответствует количеству прореагировавшего метана.
Аналогичные результаты были получены для реакций с этаном, пропаном и рядом других углеводородов: окисление a-кислородом при комнатной температуре приводит к образованию тех же продуктов, что и при окислении с помощью монооксигеназ.
Для установления более глубокой аналогии a-кислородного окисления с биологическим окислением важно сравнить не только продукты, но и механизм, по которому они образуются в обоих случаях. Удобным инструментом для этой цели является измерение кинетического изотопного эффекта (КИЭФ). Известно, что биологическое окисление метана протекает с большим изотопным эффектом (от 5 до 12), тогда как в случае окисления бензола кинетический эффект не наблюдается [74]. Для сопоставления механизмов обсуждаемых процессов в работе [75] было проведено измерение КИЭФ для реакций окисления метана и бензола a-кислородом.
Молекулы метана CH2D2, которые использовались в работе [75] могут реагировать либо по C-H, либо по C-D связи, давая две изотопные разновидности метанола:
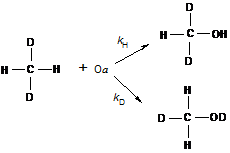 (44)
(44)
Экстрагированный с поверхности катализатора метанол был проанализирован методом ЯМР и на основании ЯМР-спектров рассчитаны величины изотопного эффекта. Оказалось, что в зависимости от температуры КИЭФ меняется от 5,5 при - 50 0С до 1,9 при +100 0С.
Высокие значения КИЭФ убедительно указывают на тот же механизм реакции, что и при окислении с помощью метанмонооксигеназ. В обоих случаях лимитирующая стадия реакции включает разрыв связи С-Н.
При взаимодействии a-кислорода с бензолом также образуются две изотопные разновидности фенола, содержащие ОН- и OD-группы. Результаты измерения КИЭФ и здесь показали сходство с биологическим процессом: как и в случае действия монооксигеназ, окисление бензола a-кислородом протекает без изотопного эффекта. Это значит, что лимитирующая стадия реакции не включает разрыв C-H связи и, вероятно, протекает через промежуточное образование ареноксида [75]:
 (45)
(45)
Таким образом, a-кислород во многих отношениях аналогичен активному кислороду метанмонооксигеназ: он координирован на комплексах Fe, обладает высокой реакционной способностью и направляет окисление по механизму того же типа.



 (40)
(40)

 и Fe.Al.Si
и Fe.Al.Si  при 350 °С
при 350 °С

 (O)a + N2
(O)a + N2 (C6H5OH)a (43)
(C6H5OH)a (43)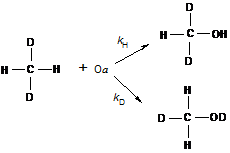 (44)
(44)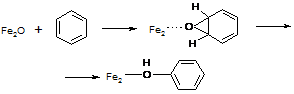 (45)
(45)

