

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...

История создания датчика движения: Первый прибор для обнаружения движения был изобретен немецким физиком Генрихом Герцем...

Общие условия выбора системы дренажа: Система дренажа выбирается в зависимости от характера защищаемого...
Топ:
История развития методов оптимизации: теорема Куна-Таккера, метод Лагранжа, роль выпуклости в оптимизации...
Установка замедленного коксования: Чем выше температура и ниже давление, тем место разрыва углеродной цепи всё больше смещается к её концу и значительно возрастает...
Методика измерений сопротивления растеканию тока анодного заземления: Анодный заземлитель (анод) – проводник, погруженный в электролитическую среду (грунт, раствор электролита) и подключенный к положительному...
Интересное:
Отражение на счетах бухгалтерского учета процесса приобретения: Процесс заготовления представляет систему экономических событий, включающих приобретение организацией у поставщиков сырья...
Принципы управления денежными потоками: одним из методов контроля за состоянием денежной наличности является...
Уполаживание и террасирование склонов: Если глубина оврага более 5 м необходимо устройство берм. Варианты использования оврагов для градостроительных целей...
Дисциплины:
|
из
5.00
|
Заказать работу |
|
|
|
|
Первое начало термодинамики для различных процессов
Как видно из определений (8.3)′ и (8.3)″, теплоемкость при постоянном объеме используется для описания изохорного процесса, а теплоемкость при постоянном давлении – изобарного.
Действительно, так как в изохорном процессе объем не меняется, то газ работы не совершает, и первое начало термодинамики для этого процесса будет иметь вид
| Q = U = νСV T. | (8.7) |
| Первое начало для изобарного процесса: | |
| Q = νСP T. | (8.8) |
В изотермическом процессе температура постоянна, поэтому внутренняя энергия не меняется, и первое начало термодинамики для этого процесса можно получить следующим образом:
| V | V2 | ||||
| Q = A = ∫2 | P(V)dV = νRT ln | , | (8.9) | ||
| V1 | |||||
| V1 |
где зависимость P (V) определяется из уравнения Менделеева – Клапейрона
(7.6): P = ν RT / V.
| Q = 0. | (8.10) |
Кроме этих трех процессов часто рассматривается адиабатический процесс, в котором газ не обменивается1 теплом с окружающей средой. Первое начало термодинамики для такого процесса очень простое
В координатах P-V график адиабатического процесса похож на изотерму, только идет более круто
| CP | PV γ = const, | (8.11) | |||
| где γ = | − показатель адиабаты. | ||||
| C | |||||
| V | |||||
| В адиабатическом процессе U A Отсюда сле- | |||||
| дует вывод, что при адиабатическом расширении (А > 0) | |||||
1 или не успевает обменяться
56
газ охлаждается (U < 0), а при адиабатическом сжатии (А < 0) – нагревается (U > 0). Это свойство используется в технике. Например, при резком сжатии воздух в цилиндрах дизельного двигателя сильно нагревается и воспламеняет топливо. В природе многие атмосферные процессы можно считать адиабатическими. Например, теплые воздушные массы, быстро поднимаясь вверх, адиабатически расширяются (так как с высотой падает давление). При этом они охлаждаются, и в них начинается конденсация водяных паров, которые мы видим как облака.
|
|
Конечно, все многообразие тепловых процессов, происходящих в природе, не исчерпывается четырьмя рассмотренными. Первое начало термодинами-
ки для любого квазистатического процесса с идеальным газом имеет вид
| V2 | |
| Q = νCV T + ∫P(V)dV, | (8.12) |
| V1 | |
| где первое слагаемое – изменение внутренней энергии | U, а второе – работа га- |
| за А. |
Вопросы к письменному ответу
1.Сформулируйте первое начало термодинамики и приведите иллюстрирующий его пример.
2.Что такое теплоемкость?
3.Почему прибрежный климат мягче континентального?
4.Почему перед весенними и летними ночными заморозками рекомендуется обильно полить растения?
5.Дайте характеристику адиабатического процесса.
6.Выведите первое начало термодинамики для основных процессов.
7.Почему при быстром подъеме воздушных масс происходит интенсивное образование облаков?
8.Почему в дизельном двигателе топливо воспламеняется без электрического разряда?
Задача №1. Применение первого закона термодинамики
Условие
Газ находился в цилиндре с поршнем площадью поперечного сечения 200 см^2. После того, как газ нагрели, сообщив ему количество теплоты в 1,5*10^5 Дж, поршень сдвинулся на расстояние h=30 см. Как изменилась внутренняя энергия газа, если его давление осталось равным 2*10^7 Па.
Решение
Запишем первое начало термодинамики:
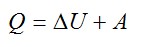
Работу против внешних сил, которую совершил газ, можно найти по формуле из механики:
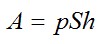
Отсюда:
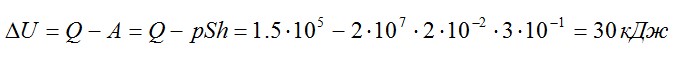
Ответ: 30 кДж.
Условие
Над газом была совершена работа 55 Дж, а его внутренняя энергия увеличилась на 15 Джоулей. Какое количество теплоты получил или отдал газ в этом процессе?
Решение
Записываем первое начало термодинамики и подставляем значения:
|
|
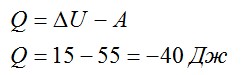
A пишется со знаком «минус», так как это работа внешних сил над газом, а не наоборот.
Ответ: в процессе газ отдал 40 Дж теплоты.
Условие
Кислород нагрели при постоянном давлении p=80 кПа. Объем газа увеличился с 1 до 3 кубических метров. Определить изменение внутренней энергии кислорода, работу, совершенную газом, и количество теплоты, сообщенное ему.
Решение
Работа газа
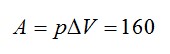
Изменение внутренней энергии равно:
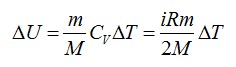
Используем уравнение состояния газа:
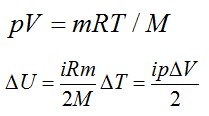
Число степеней свободы i для двухатомной молекулы равно 5.
Согласно первому закону термодинамики, сообщенное газу тепло равно:
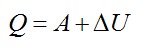
Найдем:
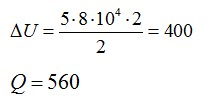
Ответ: А=160 кДж, ∆U=400 кДж, Q=560 кДж.
Задача №4. Изопроцессы
Условие
Газ находится в баллоне при температуре 400 К. До какой температуры нужно нагреть газ, чтобы его давление увеличилось в 1,5 раза?
Решение
Так как нагревание газа происходит при постоянном объеме, процесс – изохорный. При изохорном процессе:
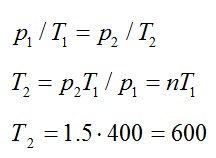
Ответ: 600 К.
Условие
Найти изменение ∆S энтропии при расширении массы m = 6 г гелия от объема V1 = 20 л под давлением р1 = 150 кПа к объему V2 = 60 л под давлением р2 = 100 кПа.
Решение
Изменение энтропии при переходе вещества из состояния 1 в состояние 2:
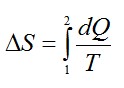
Согласно первому началу термодинамики:
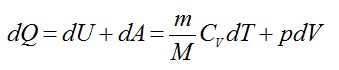
Из уравнения Менделеева-Клапейрона выразим давление:
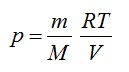
Тогда:
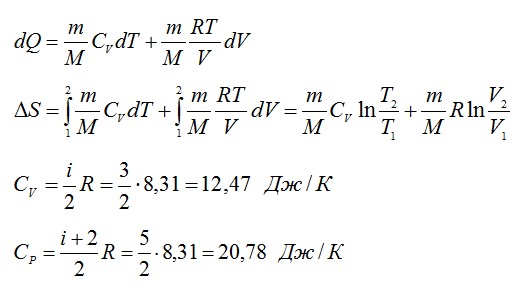
Из уравнения Менделеева-Клапейрона:
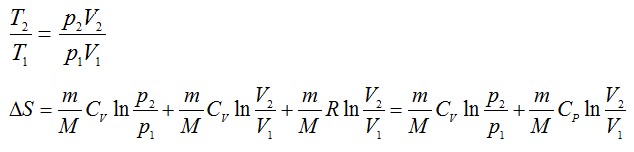
Подставим числа:
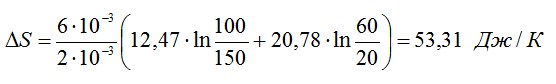
Ответ: ∆S=53,31 Дж/К.
Задачи для самостоятельного решения.
Задача 1. Во время расширения газа, вызванного его нагреванием, в цилиндре с площадью поперечного сечения S = 200 см2 газу было передано количество теплоты Q = 1,5 • 105 Дж, причём давление газа оставалось постоянным и равным р = 2 • 107 Па. На сколько изменилась внутренняя энергия газа, если поршень передвинулся на расстояние Δh = 30 см?
Задача 2. Газ расширяется от объёма V1 до объёма V2 один раз изотермически, другой изобарно и третий адиабатно. При каком процессе газ совершает большую работу и при каком газу передаётся большее количество теплоты?
Задача 3. Пусть азот нагревается при постоянном давлении. Зная, что масса азота m = 280 г, количество затраченной теплоты Q = 600 Дж и удельная теплоёмкость азота при постоянном объёме cv = 745 Дж/(кг • К), определите, на сколько повысилась температура азота. Молярная масса азота М = 0,028 кг/моль.
|
|
Задача 4. Газ находится в сосуде под давлением 2,5·104Па. При сообщении ему количества теплоты 6·104Дж он изобарно расширяется на 2м3. На сколько изменилась внутренняя энергия? Как изменилась его температура?
Задача 5. Какова внутренняя энергия гелия, заполняющего аэростат объёмом 50 м3 при давлении 80 кПа?
ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ. ЭНТРОПИЯ
Первое начало термодинамики утверждает, что при превращении одной формы энергии в другую полная энергия системы не изменяется, однако не указывает никаких ограничений относительно возможности этого процесса. Поэтому первое начало термодинамики позволяет рассчитать энергетический эффект процесса, однако не дает ответа на вопросы о том, будет ли процесс протекать самопроизвольно, о направлении и глубине протекания процесса.
Самопроизвольный процесс – процесс, который может протекать без затраты работы извне, причем в результате может быть получена работа в количестве, пропорциональном произошедшему изменению состояния системы. Самопроизвольный процесс может протекать или обратимо, или необратимо. Хотя определение обратимого процесса уже приводилось, следует подробнее рассмотреть это понятие. Чтобы самопроизвольный процесс протекал обратимо, необходимо приложить извне такое сопротивление, чтобы переход был очень медленным и при бесконечно малом изменении противодействующей силы процесс мог пойти в обратном направлении. В случае обратимо происходящего изменения состояния системы производится максимальное количество работы. Всякий реальный процесс в какой-то степени является необратимым, и получаемая работа меньше максимально возможного теоретического количества.
Вынужденный процесс – процесс, для протекания которого требуется затрата работы извне в количестве, пропорциональном производимому изменению состояния системы.
Второе начало термодинамики дает возможность определить, какой из процессов будет протекать самопроизвольно, какое количество работы может быть при этом получено, каков предел самопроизвольного течения процесса. Далее, второе начало термодинамики дает возможность определить, какими должны быть условия, чтобы нужный процесс протекал в необходимом направлении и в требуемой степени, что особенно важно для решения различных задач прикладного характера. Подобно первому, второе начало термодинамики выведено непосредственно из опыта. В то же время второе начало термодинамики имеет ограниченную область применения: оно применимо лишь к макроскопическим системам. Формулировки второго начала термодинамики:
|
|
Теплота не может самопроизвольно переходить от менее нагретого тела к более нагретому.
Невозможен процесс, единственным результатом которого является превращение теплоты в работу.
Невозможно построить машину, все действия которой сводились бы к производству работы за счет охлаждения теплового источника (вечный двигатель второго рода).
Рассмотрим работу тепловой машины, т.е. машины, производящей работу за счет теплоты, поглощаемой от какого-либо тела, называемого нагревателем. Нагреватель с температурой Т1 передает теплоту Q1 рабочему телу, например, идеальному газу, совершающему работу расширения А; чтобы вернуться в исходное состояние, рабочее тело должно передать телу, имеющему более низкую температуру Т2 (холодильнику), некоторое количество теплоты Q2, причем
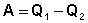 (I.34)
(I.34)
Отношение работы А, совершенной тепловой машиной, к количеству теплоты Q1, полученному от нагревателя, называется термодинамическим коэффициентом полезного действия (КПД) машины η:
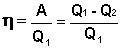 (I.35)
(I.35)
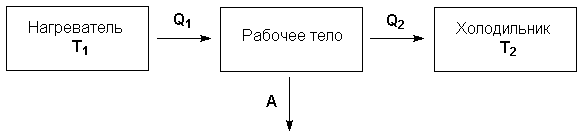
Рисунок 1.1 Схема тепловой машины
Для получения математического выражения второго начала термодинамики рассмотрим работу идеальной тепловой машины (машины, обратимо работающей без трения и потерь тепла; рабочее тело – идеальный газ). Работа машины основана на принципе обратимого циклического процесса – термодинамического цикла Карно (рис. 1.2).
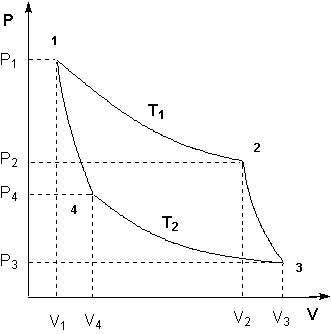
Рисунок 1.2 Цикл Карно
Запишем выражения для работы на всех участках цикла:
Участок 1 – 2: Изотермическое расширение.
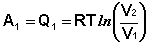 (I.36)
(I.36)
Участок 2 – 3: Адиабатическое расширение.
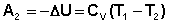 (I.37)
(I.37)
Участок 3 – 4: Изотермическое сжатие.
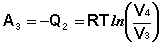 (I.38)
(I.38)
Участок 4 – 1: Адиабатическое сжатие.
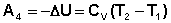 (I.39)
(I.39)
Общая работа в цикле равна сумме работ на всех участках:
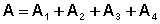 (I.40)
(I.40)
Проведя ряд несложных преобразований, получим для КПД идеальной тепловой машины, работающей по циклу Карно:
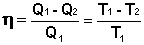 (I.41)
(I.41)
Т.о., максимальный КПД тепловой машины не зависит от природы рабочего тела, а определяется только разностью температур нагревателя и холодильника. Очевидно, что без перепада температур превращение теплоты в работу невозможно. Полученное выражение справедливо для тепловой машины, обратимо работающей по любому циклу, поскольку любой цикл можно разбить на множество бесконечно малых циклов Карно.
|
|
Для необратимо работающей тепловой машины уравнение (I.41) преобразуется в неравенство:
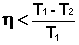 (I.42)
(I.42)
Для общего случая можем записать:
 (I.43)
(I.43)
На основе анализа работы идеальной тепловой машины Карно можно сделать следующий вывод, являющийся также одной из формулировок второго начала термодинамики:
Любая форма энергии может полностью перейти в теплоту, но теплота преобразуется в другие формы энергии лишь частично.
Т.о., можно условно принять, что внутренняя энергии системы состоит из двух составляющих: " свободной " X и " связанной " Y энергий, причем "свободная" энергия может быть переведена в работу, а "связанная" энергия может перейти только в теплоту.
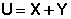 (I.44)
(I.44)
Величина связанной энергии тем больше, чем меньше разность температур, и при T = const тепловая машина не может производить работу. Мерой связанной энергии является новая термодинамическая функция состояния, называемая энтропией.
Введем определение энтропии, основываясь на цикле Карно. Преобразуем выражение (I.41) к следующему виду:
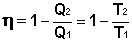 (I.45)
(I.45)
Отсюда получаем, что для обратимого цикла Карно отношение количества теплоты к температуре, при которой теплота передана системе (т.н. приведенная теплота) есть величина постоянная:
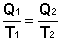 (I.46)
(I.46) 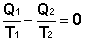 (I.47)
(I.47)
Это верно для любого обратимого циклического процесса, т.к. его можно представить в виде суммы элементарных циклов Карно, для каждого из которых
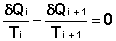 (I.48)
(I.48)
Т.о., алгебраическая сумма приведённых теплот для произвольного обратимого цикла равна нулю:
 (I.49)
(I.49)
Выражение (I.49) для любого цикла может быть заменено интегралом по замкнутому контуру:
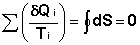 (I.50)
(I.50)
Если интеграл по замкнутому контуру равен нулю, то подынтегральное выражение есть полный дифференциал некоторой функции состояния; эта функция состояния есть энтропия S:
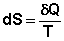 (I.51)
(I.51)
Выражение (I.51) является определением новой функции состояния – энтропии и математической записью второго начала термодинамики для обратимых процессов. Если система обратимо переходит из состояния 1 в состояние 2, изменение энтропии будет равно:
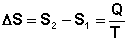 (I.52)
(I.52)
Подставляя (I.51, I.52) в выражения для первого начала термодинамики (I.1, I.2) получим совместное аналитическое выражение двух начал термодинамики для обратимых процессов:
 (I.53)
(I.53)
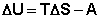 (I.54)
(I.54)
Для необратимых процессов можно записать неравенства:
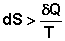 (I.55)
(I.55)
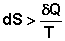 (I.56)
(I.56)
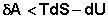 (I.57)
(I.57)
Т.о., как следует из (I.57), работа обратимого процесса всегда больше, чем того же процесса, проводимого необратимо. Если рассматривать изолированную систему (δQ = 0), то легко показать, что для обратимого процесса dS = 0, а для самопроизвольного необратимого процесса dS > 0.
В изолированных системах самопроизвольно могут протекать только процессы, сопровождающиеся увеличением энтропии.
Энтропия изолированной системы не может самопроизвольно убывать.
Оба этих вывода также являются формулировками второго начала термодинамики.
Первое начало термодинамики. Теплоемкость
Первое начало термодинамики: количество теплоты Q, сообщенное системе, идет на увеличение внутренней энергии системы U и на совершение системой внешней работы А:
| Q = U + A. | (8.1) |
Например, если газу под поршнем сообщить некоторое количество теплоты, он нагреется (увеличится внутренняя энергия газа) и переместит поршень (газ совершит работу). Внутренняя энергия есть функция температуры. Чем выше температура тела, тем быстрее движутся его молекулы, а, значит, больше внутренняя энергия тела. Если система получает тепло, Q > 0, если отдает, Q < 0; если работает система, A > 0, если работа над системой, A < 0.
Первое начало термодинамики, по существу, является законом сохранения энергии: полная энергия, переданная системе Q, превращается в тепловую энергию молекул системы U и в механическую энергию А. Он справедлив не только для газов, но и для жидкостей, и для твердых тел.
Если процесс медленный (равновесный), этот закон можно записать в ви-
| де бесконечно малых приращений величин (в дифференциальном виде)1: | |
| δQ = dU + δA. | (8.1)′ |
Пусть газ, находящийся под давлением Р медленно сдвинул поршень площади S на бесконечно малое расстояние dx. Тогда совершенная газом элементарная (бесконечно малая) работа
δA = Fdx = PSdx = PdV.
Полная работа газа при изменении объема от V 1 до V 2 получается интегрированием (суммированием бесконечно малых работ):
| V2 | |
| A = ∫P(V)dV. | (8.2) |
V1
Для характеристики процессов теплообмена введем понятия молярная и удельная теплоемкость вещества (не обязательно газа).
1 Внутренняя энергия – это функция состояния системы, для идеального газа зависящая только от температуры. Для равновесных процессов функция U (T) дифференцируемая и для нее определен дифференциал dU = U ′(T) dT, где U ′(T) – производная функции U (T) по температуре. Напротив, количество теплоты и работа не являются функциями состояния системы: нельзя сказать, что у системы такая-то теплота или такая-то работа. Для них дифференциал не определен. Поэтому бесконечно малые приращения этих величин обозначеныпо-другому.
5
Молярная теплоемкость – это отношение бесконечно малого количества теплоты, полученного молем вещества, к соответствующему приращению его температуры:
| C = | 1 | δQ | (8.3) | |
| ν | . | |||
| dT | ||||
Удельная теплоемкость – это отношение бесконечно малого количества теплоты, полученного килограммом вещества, к соответствующему прираще-
| нию его температуры: | 1 | δ Q | ||
| c = | ||||
|
| . | (8.4) | ||
| m dT | ||||
Эти теплоемкости связаны между собой простым соотношением С = μ с и измеряются соответственно в Дж/(моль·К) и в Дж/(кг·К).
Чем больше теплоемкость, тем медленнее вещество нагревается и медленнее остывает. Например, в холодную погоду водоемы охлаждаются медленнее окружающего воздуха и вблизи них теплее (в холодную погоду водоплавающие птицы сидят на воде). А в жару, наоборот, вода нагревается медленнее окружающего воздуха, и вблизи водоемов прохладнее. Это обусловлено тем, что теплоемкость воды гораздо больше теплоемкости воздуха.
Для газов, как правило, пользуются молярной теплоемкостью, а для жидкостей и твердых тел – удельной1. Например, из формулы (8.4) легко получить школьную формулу для количества тепла, которое нужно сообщить телу массы m, чтобы нагреть его от температуры t 1 до температуры t 2
δQ = mcdT.
Считая, что масса в процессе не меняется, а теплоемкость не зависит от температуры, получим
T2
Q = ∫δQ = mc∫dT = mc(T2 −T1) = mc T.
T1
ТаккакразницатемпературвкельвинахиградусахЦельсияодинакова, то
| Q = mc(t2 – t1). | (8.5) |
Аналогично из формулы (8.3) можно получить похожее выражение для теплоты через молярную теплоемкость и количество вещества. В термодинамике особо рассматриваются следующие молярные теплоемкости: молярная теплоемкость при постоянном объеме
| C | = | 1 | δQ | = | 1 | dU | (8.3)′ | |||
| ν | ν | |||||||||
| V | dT | V | dT | V | ||||||
и молярная теплоемкость при постоянном давлении
1 Значения теплоемкостей обычно определяют экспериментально и приводят в справочных таблицах. Для идеального газа теплоемкости можно сравнительно легко рассчитать из классических молекулярно-кинетических принципов. Теоретический расчет теплоемкостей жидкостей и твердых тел довольно сложен, так как опирается на принципы квантовой физики.
| CP = | 1 | δQ | (8.3)″ | |
| ν | . | |||
| dT P | ||||
Для идеального газа эти теплоемкости связаны между собой уравнением
СР = CV + R. (8.6)
Для идеального газа в диапазоне средних температур (100-1000 К) теплоемкость CV рассчитывается из молекулярно-кинетических принципов, см. приложение к главе II. Не вдаваясь в детали расчета, отметим, что для одноатомно-
го газа CV = 32 R, для двухатомного CV = 52 R, для трех- и более CV = 3 R. Для термодинамических расчетов воздух обычно считают двухатомным газом.
|
|
|

Кормораздатчик мобильный электрифицированный: схема и процесс работы устройства...

Типы сооружений для обработки осадков: Септиками называются сооружения, в которых одновременно происходят осветление сточной жидкости...

Эмиссия газов от очистных сооружений канализации: В последние годы внимание мирового сообщества сосредоточено на экологических проблемах...

Типы оградительных сооружений в морском порту: По расположению оградительных сооружений в плане различают волноломы, обе оконечности...
© cyberpedia.su 2017-2024 - Не является автором материалов. Исключительное право сохранено за автором текста.
Если вы не хотите, чтобы данный материал был у нас на сайте, перейдите по ссылке: Нарушение авторских прав. Мы поможем в написании вашей работы!