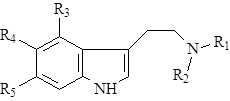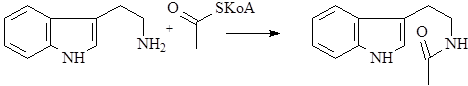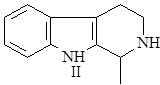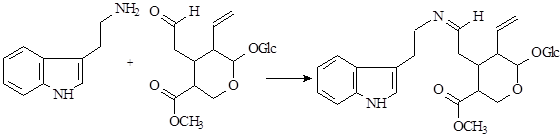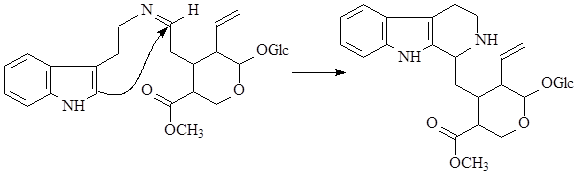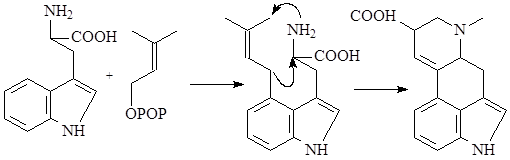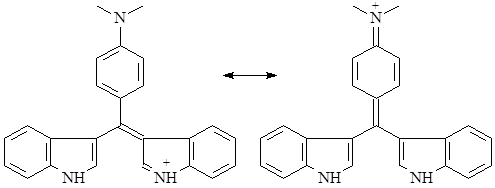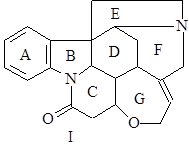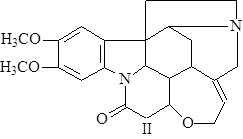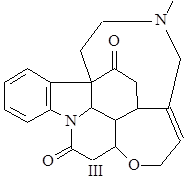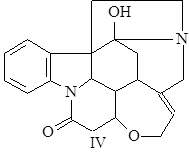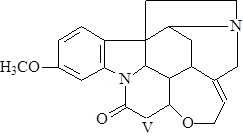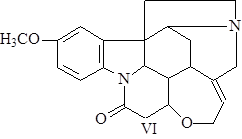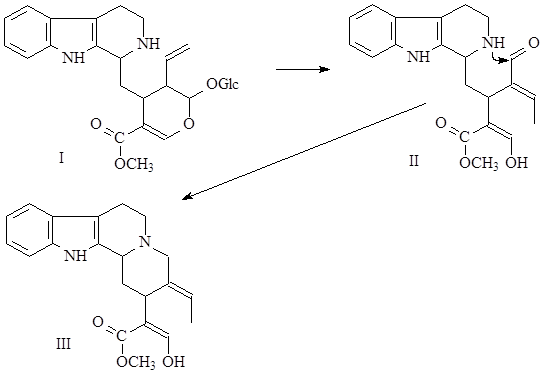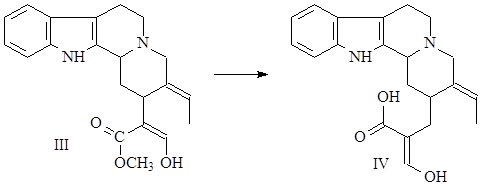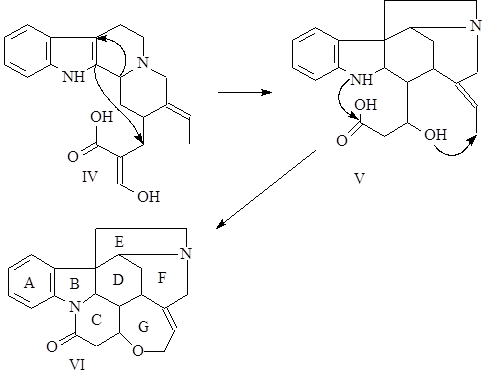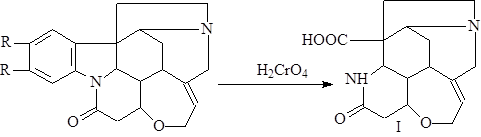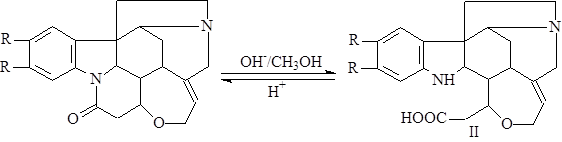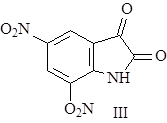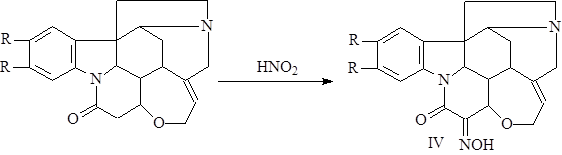Шутов Роман Вадимович
3 курс, 397 группа
Алкалоиды – производные индола
Курсовая работа
Руководитель: Шеховцова Елена Григорьевна
Санкт-Петербург
2002
Оглавление
| Введение…………………………………………………………………………………..
1. Общая характеристика алкалоидов – производных индола…………….………….
1.1 Определение и классификация………..…………………………….………….
1.2 Распространение в природе…………………………………………….………
1.3 Накопление в растениях……………….…………….…………………….……
1.4 Общие пути биосинтеза………………………………………………………...
1.5 Качественный анализ……………………………………….……….….……….
1.6 Количественный анализ………………….………………….……….….….…..
1.7 Основные направления медицинского применения……………….………….
2. Лекарственные растения и сырье, содержащие алкалоиды – производные индола…………………………….………………..
2.1. Род Чилибуха – Strychnos sp……………….………………………..………….
2.1.1. Таксономия и внешнее описание…………………………………….
2.1.2. Географическое распространение и местообитание………………..
2.1.3. Определение сырья……………………………………………………
2.1.4. Заготовка……………………………………………………………….
2.1.5. Внешний вид сырья………………………………………………..….
2.1.6. Микроскопический анализ сырья………………………….…………
2.1.7. Химический состав……………………………………………………
2.1.8. Биосинтез стрихнина…………………………………………….……
2.1.9. Доказательство строения стрихнина………………………..………..
2.1.10. Качественный анализ………………………………………………….
2.1.11. Количественный анализ…………………………………………..…..
2.1.12. Числовые показатели………………………………………………….
2.1.13. Хранение…………………………………………………………….…
2.1.14. Фармакологические свойства и медицинское применение………...
2.1.15. Другие представители рода Strychnos……………………….….…...
Заключение…………………………………………………………………………….…
Список использованной литературы……………………………………….…………...
| 3
4
4
6
6
7
9
10
11
13
13
13
13
13
13
13
15
15
17
18
20
21
22
22
22
23
25
26
|
Введение
Лекарственные растения применялись для лечения различных болезней задолго до того, как были открыты их действующие вещества, а тем более, до того как были синтезированы новые препараты и фактически они и были первыми средствами для лечения различного рода недугов. Вместе с тем своей актуальности фитотерапия не потеряла до сих пор. В современной научной медицине используется свыше 250 растений, обладающих тем или иным терапевтическим действием, которое определяется входящими в их состав биологически активными веществами. Несмотря на то, что термин «действующие вещества», считается несколько устаревшим, т.к. действие растительных препаратов – комплексное и определяется суммой веществ, все-таки есть ряд групп веществ, для которых действие чистого вещества и эффект фитопрепарата, содержащего это вещество в достаточной степени сходны. Наиболее известной группой таких веществ являются алкалоиды, действие которых часто проявляется в минимальных количествах.
Самой многочисленной группой алкалоидов являются производные индола, весьма разнообразные по химическому строению, распространению и фармакологическому действию. Многие из них наглядно демонстрируют верность утверждения, приписываемого основателю йатрохимии Парацельсу: «Одно и то же вещество одновременно может являться и лекарством, и ядом, все дело только в дозе». Этот принцип в полной мере применялся как в средние века, при решении вопросов престолонаследия, так и в современной медицине, где лекарственные препараты на основе этих алкалоидов зачастую спасают человеческие жизни.
Ряд алкалоидов имеет важное социально-уголовное значение, являясь психотропными веществами, вызывающими болезненное пристрастие – наркоманию, хотя они и уступают в этом отношении изохинолиновым опийным алкалоидам.
Знать все эти нюансы обращения с ядовитыми, сильнодействующими, наркотическими и психотропными веществами – одна из первейших задач любого медицинского работника, обязанного свято соблюдать главный принцип Гиппократа: «Не навреди!».
Многих современных ученых волнует проблема изучения этой тонкой грани между терапевтическим и токсическим действием веществ, применительно к веществам растительного происхождения, содержащих в своем составе определенную химическую структуру, а именно индольное ядро, а также выяснение связи между химическим строением вещества и его фармакологическим действием.
Кроме того, интерес представляет также биогенез этих зачастую довольно сложных соединений, структура, а тем более метаболизм в растении которых нередко остается невыясненным даже после нескольких десятилетий усиленного научного поиска.
В данной работе сделана попытка осветить общие вопросы классификации и биогенеза индольных алкалоидов, их фитохимический анализ и краткая фармакологическая характеристика. Во второй части более детально рассмотрена конкретная группа индольных алкалоидов, вместе с растениями – источниками этих алкалоидов, также с более подробным изучением проблемы их медицинского применения.
1. Общая характеристика алкалоидов – производных индола.
Распространение в природе.
Будучи самой многочисленной группой алкалоидов, индольные алкалоиды широко распространены в растительном мире. Известно около 40 семейств, в которые входят виды, продуцирующие эти алкалоиды, однако в отдельных семействах, как правило, встречается всего 1-2 вида, в которых обнаруживаются эти алкалоиды. Исключением являются тропические растения порядка горечавковые – Gentianales: кутровые – Apocynaceae, насчитывающие 73 продуцирующих вида, логаниевые – Loganiaceae – 40 видов, мареновые – Rubiaceae – 72 вида, мальпигиевые – Malpighiaceae. У видов этих семейств обнаружены в основном монотерпеноидные алкалоиды, у которых к индольному кольцу присоединены различные 4-, 5-, 6-членные углеродные циклы (3).
Довольно богато индольными алкалоидами и семейство бобовых, в котором свыше 60 видов содержат алкалоиды этой группы, но в данном случае они, в основном, простые по строению (4).
Есть малочисленные семейства, в которых, тем не менее, велика доля алкалоидоносных видов. Таково, например, семейство страстоцветные – Passifloraceae.
Встречаются индольные алкалоиды и в грибах, например в спорынье – Claviceps purpurea (Fries) Tulasne. из класса сумчатых грибов – Ascomycetes (5).
Есть данные о наличии индольных алкалоидов животного происхождения, в частности, в слизи, выделяемой тропическими лягушками, обнаружены вещества курареподобного действия (6).
Накопление в растениях.
В начале вегетации до появления листьев алкалоиды из корней, семян и коры переходят в ростки. В подземных органах число и сумма алкалоидов уменьшаются, в коре их число остается прежним, но сумма также уменьшается. Качественные и количественные изменения алкалоидного состава продолжаются в течение всего периода вегетации. К концу вегетации в растениях накапливается максимальное количество смеси оснований. Далее их количество начинает уменьшаться, алкалоиды накапливаются в зимующей части растения для перехода в следующее поколение – в семена, в подземную часть, у древесных пород – в кору. В естественно отмерших частях растения алкалоидов практически не остается. Вместе с тем не исключено, что алкалоиды в этих органах могут разрушаться самостоятельно, на фоне накопления их в зимующих органах (7).
Подвижность алкалоидов в растениях вызывается не только онтогенетическими факторами, но также географическим положением и влиянием факторов окружающей среды (5).
Большинство растений–источников индольных алкалоидов – тропические растения, деревья или кустарники, ареал которых расположен главным образом в юго-восточной части Азии, Северной Австралии и Океании. Эти растения содержат достаточно сложные по своей структуре полициклические алкалоиды. При продвижении на север общее количество алкалоидов снижается, а их структура несколько упрощается и представлена в основном b-карболиновыми алкалоидами. Это связано со снижением скорости обмена и интенсивности включения терпеноидных структур в молекулу алкалоида (3),(8).
Общие пути биосинтеза.
Все индольные алкалоиды в биогенетически являются производными аминокислоты триптофана (8). Сама аминокислота не является незаменимой для растений и синтезируется из хоризмовой кислоты – метаболита шикиматного пути биосинтеза ароматических аминокислот (5).
Дальнейшие превращения триптофана могут идти по нескольким путям. В большинстве случаев первой реакцией является его декарбоксилирование с образованием биогенного амина – триптамина (1):
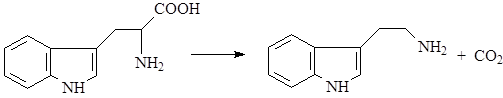
Далее возможно несколько вариантов превращений: триптамин может алкилироваться по аминогруппе и гидроксилироваться в бензольное кольцо, в результате чего образуется группа простейших индольных алкалоидов – индолалкиламины (8):
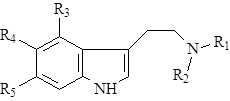
Группировки R1 и R2 почти всегда представлены метильными или этильными радикалами, R3, R4 и R5 – гидрокси- или метоксигруппами.
Триптамин может циклизоваться с образованием структуры физостигмина (8):

Образование иной циклической структуры из триптамина возможно после его предварительного ацилирования с помощью активированного ацетила – ацетил KoA.
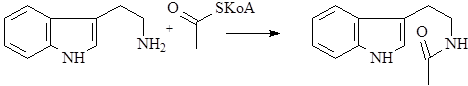
После циклизации образуется гармалин – родоначальник обширной группы b-карболиновых алкалоидов.

Далее он может окисляться в гарман (I) или восстанавливаться в тетрагидрогарман (II), а также образовывать более сложные структуры при соединении с другими соединениями, например бревиколлин (III), образующийся в осоке парвской – Carex brevicollis D.C., структура которого включает кроме гармана еще и пирролидиновое ядро (6),(9).

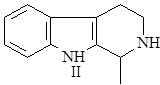

Наиболее интересен биосинтез терпеноидных алкалоидов. Он заключается в конденсации триптамина с циклическим иридоидным альдегидом – секологанином:
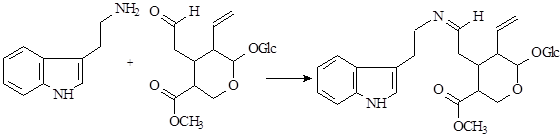
На первой стадии образуется шиффово основание, которое по механизму реакции Манниха – Шпенглера циклизуется с образованием стриктозидина (винкозида) - родоначальника всех монотерпеноидных индольных алкалоидов (10):
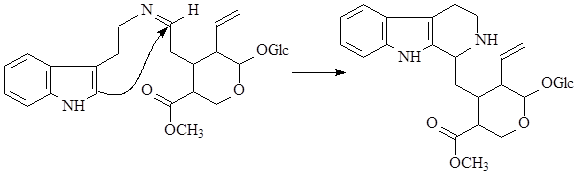
Особое место в биосинтезе индольных алкалоидов занимает биосинтез эрголиновых алкалоидов. В первую очередь он отличается от всех остальных путей тем, что в метаболизм включается непосредственно аминокислота триптофан, а не триптамин. Вначале, в результате взаимодействия триптофана и структурной единицы терпенов - диметилаллилпирофософата образуется 4-диметилаллилтриптофан, который в дальнейшем претерпевает последовательное замыкание двух связей и декарбоксилирование. После окисления боковой метильной группы образуется лизергиновая кислота, которая, соединяясь с рядом аминокислот, образует уникальную группу пептидных алкалоидов, встречающихся только в склероциях спорыньи – Claviceps purpurea (Fries) Tulasne (11):
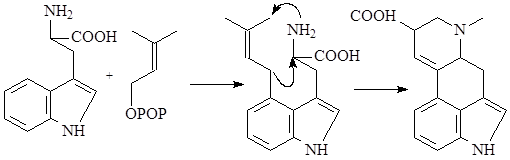
Относительно роли индольных алкалоидов в растении есть предположение, что их образование оберегает растения от избыточного накопления гетероауксина – фитогормона, стимулятора роста растений, т.е. алкалоиды выполняют регуляторную функцию (3).
Регуляция биосинтеза и метаболизма алкалоидов происходит либо по аминокислотному пути, либо через белковый (энзиматический) путь.
О взаимосвязи между биосинтезом алкалоидов и пулом свободных аминокислот свидетельствуют данные об увеличении содержания алкалоидов в 2 раза при добавлении в среду ткани катарантуса розового – Catharanthus roseus (L.) G.Don больших количеств триптофана. В опытах с некоторыми штаммами введение экзогенного триптофана позволило достичь трехкратного увеличения содержания серпентина и аймалицина.
Увеличение пула свободных аминокислот наблюдается при ингибировании синтеза белка различными веществами.
Что касается активации биосинтеза, то получен целый ряд данных, свидетельствующих о том, что участие аминокислот в образовании алкалоидов не ограничивается только ролью предшественников, субстрата для биосинтеза. Напротив имеются указания на то, что аминокислоты являются индукторами ферментов биосинтеза алкалоидов и, следовательно, выполняют определенную регуляторную функцию в их биосинтезе. Однако при высоких концентрациях триптофана наблюдается снижение образования алкалоидов, без нарушения роста и развития растений, что исключает токсическое влияние триптофана на растение и позволяет сделать вывод о репрессии ферментов, ответственных за синтез этих алкалоидов.
Регуляция образования алкалоидов осуществляется также путем аллостерического ингибирования ключевых ферментов их биосинтеза конечными продуктами реакций. Так, в опытах с культурой ткани барвинка розового было показано снижение активности в среднем на 50% цитохром Р-450-зависимой монооксигеназы такими алкалоидами как катарантин, винбластин и виндолин, т.е. конечными продуктами биосинтеза. Дополнительное изучение кинетики выявило, что этот процесс является неконкурентным и линейным, т.е. аллостерическим (8).
Качественный анализ.
Все индольные алкалоиды дают осадочные реакции с общеалкалоидными реактивами, такими как реактив Майера, реактив Марме, 1% растворы фосфорномолибденовой, фосфорновольфрамовой, кремневольфрамовой кислот и др. (2).
Еще более быстрый и простой метод качественного анализа основан на способности ряда алкалоидов флуоресцировать в ультрафиолетовом свете. Это свойство больше характерно для производных гармана. Для того чтобы обнаружить алкалоиды, достаточно нанести на фильтровальную бумагу каплю водной вытяжки или сока растения. Пятно светится при ультрафиолетовом облучении. Этот способ можно использовать как экспресс-метод, так как в этом случае выявить алкалоиды можно в течение нескольких секунд, что важно при массовых анализах в период заготовительных работ, когда необходимо отличать производящее растение от примесей (9).
Для идентификации индольных алкалоидов часто используют 1% раствор пикриновой кислоты, дающей с алкалоидами стехиометрические кристаллические осадки, которые отфильтровывают, сушат и определяют температуру плавления (12).
В качестве достаточно высокоспецифичной реакции на различные группы индольных алкалоидов используют т.н. тест Эрлиха – реакцию виннокислой соли алкалоида с раствором п-диметиламинобензальдегидом в 65% серной кислоте. После воздействия света ртутной лампы или в присутствии следов хлорного железа развивается интенсивное окрашивание, варьирующее в зависимости от типа алкалоида от пурпурного до ярко-синего. Причиной окрашивания является образование хиноидного соединения типа розиндола, существующего в двух таутомерных формах:
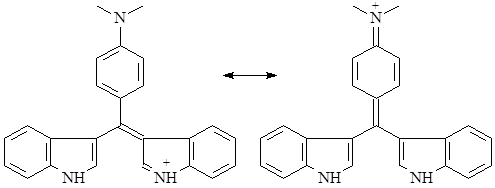
Реакция протекает быстро для алкалоидов со свободным С3-положением и не имеющих электронодонорных групп в ядре, медленнее – для С3-замещенных алкалоидов, но не содержащих свободных аминов в этом заместителе и электронодонорных групп в ядре. Реакция не идет в случае с алкалоидами, имеющими аминосодержащий заместитель в 3 положении и электронодонорные группы в ядре. В качестве заменителя п-диметиламинобензальдегида можно использовать ванилин в концентрированной серной кислоте, при этом развивается красное окрашивание. По реакции Гопкинса-Коуля с глиоксиловой кислотой в концентрированной серной кислоте кислотой развивается сине-фиолетовое окрашивание (13).
Однако наиболее тонким и селективным методом анализа является бумажная или тонкослойная хроматография. Наиболее часто применяется система бутанол-уксусная кислота-вода в различных соотношениях. Хроматограммы проявляют реактивом Драгендорфа, дающего с алкалоидами оранжевые пятна, и сравнивают коэффициенты подвижности (Rf) опытных образцов и веществ-свидетелей (9).
Количественный анализ.
Самым старым способом определения количественного содержания не только индольных, но и алкалоидов вообще, был весовой анализ по Келлеру. Алкалоиды из сырья экстрагируют эфиром в виде основания, затем их извлекают из эфирного экстракта 1%-ным раствором соляной кислоты. После подщелачивания последней, основания алкалоидов вновь извлекают эфиром, эфир упаривают, и остаток взвешивают.
Наиболее простым методом является прямая или, чаще, обратная ацидиметрия. В качестве титранта используется 0,1н. раствор NaOH, которым оттитровывается избыток предварительно добавленной серной или соляной кислоты, в присутствии индикатора – метилового оранжевого или фенолфталеина (12).
Широко используется метод фотоколориметрии, основанный на цветных реакциях индольных алкалоидов. В качестве основного реактива используется, в основном, реактив ван-Урка, так как во всех остальных случаях интенсивность развивающейся окраски не пропорциональна содержанию алкалоидов в сырье (13).
Применяется потенциометрическое титрование в неводных растворителях, что является довольно точным методом и позволяет раздельно определять содержание алкалоидов в смеси (9).
Определение сырья.
В качестве лекарственного сырья используют импортное сырье – семена чилибухи, или рвотный орех: собранные в фазу плодоношения и высушенные семена дикорастущего дерева чилибухи Strychnos nux-vomica L., сем. Логаниевые – Loganiaceae (15).
Заготовка.
Собирают в октябре-ноябре зрелые плоды, рассекают их и выбирают семена, отбрасывая недоразвитые и загнившие. Сушат на воздухе или в печи при температуре 50-60°С. Влажность сырья после сушки должна быть не более 10% (6).
Внешний вид сырья.
Семена круглые плоские, с одной стороны – немного выпуклые, с другой – вогнутые или плоские, иногда немного согнутые. В центре выпуклой стороны – рубчик в виде маленького бугорка, от которого в радиальном направлении тянется валик, образованный схождением кончиков волосков и оканчивающийся на краю семени
сосочком – семявходом. Семя – 1,5-2,5 см в поперечнике, 3-6 мм в толщину, очень твердое, может быть только распилено или разбито молотком. После размачивания в горячей воде семя становится мягким, упругим и легко режется. Под кожурой – беловато-серый роговидный твердый эндосперм, в полости которого имеющей вид широкой щели лежит светлый, часто зеленоватый, довольно крупный – до 7 мм длины зародыш. Его корешок доходит до сосочка у края семени, а 2 тонкие широкосердцевидные семядоли лежат одна над другой. Цвет семени серый, зеленовато- или буровато-серый. Снаружи семена шелковисто-блестящие, вследствие многочисленных тесно прилегающих к поверхности семени волосков. Запах отсутствует. Вкус не определяется (6),(15),(18).
Химический состав.
Семена содержат 2-3% алкалоидов, из которых приблизительно 47% приходится на долю стрихнина, и столько же – на долю его диметоксипроизводного – бруцина. В небольших количествах содержатся родственные им вомицин, псевдострихнин, псевдобруцин, a-колубрин, b-колубрин, струксин, которые в сумме составляют не более 0,1%. Из не алкалоидных веществ встречаются хлорогеновая кислота, гликозид логанин, тритерпеноидное соединение циклоарсенол, стигмастерин.
Из листьев выделен алкалоид стрихницин (18).
Стрихнин (I) открыт в 1818 г. Кристаллизуется из этилового спирта в виде бесцветных четырехгранных призм. Трудно растворим в воде, эфире, легче – в бензоле, спирте; t°пл= 286-288°С; [a]D = –104° (в абсолютном спирте), и –139,3° (в хлороформе). Дает много хорошо кристаллизующихся солей, что позволяет использовать его в качестве оптически активного основания для разделения рацематов (1),(2).
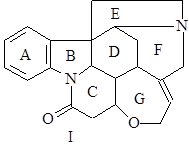
Бруцин (II) открыт в 1818 г. Кристаллизуется из разбавленного этилового спирта в виде моноклинных призм, представляющих собой тетрагидрат. Трудно растворим в горячей воде, легко – в спирте, хлороформе, почти не растворим в эфире; тетрагидратная форма плавится при t° = 105°С, безводный алкалоид – при 178°С; [a]D = +119-127° (в хлороформе). Дает много кристаллических солей с азотной кислотой (2).
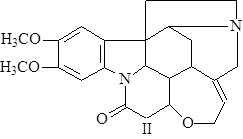
Вомицин (III) впервые выделил Гмелин в 1929 г. из маточников, оставшихся после выделения стрихнина; t°пл= 282°С; [a]D = +80,4° (этанол) (1).
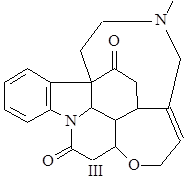
Псевдострихнин (IV) обнаружен Варнатом в 1931 г. t°пл= 266-268°С; [a]D = –58° (этанол), и –85,9° (хлороформ) (1).
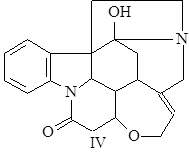
a-колубрин (V) открыл Варнат в 1931 г. t°пл= 184°С; [a]D = –76,5° (80% этанол) (1),(2).
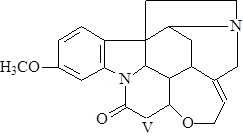
b-колубрин (VI) открыл Варнат в 1931 г. t°пл= 222°С; [a]D = –107,7° (80% этанол) (1),(2).
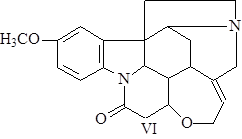
Биосинтез стрихнина.
Стрихнин является монотерпеноидным индольным алкалоидом, и синтезируется из их общего предшественника – стриктозидина (винкозида) (I) (10).
В биосинтезе стрихнина можно выделить несколько стадий:
На первой стадии происходит разрыв пиранового кольца (II), с отщеплением глюкозы, и последующим образованием центрального метаболита целого ряда алкалоидов – гизосхизина (III) (19).
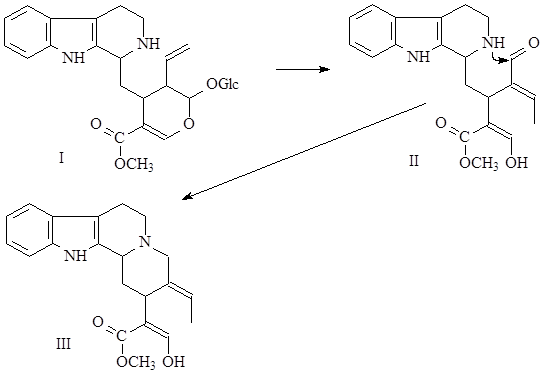
На следующей стадии гизосхизин претерпевает метилирование с увеличением боковой цепи на один углеродный атом и образованием соединения, состоящего из 21 атома углерода (IV) (20).
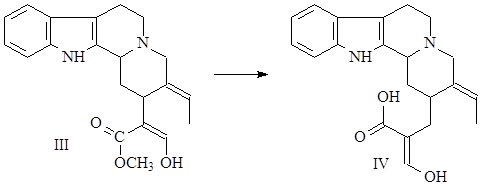
Таким образом, осуществляется переход от С20-соединений к С21-соединениям – предшественникам группы стрихнина.
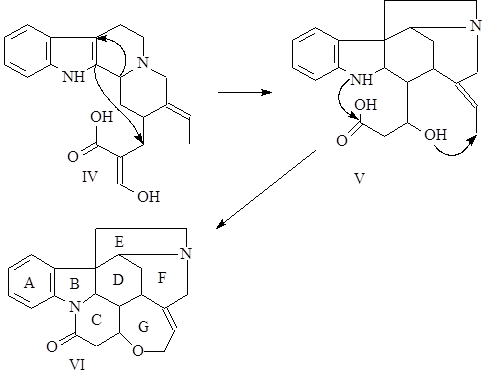
Затем происходит многоступенчатая перегруппировка по типу преакуаммицина, в результате которой получается С21-аналог преакуаммицина (V), и далее, после замыкания лактамного (С) и оксепинового (G) циклов образуется стрихнин (VI) (21),(22).
2.1.9. Доказательство строения стрихнина.
Уже в самом начале изучения строения стрихнина и бруцина была отмечена близость свойств этих оснований, которая в ряде случаев доходила до полной идентичности. Это навело исследователей на мысль, что бруцин является диметоксипроизводным стрихнина. Это предположение было подтверждено окислением хромовой кислотой в определенных условиях, при котором получался один и тот же продукт – т.н. кислота Ханссена (I) – продукт разрушения ароматического кольца алкалоидов (1).
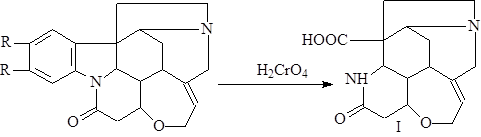
При нагревании алкалоидов со спиртовой щелочью происходит присоединение воды и образование стрихниновой и бруциновой кислоты (II), которые при действии кислот легко переходят обратно в стрихнин и бруцин. Это указывает на наличие в молекуле лактамной группировки, разрушающейся в щелочном растворе (1).
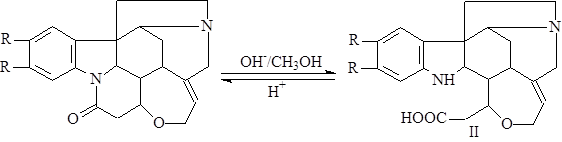
Было проведено множество экспериментов по окислению стрихнина различными окислителями. Наиболее важно окисление азотной кислотой, при котором происходит образование динитрострихнона. Долгое время его считали производным хинолина или изохинолина, но при дальнейшем окислении вещества был получен динитроизатин (III), что доказывало наличие индольного ядра в молекуле (2).
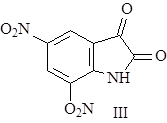
Далее, было доказано, что один из кислородных атомов имеет карбонильный характер, связан с азотом, индифферентен, и в то же время нейтрализует связанный с ним атом азота. Второй атом кислорода также индифферентен (2).
Стрихнин и бруцин дают бензилиденовые производные, реагируют с азотистой кислотой, давая изонитрозопроизводные (IV). Эти реакции доказывают наличие реакционноспособной метиленовой группы (1).
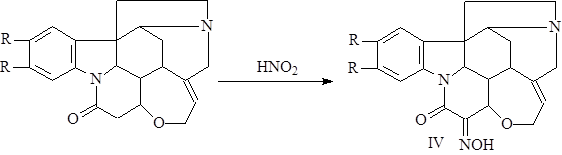
Алкалоиды содержат одну двойную связь, которая легко гидрируется с образованием дигидрострихнина и дигидробруцина. При более энергичном восстановлении были получены тетрагидрострихнин, стрихнидин, дезоксистрихнин, дигидрострихнолин (1).
Исследования формулы стрихнина продолжались более ста лет со времени его открытия, и только в 1950 г. была предложена структурная формула, которая объясняла все его превращения. Эта структура была подтверждена в 1954 г. Вудвордом (США) с помощью синтеза (1).
Качественный анализ.
Фармакопейный качественный химический анализ сырья чилибухи заключается в открытии стрихнина и бруцина.
Хлороформное извлечение порошка семян фильтруют через фильтр с безводным сульфатом натрия, делят на 2 части и упаривают на водяной бане досуха. К одной части сухого остатка прибавляют раствор бихромата калия и осторожно по стенкам чашки – концентрированную серную кислоту. При покачивании чашки появляются красно-фиолетовое окрашивание – стрихнин. К другой части сухого остатка прибавляют концентрированную азотную кислоту, появляется оранжево-красное окрашивание – бруцин. Также можно проводить анализ на срезах семян чилибухи: при смачивании обезжиренного среза каплей концентрированной серной кислоты со следами ванадата аммония содержимое клеток тотчас же окрашивается в фиолетовый цвет. При смачивании среза каплей дымящей азотной кислоты, содержимое клеток окрашивается в оранжево-желтый цвет (15).
Нефармакопейные реакции на стрихнин.
С нитритом натрия и серной кислотой стрихнин дает грязно-желтое окрашивание, которое после добавления спиртового раствора едкого кали переходит в оранжево-красное; при добавлении же водного раствора едкого кали сначала появляется коричневато-зеленая окраска, переходящая в красно-коричневую.
В концентрированной азотной кислоте стрихнин дает желтый раствор, остаток после выпаривания при прибавлении аммиака окрашивается в оранжево-желтый цвет, такая же окраска получается и от прибавления водного или спиртового раствора едкого кали. Водный раствор вызывает оранжевую окраску, которая изменяется потом в желтую, зеленую, красноватую и, наконец, исчезает (12).
Стрихнин в чистых препаратах дает характерные кристаллические осадки со многими реагентами. Наиболее пригодными для микрохимического открытия стрихнина являются: 1) пикриновая кислота, 2) реактив Майера, 3) бихромат калия, 4) железосинеродистый калий, 5) реактив Беттендорфа, 6) пикролоновая кислота, 7) четыреххлористый свинец и некоторые другие реактивы (2).
С 1%-ным раствором пикриновой кислоты раствор азотнокислого стрихнина, подкисленный уксусной кислотой, дает мелкокристаллический осадок в виде круглых зернышек, которые после недолгого стояния срастаются в перьевидные агрегаты. Эта реакция очень чувствительна.
При смешении на предметном стекле 0,1%-ного раствора азотнокислого стрихнина, подкисленного разведенной соляной кислотой, с раствором К4[Fe(CN)6] (1:10) выпадает обильный кристаллический бледно-желтый осадок, часть кристаллов срастается в виде крыльев или их обломков (12).
Насыщенный спиртовой раствор пикролоновой кислоты с 0,1%-ным раствором азотнокислого стрихнина дает быстро кристаллизующийся осадок в виде веточек.
Четыреххлористый свинец с подкисленным соляной кислотой раствором азотнокислого стрихнина дает быстро кристаллизующийся осадок. Быстрота образования кристаллов зависит от концентрации раствора алкалоидов; 0,5% раствор азотнокислого стрихнина образует с этим реактивом в большинстве случаев кристаллы перьевидных форм, а 0,1 и 0,05%-ные растворы алкалоида – кристаллы призматической формы или в виде пластинок. При действии этих реактивов на настойку чилибухи получаются аморфные осадки, за исключением реакции с К4[Fe(CN)б], с которым образуется кристаллический осадок в виде чешуек (1).
При взаимодействии на предметном стекле капли азотнокислого стрихнина с каплей свежеприготовленного 1%-ного раствора соли Рейнеке образуется аморфный осадок, который вскоре переходит в кристаллический в виде дендритов и игл.
При добавлении к капле азотнокислого стрихнина капли 10%-ного раствора платинохлористоводородной кислоты, через 5 – 10 мин выпадают бесцветные призмы и кристаллы, напоминающие форму конвертов (12).
Нефармакопейные реакции на бруцин.
Чистый препарат бруцина с концентрированной азотной кислотой дает кроваво-красную окраску, которая постепенно переходит в красно-желтую и желтую. При прибавлении к желтому раствору раствора хлористого олова (SnCl2) или гипосульфита (Nа2S2O3) появляется фиолетовое окрашивание (12).
Бруцин, как и стрихнин, дает ряд характерных микрокристалличесикх реакций.
При добавлении к капле азотнокислого бруцина капли 10%-ного раствора платинохлористоводородной кислоты, через 5 – 10 мин выпадают кристаллы игольчатой формы.
От прибавления капли насыщенного раствора пикролоновой кислоты к капле раствора хлористоводородного бруцина сначала образуется бледно-желтый аморфный, а затем, при стоянии, кристаллический осадок в виде звезд и пучков из мелких пластинок (2).
При добавлении к капле солянокислого бруцина капли 1%-ного свежеприготовленного раствора антраниловой кислоты, выпадают интенсивно желтые пластинки и призмы с двусторонними концевыми гранями.
При взаимодействии на предметном стекле капли раствора солянокислого бруцина с каплей 1%-ного раствора палладиевохлористоводородной кислоты образуются кристаллы в виде игл и пластинок желтого цвета (12).
Количественный анализ.
Количественное определение суммы стрихнина и бруцина в сухих препаратах. Навеску (1 – 7 г) порошка обезжиривают петролейным эфиром, помещают в склянку емкостью 200 мл с притертой пробкой и заливают 50 мл эфира, 25 мл хлороформа и 7,5 мл раствора аммиака. Полученную смесь в течение часа часто и сильно встряхивают. 50 мл отстоявшегося эфирохлороформного слоя фильтруют через сухой хорошо прикрытый фильтр диаметром 10 см в коническую колбу емкостью 150 мл. Фильтр промывают два раза эфирохлороформной смесью, присоединяя фильтрат к основному объему жидкости. Растворитель отгоняют досуха. Остаток растворяют в 5 мл спирта, прибавляют 15 мл воды, 3 капли метилового красного и титруют 0,1 н. раствором соляной кислоты до розового окрашивания.
1 мл 0,1 н. раствора соляной кислоты, израсходованной на титрование, соответствует 0,0364 г смеси равных частей стрихнина и бруцина (15).
Определение стрихнина в препаратах (порошке).
Около 0,3 г препарата (точная навеска) растворяют при нагревании в нейтрализованной по фенолфталеину смеси, состоящей из 30 мл спирта и 15 мл хлороформа, и при постоянном взбалтывании титруют 0,1 н. раствором едкого натра (индикатор фенолфталеин).
1 мл 0,1 н. раствора едкого натра, израсходованного на титрование, соответствует 0.03974 г стрихнина нитрата (12).
Определение стрихнина нитрата в ампулах. К 10 мл препарата прибавляют 1 каплю раствора метилового красного и по каплям 0,02 н. раствора едкого натра до перехода красной окраски в желтую.
К нейтрализованному раствору добавляют 10 мл спирта, нейтрализованного по фенолфталеину, и титруют 0,02 н. раствором едкого натра (индикатор 5 капель фенолфталеина). 1 мл ''02 н. раствора едкого натра соответствует 0,007948 г стрихнина нитрата (12).
Колориметрический метод определения малых доз стрихнина нитрата (по Соболевой). 1 мл раствора, содержащего 0, 001 г соли алкалоида, доводят водой до 4 мл, прибавляют 4 мл соляной кислоты (удельный вес 1,12) и 1 – 2 г цинковой пыли. После окончания бурной реакции смесь нагревают на водяной бане до прекращения выделения водорода и оставляют до полного охлаждения, после чего быстро фильтруют через смоченную водой вату в мерную колбу на 50 мл, в которую предварительно внесено 2 мл соляной кислоты (удельный вес 1,12). Вату промывают водой, к фильтрату прибавляют 1 каплю 10%-ного раствора нитрита натрия, доводят водой до метки и взбалтывают.
Берут 5 мл этого раствора, доводят водой до 20 мл и колориметрируют.
Стандартом может быть либо раствор стрихнина нитрата, обработанного указанным образом, либо смесь из 2,2 мл раствора хлорида кобальта (0,0059436 г хлорида кобальта в 1 мл), 0,8 мл раствора бихромата калия (с содержанием 0,002 г в 1 мл) и 17 мл воды. Такой раствор соответствует окраске 0,01 г стрихнина нитрата, разбавленного 1:200000 (12).
Хроматографическое разделение стрихнина и бруцина на бумаге не представляет затруднений. Бруцин, дигидробруцин и стрихнин распределяют в системе изобутанол – соляная кислота – вода (50:7.5:13.5) (12).
Числовые показатели.
Содержание суммы алкалоидов должно быть не менее 2,5%; золы общей не более 3,5% (15).
Хранение.
По списку А. В хорошо укупоренных банках, на складах – в ящиках и плотных мешках (15).
Заключение
Несмотря на современное развитие методов исследований, в изучении индольных алкалоидов остается еще много неизвестного. В частности, не до конца выяснен механизм биосинтеза ряда терпеноидных алкалоидов, ведутся работы по изучению регуляции биосинтеза индольных алкалоидов и их предшественников, взаимосвязи между различными видами обмена веществ в растении и о роли алкалоидов в обмене веществ в растении.
Интерес представляет хемотаксономический аспект вопроса о распространении индольных алкалоидов в растительном мире. Как было сказано, существует ряд алкалоидов, одинаковых для различных видов в пределах одного рода, произрастающих на разных континентах. Изучению путей заселения этих континентов и разыскания филогенетической связи между отдельными таксонами на основании данных о химическом составе, вероятно, будут посвящены будущие перспективные научные исследования.
Возможно, следует подвергнуть пересмотру и уточнению методы качественного и количественного анализа сырья и препаратов, содержащих индольные алкалоиды, в силу того, что методы, применяемые в настоящее время, были разработаны в условиях иного материально-технического оснащения лабораторий и регламентируются устаревшей нормативно-технической документацией, и, поэтому зачастую не удовлетворяют требованиям современных фармакопей и иных международных конвенций и соглашений.
Необходимо отметить, что, несмотря на достаточно широкое применение индольных алкалоидов в современной терапевтической практике, все-таки их потенциальные возможности еще не раскрыты в полной мере. Изыскание новых лекарственных препаратов на основе лекарственного растительного сырья, содержащего индольные алкалоиды, а также создание новых препаратов с улучшенными фармакотерапевтическими показателями на основе уже имеющихся препаратов может занять достойное место в будущей научно-исследовательской работе.
Список использованной литературы
1. Орехов А.П. Химия алкалоидов. Изд. 2-е. М.: Издательс<