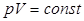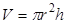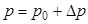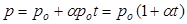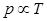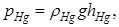Основания молекулярно-кинетической теории.
Законы идеального газа.
Казань – 2013
УДК 530.10
ББК 22.36
Э 41
Печатается по рекомендации
Учебно-методической комиссии
Института Физики
Казанского (Приволжского) федерального университета
Составители:
доцент кафедры общей физики Захаров Ю.А.
доцент кафедры общей физики Ерёмина Р.М.
доцент кафедры общей физики Скворцов А.И.
старший преподаватель кафедры общей физики Яцык И.В.
старший лаборант кафедры общей физики Блохин Д.С.
Рецензент –

Методическое пособие «Экспериментальные задачи общего физического практикума по молекулярной физике и термодинамике. Основания молекулярно-кинетической теории. Законы идеального газа» предназначено для студентов естественно-научных специальностей университетов. Приводятся описания лабораторных работ физического практикума общего курса физики, раздел «Молекулярная физика и термодинамика», по теме «Основания молекулярно-кинетической теории. Законы идеального газа». В каждой работе даны подробные описания установок, ход выполнения работ и список вопросов для самостоятельной подготовки.
УДК 530.10
ББК 22.36
Э 41
Ó Казанский университет, 2013
СОДЕРЖАНИЕ
212. ОПРЕДЕЛЕНИЕ КИНЕМАТИЧЕСКИХ ХАРАКТЕРИСТИК МОЛЕКУЛ ГАЗА.. 12
2131. ЗАВИСИМОСТЬ ОБЪЁМА ГАЗА ОТ ТЕМПЕРАТУРЫ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ (ЗАКОН ГЕЙ-ЛЮССАКА) 16
2132. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ГАЗА ОТ ОБЪЕМА.. 19
ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ (ЗАКОН.. 19
БОЙЛЯ-МАРИОТТА) 19
2133. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ГАЗА ОТ ТЕМПЕРАТУРЫ ПРИ ПОСТОЯННОМ ОБЪЕМЕ 22
(ЗАКОН ШАРЛЯ) 22
214. ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ CP/CV РАЗНЫХ ГАЗОВ С ИСПОЛЬЗОВАНИЕМ ПРИБОРА ПО ИЗУЧЕНИЮ УПРУГОГО РЕЗОНАНСА ГАЗОВ.. 26
215. ИЗМЕРЕНИЕ КОЭФФИЦИЕНТА ПУАССОНА И ИЗОХОРИЧЕСКОЙ ТЕПЛОЕМКОСТИ ВОЗДУХА.. 29
216. СКОРОСТЬ ЗВУКА В ГАЗАХ.. 34
Контрольные вопросы и дополнительные задания. 39
211. ИССЛЕДОВАНИЕ БРОУНОВСКОГО ДВИЖЕНИЯ
Введение
Английский ученый Броун (Brawn) обнаружил, что мельчайшие частички цветочной пыльцы, взвешенные в воде, находятся в состоянии непрерывного движения, не подчиняющегося на первый взгляд каким-либо закономерностям.
Эйнштейном и Смолуховским была выдвинута гипотеза, что движение броуновских частиц удовлетворяет уравнению
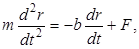 (1)
(1)
где m и r масса и радиус-вектор броуновской частицы, первое слагаемое в правой части представляет собой силу вязкого трения, действующую на частицу, а второе – случайную по величине и направлению силу давления со стороны прилежащих частей жидкости. При этом считалось, что частица находится все время на одной глубине, так что сила тяжести и сила Архимеда уравновешивают друг друга.
Решая это уравнение можно показать, что среднее значение квадрата перемещения <Dr2> шарообразной броуновской частицы прямо пропорционально времени Dt, за которое происходит это перемещение:
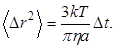 (2)
(2)
где k – постоянная Больцмана, T – абсолютная температура, h – вязкость жидкости, a – радиус частицы.
Соотношение (2) можно проверить экспериментально. Флуктуации давления на границе броуновской частицы легко объяснить с точки зрения молекулярно-кинетических представлений. Таким образом, справедливость уравнения (2) является косвенным свидетельством молекулярной структуры вещества.
Цель работы
Исследование броуновского движения. Экспериментальное подтверждение решения уравнения Эйнштейна–Смолуховского.
Решаемые задачи
ü Освоение техники наблюдения броуновского движения;
ü Наблюдение броуновского движения;
ü Знакомство с решением уравнения Эйнштейна–Смолуховского;
ü Экспериментальная проверка решения уравнения Эйнштейна–Смолуховского.
Техника безопасности
ü Внимание в работе используется стекло.
ü Будьте предельно аккуратны при работе с предметным и покровным стеклами;
ü Не прикасаться к оптической части микроскопа;
Экспериментальная установка
Приборы и принадлежности
ü Оптический микроскоп
ü Портативная видеокамера
ü ТВ-тюнер
ü Компьютер
ü Исследуемая жидкость

|
| Рис. 1 Общий вид установки для наблюдения броуновского движения. (1) оптический микроскоп, (2) видеокамера, (3) ТВ-тюнер, (4) ноутбук
|
Увеличение всей системы определяется совокупным увеличением объектива и окуляра микроскопа, а также видеокамерой и размером экрана монитора. Оно зависит от настройки системы и может достигать нескольких тысяч крат. Конкретное значение увеличения указано на установке. ТВ-тюнер подключается через порт USB 2.0 к компьютеру и позволяет записать изображения с камеры в цифровом виде.
В качестве исследуемой жидкости используется сильно разбавленное водой свежее молоко. Этот раствор должен быть практически прозрачным с очень слабой замутненностью. Броуновскими частицами в этом случае являются микроскопические капельки жира. Молоко должно быть не прокисшим. При скисании молока в растворе кроме капелек жира начинают двигаться бактерии, имеющие собственные механизмы перемещения, что мешает проведению эксперимента.
Порядок выполнения работы
Подготовка установки к работе
1. Очистить предметное стекло микроскопа. Для этого протереть кусочком салфетки его поверхность с обеих сторон в промежутке между двумя приклеенными покровными стеклами, либо в имеющемся углублении. Приготовить покровное стекло и также очистить его.
2. Пипеткой нанести каплю раствора молока на предметное стекло в середину промежутка между приклеенными стеклами (или в углубление). Диаметр капли должен составлять примерно 7 - 8 мм, не более (см. рис. 2). Сразу аккуратно накрыть промежуток покровным стеклом. Если стекло не коснулось капли, то слегка придавить его сверху (например, сухой спичкой) до касания. При этом стараться не испачкать верхнюю поверхность покровного стекла. Капля должна одновременно касаться поверхностей предметного и покровного стекол (см. рис. 3).

| 
|
| Рис 2. Предметное стекло с раствором молока
| Рис. 3. Сверху покровное стекло, снизу предметное стекло, раствор должен касаться обоих стекл.
|
3. Отодвинуть предметный столик от объектива микроскопа, вращая соответствующую ручку на корпусе микроскопа (см. рис. 4, стрелка указывает на ручку).
4. Осторожно поместить образец на предметный столик.
5. Включить электропитание осветителя микроскопа, видеокамеры и компьютера.
6. Открыть диафрагму осветителя. Ручку регулировки яркости осветителя поставить в среднее положение.
7. Двигая стекла с образцом, добиться попадания в просвечивающий пучок микроскопа.
8. Вплотную придвинуть образец к объективу, избегая соприкосновения объектива с покровным стеклом. Для этого наблюдать за промежутком между ними сбоку. ВНИМАНИЕ возможно продавливание покровного стекла окуляром микроскопа.
9. Плавно отодвигая предметный столик от объектива, получить резкое изображение крупных капелек жира. Они имеют сферическую форму с резкими очертаниями. Первоначально капельки располагаются во всей толще раствора, но постепенно всплывают к покровному стеклу и, оказавшись там, могут перемещаться только в горизонтальной плоскости. Необходимо настроиться на самый верхний слой частиц! Если на экране находится более 10-и частиц, то раствор молока оказался слишком концентрированным. Его необходимо разбавить и сменить образец в микроскопе.
10. Отрегулировать яркость и контрастность изображения с помощью ручек регулировки яркости и диафрагмы осветителя микроскопа. Яркость просвечивающего пучка должна быть по возможности минимальной, иначе раствор нагреется и быстро высохнет.
11. Прикрепить камеру к окуляру микроскопа.
12. Создать папку с именем группы в следующем каталоге D:\студент\
13. Запустить программу AVerTV6 (находиться на рабочем столе).
14. Добиться четкого изображения броуновских частиц при помощи объектива камеры. Если все частицы на экране упорядоченно перемещаются, подождать около 1 минуты до исчезновения этого течения.
Проведение измерений
1. Снять видео в программе AVerTV6 (кнопка «запись»). Время записи 50 сек.
2. Перенести из папки D:\студент\ видео в с созданную Вами папку
3. Закрыть программу AVerTV6.
4. Запустить программу VirtualDub (находится на рабочем столе)
5. Открыть ранее сохраненный видео файл в VirtualDub (Файл → открыть видео файл…)
 6. Выбрать на экране активно перемещающуюся броуновскую частицу с диаметром D около 2-3 мм и вывести ее изображение в центр экрана перемещением предметного столика. Определить как можно точнее ее реальный радиус а с учетом увеличения Ω оптической системы: a =D/2Ω. Увеличение оптической системы указано на микроскопе. Определить также минимальный размер более крупной частицы, броуновское движение которой становится незаметным.
6. Выбрать на экране активно перемещающуюся броуновскую частицу с диаметром D около 2-3 мм и вывести ее изображение в центр экрана перемещением предметного столика. Определить как можно точнее ее реальный радиус а с учетом увеличения Ω оптической системы: a =D/2Ω. Увеличение оптической системы указано на микроскопе. Определить также минимальный размер более крупной частицы, броуновское движение которой становится незаметным.
7. Преобразовать видео файлы в серию фотографий. Для этого в меню Файл выбрать команду Экспорт, а затем — команду Сохранить серию картинок. В окне Фильтр вывода картинок: формат имени файла для серий картинок, которые соответствуют различным частицам, поставьте различные префиксы, например латинские a, b и c. В окне Каталог для хранения картинок: выбрать D:\студент\группа\. Установить флажок в Выходной формат: на Windows BMP. Нажать ОК. Закрыть приложение VirtualDub. Файл→ Экспорт → сохранить серию картинок
8. Установить величину временного интервала между кадрами. Выставите частоту кадров. Частота кадров равная 0,16 соответствует временному интервалу между кадрами 5с.
9. Повторить действия пунктов 6-8 еще для других двух частиц.
10. По окончании измерений отключить электропитание установки. Вынуть и протереть предметное и покровное стекла и положить их в футляры.
Обработка результатов эксперимента.
1. Измерение изменения положения броуновской частицы с течением времени производится с помощью приложения «Измеритель» версия 1.0 ЗАО «1С». Для загрузки серии файлов с фотографиями необходимо выполнить команду Загрузить серию… в меню Файл. Далее в окне Открыть… выделить файлы соответствующие одной из частиц и нажать на кнопку Открыть. На экране появится изображение кадра под номером ноль. С помощью мыши и кнопок двойных стрелок в нижней части окна или стрелок перемещения на клавиатуре можно переходить от одного кадра к другому.
2. Нажатие «стрелкой» (кнопка  ) на первую из кнопок
) на первую из кнопок  позволяет создавать объекты «точка» в поле изображения. При переходе к следующему кадру, созданные объекты сохраняются. Зафиксируйте положение выбранной частицы в каждом кадре объектом «точка» начиная с кадра под номером 1.
позволяет создавать объекты «точка» в поле изображения. При переходе к следующему кадру, созданные объекты сохраняются. Зафиксируйте положение выбранной частицы в каждом кадре объектом «точка» начиная с кадра под номером 1.
3. Далее, необходимо для полученной совокупности положений частицы выявить наличие или отсутствие постоянной действующей силы и выбрать систему отсчета. Если траектория частицы вытянута вдоль некоторой прямой, то такое поведение могло быть обусловлено действием постоянной силы. Эта сила, например, может быть вызвана небольшим наклоном предметного столика. Направим вдоль этой прямой ось Y декартовой системы координат. В уравнении Энштейна-Смолуховского постоянная сила не учитывается, поэтому измерять перемещения можно только вдоль оси X перпендикулярной Y.
4. Если траектория частицы не имеет ярко выраженного направления оси системы координат можно ориентировать произвольно и определять перемещения вдоль любой из этих осей. Для создания система координат на рабочее поле нажимаем на кнопку  , затем щелкаем левой кнопкой мыши на рабочем поле. Появляется декартова система координат и мерный отрезок. При нажатой кнопке
, затем щелкаем левой кнопкой мыши на рабочем поле. Появляется декартова система координат и мерный отрезок. При нажатой кнопке  перемещаем и ориентируем необходимым образом систему координат. 100 мкм соответствует 72 мм на экране. Поэтому, для задания масштаба, при нажатой кнопке
перемещаем и ориентируем необходимым образом систему координат. 100 мкм соответствует 72 мм на экране. Поэтому, для задания масштаба, при нажатой кнопке  , удлиняем мерный отрезок до 72 мм. Далее фиксируем длину мерного отрезка 0.1 мм в окнах «Мерный отрезок». При нажатии кнопки «Показать таблицу» выводится окно с таблицей на передний план. Далее выбираем вкладку «Точки». Таблица содержит координаты каждой точки.
, удлиняем мерный отрезок до 72 мм. Далее фиксируем длину мерного отрезка 0.1 мм в окнах «Мерный отрезок». При нажатии кнопки «Показать таблицу» выводится окно с таблицей на передний план. Далее выбираем вкладку «Точки». Таблица содержит координаты каждой точки.
5. Для отчета необходимо сохранить изображение на экране. Для этого воспользуйтесь командой Экспорт изображения в меню Файл. С помощью команды Содержимое экрана с отрезками на фотографии можно сохранить на жестком диске в виде графического файла, а таблицу экспортировать в Excel. Обе операции можно выполнить с помощью вкладки Файл – Экспорт изображения и Экспорт таблиц в Excel.
6. Далее необходимо измерить изменение координаты X за время
D t = 5с D x (D t) = x n+1 - x n,
2D t = 10с D x (2D t) = x n+2 - x n,
3D t = 15с D x (3D t) = x n+3 - x n,
где x i координата частицы, x n одна из этих координат, выбранная произвольно.
7. Вычислить среднеквадратичные значения проекций перемещений частицы на ось X для трех промежутков времени по формулам:
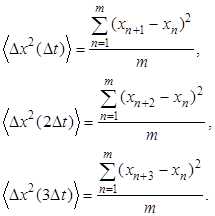
где m – число перемещений.
8. Построить график зависимости среднеквадратичного перемещения частицы от времени  . Экспериментальным доказательством справедливости закона Эйнштейна-Смолуховского является линейность графиков.
. Экспериментальным доказательством справедливости закона Эйнштейна-Смолуховского является линейность графиков.
Контрольные вопросы и дополнительные задания
1. Как оценить размер молекул?
2. Сколько молекул воды вытесняются наблюдаемой броуновской частицей?
3. Почему увеличение размера броуновских частиц приводит к замедлению их движения?
4. Как влияет изменение температуры на броуновское движение?
5. Понятие флуктуации. Флуктуации плотности и температуры.
6. Предположим, что броуновская частица является шаром радиуса 100 мкм. На половину поверхности частицы действует давление p 1, а на другую половину p 2. Какова должна быть разница p 1 – p 2, чтобы за одну секунду частица сдвинулась на расстояние, равное ее радиусу? Вязким трением пренебречь. Оценить во сколько раз должна отличаться концентрация молекул для обеспечения такой разницы давлений?
7. Решение уравнения Эйнштейна–Смолуховского.
212. ОПРЕДЕЛЕНИЕ КИНЕМАТИЧЕСКИХ ХАРАКТЕРИСТИК МОЛЕКУЛ ГАЗА
Введение
С точки зрения молекулярно- кинетической теории газ представляет собой совокупность отдельных микрочастиц (молекул, атомов, ионов). Для простоты можно считать их абсолютно твердыми шариками. Наблюдение броуновского движения частиц позволяет предположить, что молекулы находятся в непрерывном движении. Большая сжимаемость газов говорит о том, что молекулы газа находятся на большом расстоянии друг от друга. К кинематическим параметрам газа относятся: средняя длина свободного пробега молекул álñ (расстояние, которое пролетает молекула между двумя столкновениями), среднее эффективное сечение столкновения ásñ=0.25páDñ2, где D – максимальное расстояние между центрами сталкивающихся молекул, при котором происходит изменении их скорости: эффективный диаметр молекулы). Средняя частота столкновений будет пропорциональна сечению столкновений. Если концентрация молекул равна n, а средняя скорость теплового движения молекул áuñ, то средняя частота столкновений ázñ равна:
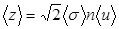 .
.
В этой формуле учтено, что средняя относительная скорость движения молекул в 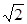 больше средней скорости их движения áuñ.
больше средней скорости их движения áuñ.
Среднюю длину свободного пробега álñ можно получить, поделив средний путь, проходимый молекулой за единицу времени, на число столкновений за это же время. Так как путь, проходимый в единицу времени, численно равен скорости, то длина свободного пробега álñ равна:
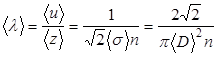
На основании представлений молекулярно-кинетической теории газов, в случае справедливости распределения Максвелла по скоростям можно найти связь между динамической вязкостью h и этими параметрами: 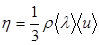 , где r - плотность газа. В состоянии равновесия, когда справедливо распределение Максвелла по скоростям, средняя скорость равна:
, где r - плотность газа. В состоянии равновесия, когда справедливо распределение Максвелла по скоростям, средняя скорость равна:
 , где R - универсальная газовая постоянная, m - молярная масса газа. Таким образом, выражение для средней длины свободного пробега через макропараметры равно:
, где R - универсальная газовая постоянная, m - молярная масса газа. Таким образом, выражение для средней длины свободного пробега через макропараметры равно:

Т.е., измерив температуру, коэффициент вязкости, и зная молярную массу газа, можно вычислить длину свободного пробега, и далее, по формуле оценить среде сечение столкновения, учитывая, что 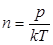 .
.
Цель работы
Определение кинематических характеристик различных газов: длины свободного пробега, эффективного сечения столкновений.
Решаемые задачи
ü Определение вязкости гелия, углекислого газа и воздуха.
Техника безопасности
ü Внимание: в работе используется стекло.
ü Будьте предельно аккуратны при работе с газовым шприцом;
Экспериментальная установка
Приборы и принадлежности
ü V-образное основание штатива, 28 см.
ü Штативный стержень, 75 см
ü S образный зажим
ü Штангенциркуль
ü Водоструйный насос
ü Термометр -30 ÷ +110°С
ü Безопасная емкость для вакууммирования 50 мл
ü Хомуты для резиновых трубок 12-20 мм (10 шт.)
ü Каучуковая трубка 4 мм Ø
ü Вакуумный шланг
ü Штуцер прямой полипропиленовый PP, Ø 4÷15 мм
ü Газовый шприц 100 мл, с 3-ходовым краном
ü Держатель 100 мл газового шприца
ü Капельницы (10 шт.)
ü Универсальный зажим, 0-80 мм
ü Капиллярная трубка Ø 0,5 мм длина 100 мм
ü Цифровой секундомер

|
| Рис. 3. Общий вид экспериментальной установки
|
Порядок выполнения работы
Упражнения №1.
- Установите поршень на V=50 ml.
- Откачайте ручным насосом газ из ёмкости. По показаниям манометра определите изменения давления Dр (примерно 500 mbar; измерения проводятся по черной шкале).
- Откройте вентиль и определите время t, за которое газ пройдет через капилляр.
- Измерьте длину капиляра l с помощью штангенциркуля, объем внутренней полости капиляра указан на капиляре.
- Вычислите радиус капиляра R, используя формулу объема цилиндра.
6. По формуле  вычислите вязкость газа.
вычислите вязкость газа.
7. Опыт повторите не менее пяти раз. Результаты занесите в таблицу.
8. Оцените относительную погрешность измерения вязкости газа. Погрешности измерений диаметра и длины капилляра возьмите из «паспорта» прибора.
8. Сравните полученное значение вязкости воздуха при комнатной температуре с табличным значением (h = 1,8 ×10-5 Па ×с при 18оС)
9. Вычислите плотность воздуха по формуле ρ=pM/RT, где М = 0,029 кг/моль – молярная масса воздуха, R - универсальная газовая постоянная, давление р и температуру Т измерьте по приборам в лаборатории.
10. Вычислите среднюю арифметическую скорость 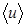 молекул воздуха при данных условиях.
молекул воздуха при данных условиях.
11. Вычислите среднюю длину свободного пробега 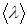 молекул воздуха при нормальных условиях, исходя из формулы связи ее с коэффициентом вязкости
молекул воздуха при нормальных условиях, исходя из формулы связи ее с коэффициентом вязкости 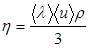 .
.
12. Исходя из формулы р = nkT, вычислите концентрацию п молекул воздуха в емкости для вакуумирования (k - постоянная Больцмана – равна 1.38∙10-23 Дж/К).
13. Вычислить среднее число столкновений молекул, испытываемых одной молекулойза одну секунду 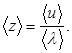
Упражнение №2.
1. Наберите газ (гелий или углекислый газ по указанию преподавателя) в камеру.
2. Поршень газового шприца установите на ноль.
3. Подсоедините камеру с газом к газовому шприцу.
4. Запустите газ в и по положению поршня определите объем газа.
5. Выполните пункты 2-7 упражнения №1.
2131. ЗАВИСИМОСТЬ ОБЪЁМА ГАЗА ОТ ТЕМПЕРАТУРЫ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ (ЗАКОН ГЕЙ-ЛЮССАКА)
Введение
Количественное исследование зависимости объема газа от температуры при неизменном давлении было произведено в 1802 г. французским физиком и химиком Жозефом Луи Гей-Люссаком (1778—1850). Опыты показали, что приращение объема газа пропорционально приращению температуры. Поэтому тепловое расширение газа можно, так же как и для других тел, охарактеризовать при помощи температурного коэффициента объемного расширения. Экспериментально установлено, что температурный коэффициент объемного расширения у всех газов одинаков (точнее, почти одинаков) и равняется:
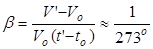 . (1)
. (1)
Коэффициент объемного расширения измеряется в градусы Цельсия С-1. За начальный объем V0 примем объем при температуре t0= 0°C. В таком случае приращение температуры газа равно температуре t= t’ отсчитанной по шкале Цельсия. Тогда, температурный коэффициент объемного расширения:
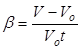 , и
, и  .
.
Следует, однако, иметь в виду, что закон Гей-Люссака не оправдывается, когда газ сильно сжат или настолько охлажден, что он приближается к состоянию сжижения. Подставим значение температурного коэффициента объемного расширения b в формулу температурной зависимости объема газа:
 . (2)
. (2)
Величину (273+ t) можно рассматривать как значение температуры, отсчитанное по новой температурной шкале, единица которой такая же, как и у шкалы Цельсия, а за нуль принята точка, лежащая на 273° ниже точки, принятой за нуль шкалы Цельсия, т. е. точки таяния льда. Нуль этой новой шкалы называют абсолютным нулем. Эту новую шкалу называют термодинамической шкалой температур, где T» t+273 °.
Тогда, при постоянном давлении справедлив закон Гей-Люссака:
 . (3)
. (3)
 Цель работы
Цель работы
Проверка закона Гей-Люссака
Решаемые задачи
ü Определение зависимости объёма газа от температуры при постоянном давлении
ü Определение абсолютной шкалы температур путем экстраполяции в сторону низких температур
Техника безопасности
ü Внимание: в работе используется стекло;
ü Будьте предельно аккуратны при работе с газовым термометром; стеклянным сосудом и мерным стаканом
ü Будьте предельно внимательны при работе с горячей водой.
Экспериментальная установка
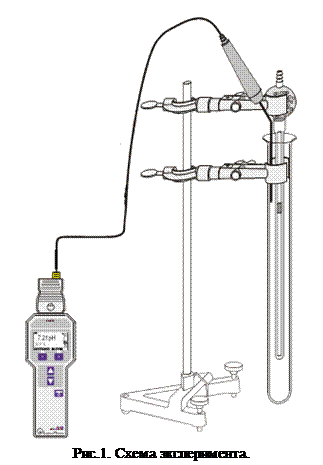
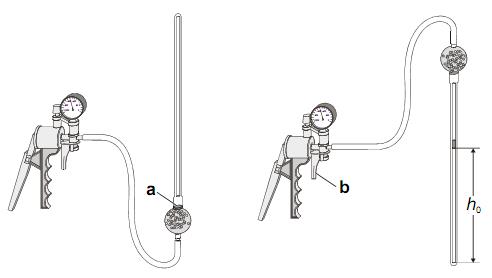
Для проверки закон Гей-Люссака используется газовый термометр. Он состоит из стеклянного капилляра с капелькой ртути, открытого с одного конца. Термометр помещают в воду с температурой около 90 ºС и эта система постепенно охлаждается. Открытый конец газового термометра находится при атмосферном давлении, и давление столба воздуха в термометре остается постоянным на протяжении всего эксперимента. Объём столба воздуха определяется по высоте столба газа под капелькой ртути и сечения капилляра по формуле:

| (4),
|
где r- внутренний диаметр капилляра (1,35мм); h – высота столба газа.
Приборы и принадлежности
ü Газовый термометр
ü Мобильный CASSY Lab
ü Термопара
ü Электрическая нагревательная плитка
ü Стеклянный мерный стакан
ü Стеклянный сосуд
ü Ручной вакуумный насос
Порядок выполнения работы
|
| Рис.2.
|
1. Откройте заглушку газового термометра, подключите к термометру ручной вакуумный насос.
2. Поверните осторожно термометр как показано слева на рис. 2 и откачайте воздух из него с помощью насоса так, чтобы капелька ртути оказалась в точке a) (см. рис.2).
3. После того как капелька ртути собралась в точке a)поверните термометр отверстием наверх и спустите нагнетенный воздух ручкой b) на насосе (см. рис.2) осторожно, чтобы ртуть не разделилась на несколько капелек.
4. Отсоедините насос от термометра. Отверстие термометра должно оставаться открытым.
5. Нагрейте воду в стеклянном сосуде на плитке до 90°С.
6. Налейте горячую воду в стеклянный сосуд.
7. Поместите в сосуд газовый термометр, закрепив его на штативе.
8. Поместите термопару в воду.
9. Измерьте высоту столба воздуха под капелькой ртути при изменении температуры.
10. Постройте график измеренной зависимости объема столба воздуха от температуры, откладывая по оси абсцисс – температуру в градусах Цельсия.
11. Продолжите график до пересечения с осью абсцисс. Определите температуру пересечения, объясните полученные результаты.
12. По тангенсу угла наклона определите коэффициент объемного расширения газа.
13. Рассчитайте зависимость объема от температуры при постоянном давлении по закону Гей-Люссака и постройте график. Сравните теоретические и экспериментальные зависимости.
2132. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ГАЗА ОТ ОБЪЕМА
ПРИ ПОСТОЯННОЙ ТЕМПЕРАТУРЕ (ЗАКОН
БОЙЛЯ-МАРИОТТА)
Введение
Состояние идеального газа полностью описывается измеряемыми величинами: давлением, температурой, объемом. Отношение между этими тремя величинами определяется основным газовым законом:
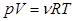 , ,
| (1)
|
где р – давление; V - объем; Т – температура; n - количество идеального газа в молях; R - универсальная газовая постоянная (8,31 Дж/(К×моль).
Если одна из величин давление, объем или температура остается постоянной, то другие две величины не могут быть изменены независимо друг от друга. Например, при постоянной температуре выполняется закон Бойля-Мариотта в виде:
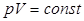
| (2)
|
Цель работы
Проверка закона Бойля-Мариотта.
Решаемые задачи
ü Измерение давления воздуха в шприце при изменении объема учитывая, что температура газа постояна.
Экспериментальная установка
Приборы и принадлежности
ü Шприц
ü Манометр
ü Ручной вакуумный насос

|
| Рис 1. Общий вид установки по изучению закона Бойля – Мариотта. (1) шприц, (2) манометр (отсчет производить по черной шкале), (3) ручной вакуумный насос
|
В данном эксперименте закон Бойля – Мариотта подтверждается с помощью установки показанной на рисунке 1. Объем воздуха в шприце определяется следующим образом:
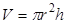
| (3),
|
где r радиус шприца, а h – расстояние от носика до поршня шприца.
Давление в системе нужно находить как:
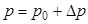
| (4),
|
где p0 атмосферное давление, а Dp – давление, измеренное при помощи манометра.
Порядок выполнения работы
1. Установите поршень шприца на отметке 50 мл.
2. Плотно надеть свободный конец соединительного шланга ручного вакуумного насоса на выходной патрубок шприца.
3. Выдвигая поршень, увеличивайте объем с шагом 5 мл, фиксируйте показания маномета по черной шкале.
4. Чтобы определить давление под поршнем, надо из атмосферного давления вычесть показания монометра, выраженного в паскалях. Атмосферное давление равно приблизительно 1 бар, что соответствует 100 000 Па.
5. Для обработки результатов измерений следует учитывать наличие воздуха в соединительном шланге. Для этого измерьте расчитайте объем соединительного шланга, измерив длину шланга рулеткой, а диаметр шланга штангенциркулем, учитывая, что толщина стенок составляет 1,5 мм.
6. Постройте график измеренной зависимости объема воздуха от давления.
7. Рассчитайте зависимость объема от давления при постоянной температуре по закону Бойля-Мариотта и постройте график.
8. Сравните теоретические и экспериментальные зависимости.
2133. ЗАВИСИМОСТЬ ДАВЛЕНИЯ ГАЗА ОТ ТЕМПЕРАТУРЫ ПРИ ПОСТОЯННОМ ОБЪЕМЕ
(ЗАКОН ШАРЛЯ)
Введение
Рассмотрим зависимость давления газа от температуры при условии неизменного объема определенной массы газа. Эти исследования были впервые произведены в 1787 г. Жаком Александром Сезаром Шарлем (1746—1823). Газ нагревался в большой колбе, соединенной с ртутным манометром в виде узкой изогнутой трубки. Пренебрегая ничтожным увеличением объема колбы при нагревании и незначительным изменением объема при смещении ртути в узкой манометрической трубке. Таким образом, можно считать объем газа неизменным. Подогревая воду в сосуде, окружающем колбу, измеряли температуру газа по термометру Т, а соответствующее давление р — по манометру. Наполнив сосуд тающим льдом, определяли давление ро, и соответствующую температуру То. Было установлено, что если при 0°С давление ро, то при нагревании на 1°С приращение давления будет в aро . Величина a имеет одно и то же значение (точнее, почти одно и тоже) для всех газов, а именно 1/273°C-1. Величину a называют температурным коэффициентом давления.
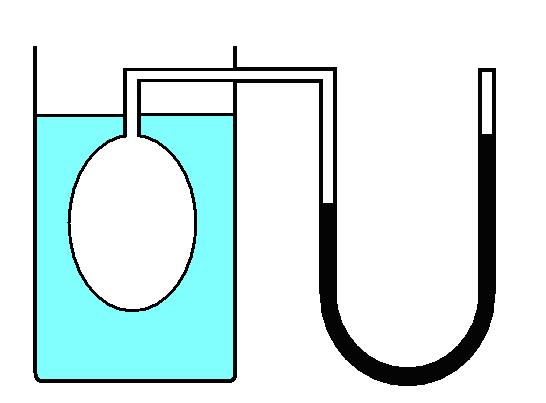
Закон Шарля позволяет рассчитать давление газа при любой температуре, если известно его давление при температуре 0°C. Пусть давление данной массы газа при 0°C в данном объеме po, а давление того же газа при температуре t - p. Температура меняется на t, а давления изменяется на aро t, тогда давление р равно:
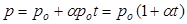
| (1).
|
При очень низких температурах, когда газ приближается к состоянию сжижения, а также в случае сильно сжатых газов закон Шарля неприменим. Совпадение коэффициентов a и b, входящих в закон Шарля и закон Гей-Люссака, не случайно. Так как газы подчиняются закону Бойля — Мариотта при постоянной температуре, то a и b должны быть равны между собой.
Подставим значение температурного коэффициента давления a в формулу температурной зависимости давления:

| (2).
|
Величину (273+ t) можно рассматривать как значение температуры, отсчитанное по новой температурной шкале, единица которой такая же, как и у шкалы Цельсия, а за нуль принята точка, лежащая на 273° ниже точки, принятой за нуль шкалы Цельсия, т. е. точки таяния льда. Нуль этой новой шкалы называют абсолютным нулем. Эту новую шкалу называют термодинамической шкалой температур, где T» t+273 °.
Тогда, при постоянном объеме справедлив закон Шарля:
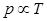
| (3)
|
Цель работы
Проверка закона Шарля
Решаемые задачи
ü Определение зависимости давления газа от температуры при постоянном объеме
ü Определение абсолютной шкалы температур путем экстраполяции в сторону низких температур
Техника безопасности
ü Внимание: в работе используется стекло.
ü Будьте предельно аккуратны при работе с газовым термометром; стеклянным сосудом и мерным стаканом.
ü Будьте предельно внимательны при работе с горячей водой.
Экспериментальная установка
Приборы и принадлежности
ü Газовый термометр
ü Мобильный CASSY Lab
ü Термопара
ü Электрическая нагревательная плитка
ü Стеклянный мерный стакан
ü Стеклянный сосуд
ü Ручной вакуумный насос
При откачке воздуха при комнатной температуре с помощью ручного насоса, создается давление на столб воздуха р0+Dр, где р 0 – внешние давление. Капля ртути также оказывает давление на столб воздуха:
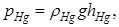
| (3),
|
где rHg=13,6 г/см3 – плотность ртути; g =9,81 м/c2 – ускорение свободного падения; hHg – высота капли ртути.
Общее давление на столб воздухав газовом термометре определяется выражением:

| (4)
|
В данном эксперименте этот закон подтверждается с помощью газового термометра. Термометр помещают в воду с температурой около 90°С и эта система постепенно охлаждается. Откачивая воздух из газового термометра с помощью ручного вакуумного насоса, поддерживают постоянный объём воздуха во время охлаждения.

|
| Рис.2.
|
Порядок выполнения работы
1. Откройте заглушку газового термометра, подключите к термометру ручной вакуумный насос.
2. Поверните осторожно термометр как показано слева на рис. 2 и откачайте воздух из него с помощью насоса так, чтобы капелька ртути оказалась в точке a) (см. рис.2).
3. После того как капелька ртути собралась в точке a)поверните термометр отверстием наверх и спустите нагнетенный воздух ручкой b) на насосе (см. рис.2) осторожно, чтобы ртуть не разделилась на несколько капелек.
4. Нагреть воду в стеклянном сосуде на плитке до 90°С.
5. Налить горячую воду в стеклянный сосуд.
6. Поместить в сосуд газовый термометр, закрепив его на штативе.
7. Поместить термопару в воду, постепенно эта система охлаждается. Откачивая воздух из газового термометра с помощью ручного вакуумного наноса, поддерживаете постоянный объём столба воздуха в течении всего процесса охлаждения.
8. Фиксируйте показание манометра D р и температуру Т.
9. Постройте зависимость полного давления газа p 0+D p + p Hgот температуры в оС.
10. Продолжите график до пересечения с осью абсцисс. Определите температуру пересечения, объясните полученные результаты.
11. По тангенсу угла наклона определите температурный коэффициент давления.
12. Рассчитайте зависимость давления от температуры при постоянном объеме по закону Шарля и постр




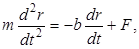 (1)
(1)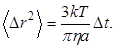 (2)
(2)


 6. Выбрать на экране активно перемещающуюся броуновскую частицу с диаметром D около 2-3 мм и вывести ее изображение в центр экрана перемещением предметного столика. Определить как можно точнее ее реальный радиус а с учетом увеличения Ω оптической системы: a =D/2Ω. Увеличение оптической системы указано на микроскопе. Определить также минимальный размер более крупной частицы, броуновское движение которой становится незаметным.
6. Выбрать на экране активно перемещающуюся броуновскую частицу с диаметром D около 2-3 мм и вывести ее изображение в центр экрана перемещением предметного столика. Определить как можно точнее ее реальный радиус а с учетом увеличения Ω оптической системы: a =D/2Ω. Увеличение оптической системы указано на микроскопе. Определить также минимальный размер более крупной частицы, броуновское движение которой становится незаметным. ) на первую из кнопок
) на первую из кнопок  позволяет создавать объекты «точка» в поле изображения. При переходе к следующему кадру, созданные объекты сохраняются. Зафиксируйте положение выбранной частицы в каждом кадре объектом «точка» начиная с кадра под номером 1.
позволяет создавать объекты «точка» в поле изображения. При переходе к следующему кадру, созданные объекты сохраняются. Зафиксируйте положение выбранной частицы в каждом кадре объектом «точка» начиная с кадра под номером 1.  , затем щелкаем левой кнопкой мыши на рабочем поле. Появляется декартова система координат и мерный отрезок. При нажатой кнопке
, затем щелкаем левой кнопкой мыши на рабочем поле. Появляется декартова система координат и мерный отрезок. При нажатой кнопке  перемещаем и ориентируем необходимым образом систему координат. 100 мкм соответствует 72 мм на экране. Поэтому, для задания масштаба, при нажатой кнопке
перемещаем и ориентируем необходимым образом систему координат. 100 мкм соответствует 72 мм на экране. Поэтому, для задания масштаба, при нажатой кнопке  , удлиняем мерный отрезок до 72 мм. Далее фиксируем длину мерного отрезка 0.1 мм в окнах «Мерный отрезок». При нажатии кнопки «Показать таблицу» выводится окно с таблицей на передний план. Далее выбираем вкладку «Точки». Таблица содержит координаты каждой точки.
, удлиняем мерный отрезок до 72 мм. Далее фиксируем длину мерного отрезка 0.1 мм в окнах «Мерный отрезок». При нажатии кнопки «Показать таблицу» выводится окно с таблицей на передний план. Далее выбираем вкладку «Точки». Таблица содержит координаты каждой точки.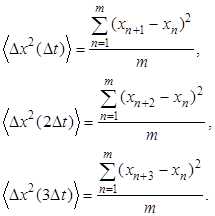
 . Экспериментальным доказательством справедливости закона Эйнштейна-Смолуховского является линейность графиков.
. Экспериментальным доказательством справедливости закона Эйнштейна-Смолуховского является линейность графиков.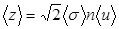 .
.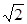 больше средней скорости их движения áuñ.
больше средней скорости их движения áuñ.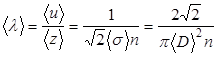
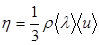 , где r - плотность газа. В состоянии равновесия, когда справедливо распределение Максвелла по скоростям, средняя скорость равна:
, где r - плотность газа. В состоянии равновесия, когда справедливо распределение Максвелла по скоростям, средняя скорость равна: , где R - универсальная газовая постоянная, m - молярная масса газа. Таким образом, выражение для средней длины свободного пробега через макропараметры равно:
, где R - универсальная газовая постоянная, m - молярная масса газа. Таким образом, выражение для средней длины свободного пробега через макропараметры равно:
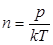 .
.
 вычислите вязкость газа.
вычислите вязкость газа.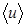 молекул воздуха при данных условиях.
молекул воздуха при данных условиях.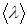 молекул воздуха при нормальных условиях, исходя из формулы связи ее с коэффициентом вязкости
молекул воздуха при нормальных условиях, исходя из формулы связи ее с коэффициентом вязкости 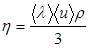 .
.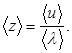
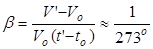 . (1)
. (1)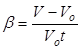 , и
, и  .
. . (2)
. (2) . (3)
. (3) Цель работы
Цель работы

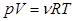 ,
,