Эритроциты –безъядерные клетки, главной функцией которых является транспорт газов: перенос О2 и СО2. Он возможен благодаря большому содержанию гемоглобина и высокой активности фермента карбоангидразы.Двояковогнутая форма эритроцитов имеет большую площадь поверхности по сравнению с клетками сферической формы такого же размера. Это облегчает газообмен между клеткой и внеклеточной средой. Кроме того, такая форма, а также особенности строения мембраны и цитоскелета обеспечивают большую пластичность эритроцитов при прохождении ими мелких капилляров. Зрелые эритроциты не имеют ядер, рибосом, митохондрий, лизосом. Поэтому обмен эритроцитов имеет ряд особенностей:
1. В зрелых эритроцитах не идут реакции биосинтеза белков.
2. Образование энергии - только путем гликолиза, субстрат - только глюкоза.
В эритроцитах существуют механизмы предохранения гемоглобина от окисления:
1. Активно протекает ГМФ-путь распада глюкозы, дающий НАДФ.H2
2. Высока концентрация глютатиона - пептида, содержащего SH-группы.
Приблизительно 90% сухого вещества эритроцитов составляет гемоглобин, белок с повышенным содержанием железа. При недостаточном поступлении железа с пищей или избыточной потебности (беременность) равивается железодефицитная анемия.
Антиоксидантную защиту осуществляет ферментативная система эритроцита предотвращающая токсическое действие активных форм кислорода (О-2 и н2О2) и разрушение мембран эритроцитов.
Глутатион - трипептид, состоящий из глютаминовой кислоты, глицина и цистеина. Мощный антиоксидант, который и предотвращает образование свободных радикалов, и предохраняет клетки от их повреждающего воздействия. Глютатион нейтрализует кислородсодержащие молекулы до того, как они повредят клетки. Вместе с селеном он образует фермент глютатионпероксидазу, которая нейтрализует перекись водорода. Глютатион защищает не только отдельные клетки, но и стенки артерий, мозг, сердце, иммунокомпетентные клетки, почки, хрусталик, печень, легкие и кожу от повреждающего действия свободных радикалов. Он играет большую роль в предупреждении рака (особенно рака печени), преждевременного старения.
7. Гемоглобин, строение, св-ва, производные, виды. Сравнительная хар-ка гемоглобина и миоглобина. Роль 2,3 –ДФГК. Гипоксия.
Гемоглобин— сложный железосодержащий белок животных и человека, способный обратимо связываться с кислородом, обеспечивая его перенос в ткани. Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве простетической группы здесь выступает особая пигментная группа, содержащая химический элемент железо — гем. Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1 и β2. Субъединицы соединены друг с другом по принципу изологического тетраэдра. Главная функция гемоглобина состоит в переносе дыхательных газов: кислорода от легких к тканям и углекислого газа от тканей к легким, а также регуляция КОС.
Соединения гемоглобина:
1. Оксигемоглобин (HbО2) — гемоглобин, присоединивший 4 молекулы
О2. В артериальной крови его содержится около 98%, а в венозной — около
60%. Гемоглобин, отдавший О2, называется восстановленный, или
дезоксигемоглобин (Hb). Гемоглобин обладает высоким сродством к
кислороду. Показателем сродства является Р50 — напряжение О2 в мм рт.ст.,
при котором содержание оксигемоглобина равно 50% (в норме Р50 составляет
27 мм рт. ст.). Снижение данного показателя свидетельствует об уменьшении
сродства гемоглобина к кислороду, а увеличение его — о повышении сродства.
2. Карбогемоглобин (HbСО2) — соединение гемоглобина с СО2.
3. Карбоксигемоглобин (HbCО) — соединение гемоглобина с угарным
газом (СО). Соединение в 150–200 раз прочнее HbО2; гемоглобин,
присоединивший СО, неспособен связываться с О2. При содержании во
вдыхаемом воздухе 0,1% СО 80% гемоглобина превращается в
карбоксигемоглобин. При содержании 1% — гибель через несколько минут. В норме в крови содержится примерно 1% HbCO. У курильщиков — до 3%,
после глубокой затяжки — до 10%. При вдыхании чистого О2 резко возрастает скорость распада карбоксигемоглобина, что пользуется на практике для лечения отравлений СО.
4. Метгемоглобин (MetHb). Образуется под влиянием сильных
окислителей (нитраты, неорганические нитриты, сульфаниламиды,
перманганат калия и др.). При этом Fe2+ превращается в Fe3+, в результате чего возникает прочное соединение гемоглобина с О 2, нарушается транспорт О2, при 66% насыщения крови MetHb наступает острая гипоксия
Миоглобин — кислород-связывающий белок скелетных мышц и мышцы сердца. Миоглобин высокотоксичен при его нахождении в свободном состоянии в плазме крови: крупные молекулы миоглобина могут закупоривать канальцы почек и приводить к их некрозу. Конкурируя с гемоглобином эритроцитов за связывание с кислородом в лёгких и не выполняя функцию отдавания кислорода тканям, свободный миоглобин ухудшает кислородное снабжение тканей и приводит к развитию тканевой гипоксии. Самоотравление организма свободным миоглобином и как следствие острая почечная недостаточность и тканевая гипоксия — одна из главных причин смерти при синдроме длительного сдавливания, встречающемся при тяжелых травмах со сдавлением или размозжением значительных количеств мышечной ткани.
Дыхательная функция крови — транспорт О2 и СО2 — осуществляется благодаря большому содержанию, высокой активности фермента карбоангидразы, большой концентрации 2,3-дифосфоглицериновой кислоты, наличию АТФ и. Эти соединения, главным образом 2,3- дифосфоглицериновая кислота, связываясь с дезоксигемоглобином, уменьшают его сродство с О2, что способствует отдаче тканям.
Виды гипоксии.
Гипоксическая (экзогенная) — при снижении парциального давления кислорода во вдыхаемом (низкое атмосферное давление или закрытые помещения);
Дыхательная (респираторная) — при нарушении транспорта кислорода из атмосферы в кровь(дыхательная недостаточность);
Гемическая (кровяная) — при снижении кислородной емкости крови (анемия; инактивация гемоглобина угарным газом или окислителями);
Циркуляторная — при недостаточности кровообращения (сердца либо сосудов), сопровождается снижением артериовенозной разницы по кислороду;
Тканевая (гистотоксическая) — при нарушении использования кислорода тканями (пример: цианиды блокируют цитохромоксидазу — фермент дыхательной цепи митохондрий);
Перегрузочная - вследствие чрезмерной функциональной нагрузки на орган или ткань (в мышцах при тяжелой работе, в нервной ткани во время эпилептического приступа);
Смешанная — любая тяжелая/длительная гипоксия приобретает тканевой компонент (гипоксия→ ацидоз → блокада гликолиза → отсутствие субстрата для окисления → блокада окисления → тканевая гипоксия).
Аноксия — это состояние, при котором ткани человеческого организма получают недостаточное количество кислорода. Может развиться при снижении атмосферного давления на больших высотах, недостаточности кровообращения, уменьшении содержания эритроцитов или гемоглобина в крови, а также при различных заболеваниях системы кровообращения, например, в случае сердечной недостаточности. Кроме того, может возникать вследствие недостаточного обогащения крови кислородом в легких из-за различных дыхательных нарушений или таких заболеваний, как пневмония, при которых уменьшается эффективная дыхательная поверхность лёгочной ткани. При истинной общей аноксии вскоре наступает смерть. Гипоксия – несоответствие энергопродукции энергетическим потребностям клетки. Основное звенопатогенеза — нарушение окислительного фосфорилирования в митохондриях, имеющее 2 последствия:
1. Нарушение образования АТФ → энергодефицит → нарушение энергозависимых процессов, а именно:сокращения — контрактура всех сократимых структур, синтеза — белков, липидов, нуклеиновых кислот,активного транспорта — потеря потенциала покоя, поступление в клетку ионов кальция и воды.
2. Накопление молочной кислоты и кислот цикла Кребса → ацидоз, вызывающий: блокаду гликолиза, единственного пути получения АТФ без кислорода; повышение проницаемости плазматической мембраны; активацию лизосомальных ферментов в цитоплазме с последующим аутолизом клетки.
8. Биосинтез гема. Реакции, ферменты, локализация, регуляция и биологическая роль. Порфирии
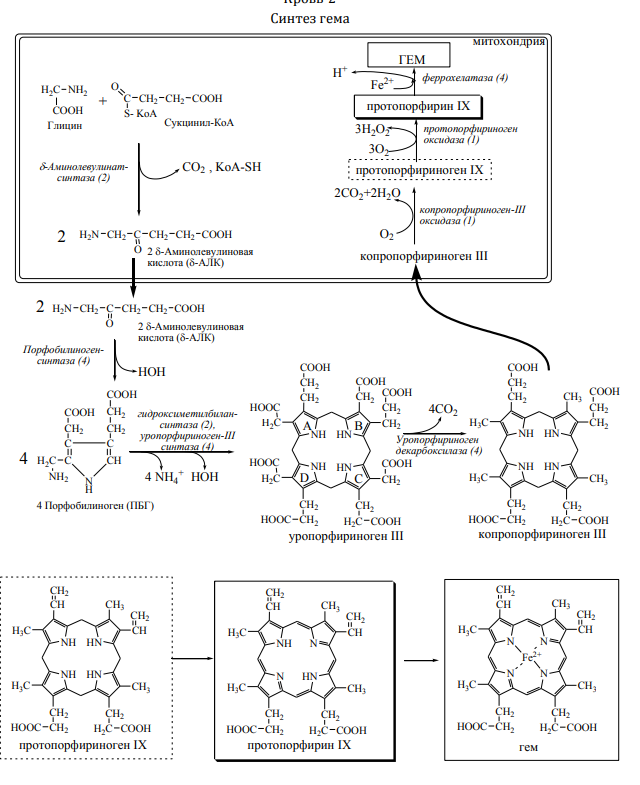
Гем является простетической группой многих белков: гемоглобина, миоглобина, цитохромов митохондриальной ЭТЦ, цитохрома Р450, ферментов каталазы, пероксидазы, цитохромоксидазы, триптофанпироллазы. Наибольшее кол-во гемма содержат эритроциты, заполненные гемоглобином, мышечные клетки(миоглобин), клетки печени (цитохром Р450). .
Гем синтезируется во всех тканях, но с наибольшей степенью в красном костном мозге(синтез гемоглобина) и печени (цитохром Р450). Синтезируетсся в митохондриях он индуцирует синтез цепей глобина на полирибосомах. Цепи глобина формируют глобулы и соединяются с гемом (4 глобулы соединяются в гемоглобин).
Порфирии – патологические состояния, которые развиваются при нарушении синтеза гемма вследствие дефицита одного или нескольких ферментов.
Гемоглобинопатия — наследственное изменение или нарушение структуры белка гемоглобина, обычно приводящее к клинически или лабораторно наблюдаемым изменениям в его кислород-транспортирующей функции либо в строении и функции эритроцитов. К наиболее часто встречающимся гемоглобинопатиям относятся серповидно-клеточная анемия, бета-талассемия, персистенция фетального гемоглобина.
Талассэмии – группа наследственных заболеваний с нарушением биосинтеза гемма, в результате гемоглобин, свойственный взрослым на 50 – 90% заменяется фетальным гемоглобином, в результате – гипоксия, гемолитические анемии, усиленное всасывание железа и отложение его во внутренних органах.
9. Распад Hb в клетках РЭС. Обмен билирубина в печени и превращение в ЖКТ. Причины возникновения и лабораторная диагностика желтух: гемолитической, паренхиматозной и обтурационной.
Старые поврежденные эритроциты фагоцитируются клетками ретикулоэндотелиальной системы (РЭС) и перевариваются в лизосомах. При распаде гемоглобина образуется билирубин. Дальнейший катаболизм билирубина в печени, кишечнике и почках провидит к образованию уробилиногенов и уробилина, которые выводятся с калом и с мочой. Железо освобождается при распаде гемма и используется для синтеза железосодержащих белков.
Билирубин – желчный пигмент, продукт восстановления биливердина:
1. Непрямой (несвязанный) билирубин – фракция сывороточного билирубина, не соединяющаяся в клетках печени с глюкуроновой кислотой.
2. Прямой (связанный) билирубин – фракция сывороточного билирубина, соединяющаяся в клетках печени с глюкуроновой кислотой с образованием диглюкуронида билирубина.
Эндогенный гемоглобин разрушается главным образом в печени, а также в селезенке, костном мозге и других органах.
Образующийся же в печени билирубин находится в связанной форме. Из печени билирубин поступает в желчный пузырь и подвергается превращениям. Дальнейшие продукты восстановления получили название уробилиногеновых тел. Почти весь выделяющийся печенью билирубин превращается в стеркобилиноген. У здорового человека ежедневно образуется 250-300 мг билирубина, который почти полностью удаляется из организма. Содержание билирубина в крови до 20,5 мкмоль\л. Повышение содержания билирубина сопровождается развитием желтухи. Железо, освобождающееся в клетках ретикуло-эндотелия при распаде гемоглобина, не удаляется из организма, а используется в синтезе нового хромопротеида - ферритина, выполняющего роль депо железа в организме. 2/3 общего количества ферритина содержится в печени. Из печени железо ферритина транспортируется к месту синтеза гемоглобина (костный мозг) в виде железосодержащего белка - трансферина.

1. Гемолитическая (надпеченочная желтуха) .
Гемолитическая желтуха развивается вследствие интенсивного гемолиза эритроцитов при гемолитических анемиях, вызванных сепсисом, лучевой болезнью, переливанием несовместимых групп крови, отравлением сульфаниламидами и т. д. Усиленный гемолиз эритроцитов приводит к интенсивному образованию в клетках РЭС непрямого билирубина. Печень не способна утилизировать в короткое время весь образующийся непрямой билирубин, он накапливается в крови и тканях. Так как печень обезвреживает повышенное количество непрямого билирубина, в больших количествах образуется прямой билирубин в печени. Поступление значительных количеств билирубина в кишечник ведет к усиленному образованию и выделению с калом и мочой стеркобилиногена. Кал приобретает более интенсивное окрашивание.
2. Паренхиматозная (печёночная) желтуха .
Паренхиматозная желтуха обусловлена повреждением гепатоцитов при острых вирусных инфекциях, хроническом и токсическом гепатитах. Причина повышения концентрации билирубина – нарушение функций и некроз части печеночных клеток.
Биохимические нарушения .
1. В результате некроза гепатоцитов прямой билирубин частично попадает в кровь, его концентрация увеличивается. Прямой билирубин хорошо растворим в воде и экскретируется с мочой .
2. Экскреция жёлчи нарушена, в кишечник попадает меньше билирубина чем в норме, поэтому количество образующегося в толстом кишечнике стеркобилиногена также снижена. Кал гипохоличный.
3. При прогрессирующем гепатите нарушается процессы коньюгации билирубина в печени, вследствие этого в крови накапливается непрямой билирубин.
4. Нарушается процесс разрушения уробилиногена, поступающего в печень из кишечника по воротной вене. Он попадает в общий кровоток и экскретируется с мочой (в норме в моче отсутствует) .
3. Механическая или обтурационная (подпеченочная) желтуха .
Механическая желтуха развивается при нарушении желчевыделения в двенадцатиперстную кишку. Основная причина – частичная или полная закупорка желчных протоков, например при жёлчно-каменной болезни, опухолях поджелудочной железы, желчного пузыря, печени. Так как нормальные пути экскреции коньюгированного билирубина заблокированы, происходит его поступление в кровь. В крови увеличивается содержание прямого билирубина, он выводится с мочой, придавая ей насыщенный оранжево-коричневый цвет. При полной закупорке общего желчного протока желчь не попадает в кишечник, не происходит образование стеркобилиногена, кал обесцвечен и в моче отсутствует уробилиноген.
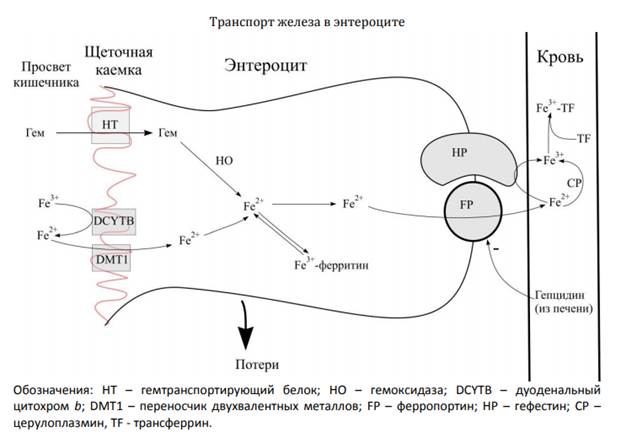
10. Метаболизм Fe (всасывание, транспорт в крови, депонирование) Нарушение метаболизма, причины и последствия.
Процесс всасывания железа является основным в поддержании гомеостаза железа. Железо всасывается как в виде гема (10% поглощаемого железа), так и в негемовой (9%) форме с помощью ворсинок верхней части тонкого кишечника. Сбалансированная ежедневная диета содержит около 5-10 мг железа (гемового и негемового), но всасывается лишь 1-2 мг. Гемовое железо содержится лишь в небольшой части пищевого рациона (мясные продукты). Оно очень хорошо всасывается (на 20-30%) и на его усвоение не влияют другие компоненты пищи. Большая часть пищевого железа - негемовое (оно содержится в основном в листовых овощах). Гемовое железо. Всасывается как железопорфириновый комплекс с помощью специальных рецепторов. Не подвержено влиянию различных факторов в просвете-кишечника
Негемовое железо. Всасывается как разновидность железа поступающего из солей железа. На процесс абсорбции в кишечнике оказывает влияние ряд факторов: концентрация солей железа, пищевые продукты, рН, лекарственные препараты. Всасывается в виде железа, образующегося из комплексов Fe (III). Находется под влиянием обмена таких железосвязывающих белков, как трансферрин, муцины, интегрины, и мобилферрин. Оксигеназа гема, специальный фермент, стимулирует распад комплекса железа и порфирина. .
В клетках слизистой оболочки тонкого кишечника, во время процесса всасывания, закисное железо Fe(II) превращается в окисное железо Fe(III) для того, чтобы быть включенным в состав трансферрина и транспортироваться по всему организму.
Транспортировка. Трансферрин, синтезируемый в печени, отвечает за транспортировку не только всосавшегося в кишечнике железа, но и железа, поступающего из разрушенных эритроцитов для повторного использования.
Хранение. Железо хранится в организме в виде ферритина и гемосидерина. Ферритин обнаруживается практически во всех клетках, обеспечивая легкодоступный резерв для синтеза железосодержащих соединений и представляя железо в растворимой, неионной и, безусловно, нетоксичной форме. .
Регуляция. Когда организм насыщен железом, то есть, им «заполнены» все молекулы апоферритина и трансферрина, уровень всасывания железа в желудочно-кишечном тракте уменьшается. Напротив, при сниженных запасах железа, степень его абсорбции увеличивается настолько, что поглощение становится значительно больше, чем в условиях пополненных запасов железа. Повышенное всасывание и нарушение обмена железа, которое сопровождается его избыточным отложением в тканях и органах носит название гемохроматоза (тяжелое наследственное заболевание). .
Дефицит железа приводит к развитию железодефицитной анемии. Избыточное поступление железа с водой и пищей может оказывать токсическое действие, угнетать антиоксидантную систему организма. Гемосидероз избыточное отложение гемосидерина в тканях организма. Возможные причины гемозидероза — усиленный распад эритроцитов, нарушение утилизации этого пигмента в процессе эритроцитопоэза, усиленное всасывание его в кишечнике, нарушение обмена железосодержащих пигментов.
В организме человека содержится 3-4 г железа (3,5 г в крови). Гемоглобин эритроцитов – 68% всего железа организма, ферритин – 27% (резервное железо печени, селезенки, красного костного мозга), миоглобин – 4%, трансферрин (в плазме крови) – 0,1%.
11. Особенности метаболизма лейкоцитов. Биохимические основы фагоцитоза. Респираторный взрыв.
Клетки, выполняющие защитные функции - способны к фагоцитозу. В лейкоцитах много активных протеаз, расщепляющих чужеродные белки. В момент фагоцитоза увеличивается выработка перекиси водорода и увеличивается активность пероксидазы, что способствует окислению чужеродных частиц (антибактериальное действие).
Лейкоциты богаты внутриклеточными низкоспецифичными протеиназами - катепсинами, локализованными в лизосомах. Катепсины способны к практически тотальному протеолизу белковых молекул. В лизосомах лейкоцитов в значительных количествах содержатся и другие ферменты: например, рибонуклеазы и фосфатазы. Способность некоторых клеток крови к фагоцитозу - одна из защитных функций крови. В фагоцитозе участвуют 2 типа лейкоцитов - нейтрофилы и моноциты.
Образование фагосомы начинается с взаимодействия специфических рецепторов фагоцитов с бактерией или комплексом антиген - антитело. Активация рецепторов, передающих сигнал в клетку с участием инозитолфосфатной системы, инициирует процессы, определяющие фагоцитарный ответ клетки. Он включает в себя формирование фагосомы, слияние её с лизосомой, образование фаголизосомы, активацию кислородзависимых бактерицидных механизмов уничтожения микробов и выработку клетками токсичного для микробов оксида азота, а также действие кислороднезависимых механизмов уничтожения микроорганизмов.
Взаимодействие белков интегринов с рецепторами эндотелиальных клеток капилляров приводит к адгезии нейтрофилов, которые далее мигрируют в ткань. Моноциты также могут выходить из кровяного русла, и тогда их называют макрофагами.
Оба типа фагоцитов захватывают и разрушают бактерии. Макрофаги, кроме того, утилизируют старые повреждённые клетки и клеточные оболочки, в том числе эритроциты. Активация кислородзависимых бактерицидных механизмов уничтожения микробов.
Ферментный комплекс мембраны фагосом - NADPH-оксидаза восстанавливает О2, образуя супероксидный анион: 2 О2 + NADPH → 2 O2- + NADP+ + H+
Супероксидный анион спонтанно или при участии фермента супероксиддисмутазы превращается в пероксид водорода: О2- + О2- + 2Н+ → Н2О2 + О2. Под действием миелопероксидазы, проникающей в фагосому при её слиянии с лизосомой, из пероксидов в присутствии галогенов (йодидов и хлоридов) образуются дополнительные токсичные окислители - гипойодид и гипохлорид. Н2О2 + Cl- + H+ → НОСl + H2O. Все эти молекулы являются сильными окислителями и оказывают бактерицидное действие. Резкое увеличение потребления кислорода фагоцитирующей клеткой называется "респираторным взрывом". Активные формы кислорода инициируют свободнорадикальные реакции, разрушающие липиды клеточных мембран поглощённых фагоцитами бактерий.
12. Особенности метаболизма тромбоцитов, роль в гемостазе.
Тромбоциты и их роль в организме.
Тромбоциты имеют дисковидную форму диаметром от 2 до 5 мкм, толщиной около 0,5 мкм. В крови содержится 180-320 х 109 /л. Образуются в костном мозге(из цитоплазмы мегакариоцитов). Не содержат ядра. В них синтезируются белки, осуществляется биологическое окисление, обмен углеводов и липидов.
Значение тромбоцитов в организме:
1) Участвуют в гемостазе (содержат тромбоцитарные факторы свёртывания).
2) Участвуют в транспорте креаторных веществ, важных для сохранения сосудистой стенки, стимулируют восстановление эндотелия.
3) Возможно, фагоцитируют низкомолекулярные соединения. Мембрана тромбоцитов содержит рецепторы, необходимые для активации тромбоцитов, их адгезии (приклеиванию к субэндотелию) и агрегации. Мембрана содержит фосфолипидный фактор 3, формирующий активные коагуляционные комплексы с плазменными факторами свертывания крови. В мембрану встроены гликопротеины, ответственные за адгезию тромбоцитов к коллагену, имеются рецепторы к фактору Виллебранда. Гранулы цитоплазмы содержат АТФ, кальций, серотонин, катехоламины. Кальций регулирует адгезию, образование тромбоксана А2, АДФ, способствует агрегации.
Гемостатическая функция тромбоцитов заключается:
§ в запуске немедленного (первичного) гемостаза за счет их адгезии и агрегации при нарушении целостности сосудов, что приводит к формированию тромбоцитарной пробки;
§ в локальной секреции сосудосуживающих веществ для уменьшения кровотока в поврежденном участке сосуда;
§ в ускорении реакций коагуляционного (вторичного) гемостаза с образованием в конечном счете фибринового сгустка.
Защитную функцию тромбоциты выполняют за счет склеивания (агглютинации) бактерий, фагоцитоза, а также эндо- и экзоцитоза иммуноглобулинов.
13. Механизм и стадии образования мочи: фильтрафия, реабсорбция, секреция. Механизм активного транспорта в канальцах глюкозы, АМК и др.
Образование мочи происходит в нефроне. Нефрон состоит из клубочка и почечного канальца. Клубочек образован пучком капилляров, представляющих собой разветвления приносящей и выносящей артериол. Капилляры окружает боуменова капсула, образованная канальцевым эпителием. От нее начинаются извитые участки почечных канальцев, переходящие в прямые канальцы.
Первая фаза - фильтрационная. Она протекает в капсуле и заключается в образовании первичной мочи. Как предполагается, первичная моча фильтруется из капилляров мальпигиева клубочка в полость капсулы.
Во вторую фазу образования мочи - реабсорбционную - в канальцах нефронов происходит обратное всасывание (реабсорбция) из первичной мочи в кровь аминокислот, глюкозы, витаминов, большей части воды и солей.
Клубочковая фильтрация — это первый этап мочеобразования, который заключается в переносе жидкости и растворенных в ней веществ из клубочковых капилляров в полость капсулы
Фильтрационное давление представляет собой эффективное давление, т.е. это разница гидростатического давления в капиллярах, которое способствует фильтрации и, препятствующих фильтрации, онкотическое давление крови и гидростатическое давление самой первичной мочи в клубочке почки.
Фильтрат, поступивший в капсулу Шумлянского-Боумена, составляет первичную мочу, которая по своему содержанию отличается от состава плазмы только отсутствием белков. первичная моча, содержащая необходимую организму воду и растворенные в ней вещества, большинство из которых представляют биологическую ценность, например аминокислоты, углеводы, соли и др.
Канальцевая реабсорбция - способность клеток почечных канальцев к обратному всасыванию веществ из просвета нефрона в кровь.
Канальцевой секрецией называют активный транспорт в мочу веществ, содержащихся в крови или образуемых в самих клетках канальцевого эпителия, например аммиака.
Моча обычно прозрачна, но имеет небольшой осадок, получаемый при центрифугировании и состоящий из малого количества эритроцитов, лейкоцитов и эпителиальных клеток. Белок и глюкоза в конечной моче практически отсутствуют. В небольших количествах в мочу поступают производные продуктов гниения белков в кишечнике — индола, скатола, фенола. В моче содержится широкий спектр органических кислот, небольшие концентрации витаминов (кроме жирорастворимых), биогенные амины и их метаболиты, стероидные гормоны и их метаболиты, ферменты и пигменты, определяющие цвет мочи.
Активный транспорт через мембрану связан с гидролизом АТФ. Особое значение первично активного транспорта в том, что с его помощью растворенные вещества могут перемещаться против электрохимического градиента. Энергию, необходимую для этого вида транспорта, предоставляет АТФ, гидролиз молекулы которой обеспечивается связанной с мембраной АТФ-азой. Фермент АТФ-аза является также составной частью транспортной системы, присоединяющей и перемещающей растворенные вещества через мембрану. .
Реабсорбция аминокислот в почечных канальцах происходит по механизму активного транспорта, против электрохимического и концентрационного градиентов, сопряженного с Na+. Профильтровавшиеся в клубочках аминокислоты на 90% реабсорбируются клетками проксимального канальца почки. Процесс активного транспорта является энергозависимым. Известны 4 транспортные системы активного транспорта различных аминокислот, аналогичные тем, которые действуют в кишечнике.
Глюкоза поступает из просвета канальца в клетки проксимального канальца с помощью специального переносчика, который должен присоединить ион Ма4+. Перемещение этого комплекса внутрь клетки осуществляется пассивно по электрохимическому и концентрационным градиентам дли ионов Nа+. Низкая концентрация натрия в клетке, создающая градиент его концентрации между наружной и внутриклеточной средой, обеспечивается работой натрий-калиевого насоса базальной мембраны. В клетке этот комплекс распадается на составные части. Внутри почечного эпителия создается высокая концентрация глюкозы, поэтому в дальнейшем по этому градиенту концентрации глюкоза переходит в интерстициальную ткань. Этот процесс осуществляется с участием переносчика за счет облегченной диффузии. В норме при обычной концентрации глюкозы в крови вся глюкоза реабсорбируется. При избытке глюкозы может произойти максимальная загрузка всех канальцевых систем транспорта. В таком случае вся глюкоза не может реабсорбироваться и появляется в конечной моче, возникает глюкозурия.
14. Органические (мочевина, мочевая кислота, аминокислоты и креатинин) и неорганические компоненты мочи в норме и при патологии. Патологические компоненты мочи (кровь, белок, глюкоза, билирубин). Причины их появления и диагностическое значение
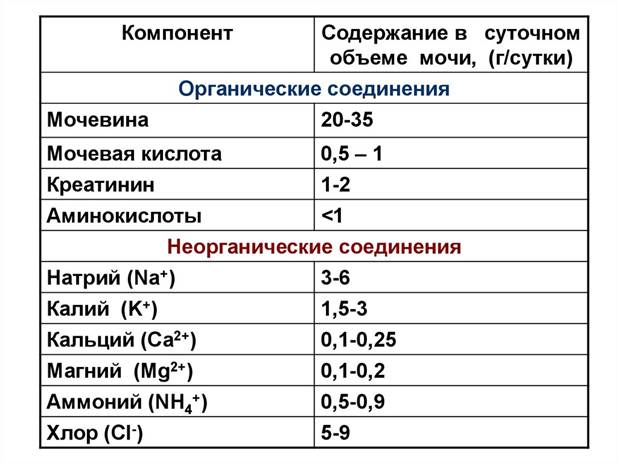
Мочевина. Синтезируемая печенью мочевина является главным соединением азота, образующимся при распаде аминокислот и пиримидиновых оснований. Её количество непосредственно определяет уровень интенсивности обмена белков: 70 г белка приводит к образованию 30 г мочевины. Количество выделяющейся мочевины увеличивается при потреблении богатой белками пищи и при усилении катаболизма белков в организме (злокачественные опухоли, лихорадка, гипертиреоз и другие гормональные нарушения). Снижение её наблюдается при нарушении азотвыделительной функции почек (нефриты), а также при заболеваниях печени
Мочевая кислота – конечный продукт пуринового обмена. За сутки у здорового взрослого человека с мочой выделяется около 0,7 г мочевой кислоты (в расчете на азот 0,08‑0,2 г). Эта величина редко падает ниже 0,5‑0,6 г даже при отсутствии в пище пуринов, но может возрастать до 1 г и более при употреблении диеты с высоким содержанием нуклеопротеинов. Количество выделяемой с мочой мочевой кислоты зависит от ее содержания в крови и определяется соотношением процессов клубочковой фильтрации, реабсорбции и секреции в канальцах. Реабсорбции подвергается 90‑95% мочевой кислоты, присутствующей в ультрафильтрате. Кортикостероиды повышают выведение мочевой кислоты с мочой и снижают ее концентрацию в плазме крови.
Повышенное выведение мочевой кислоты наблюдается при лейкемии, полицитемии, гепатитах, подагре, а также при лечении аспирином и кортикостероидами. Причиной повышенного выведения мочевой кислоты является ее гиперпродукция в организме вследствие усиленного распада тканевых структур или генетических нарушений активности отдельных ферментов. Вследствие незначительной растворимости в воде мочевая кислота и ее соли могут выпадать в осадок и образовывать камни в нижних отделах мочевых путей.
Креатинин также является конечным продуктом азотистого обмена. Образуется в мышечной ткани из фосфокреатина. Креатинин попадает в мочу преимущественно путем клубочковой фильтрации и в небольшом количестве за счет активной канальцевой секреции. Суточное выделение креатинина индивидуально и постоянно для каждого человека, так как отражает преимущественно объем мышечной массы организма, составляя в среднем 1‑2 г у мужчин и 0,6‑1,5 г у женщин. У мужчин на каждый 1 кг массы тела за сутки выводится с мочой 18‑32 мг креатинина, у женщин – 10‑25 мг. Эти величины мало зависят от содержания белков в диете, а связаны с объемом мышечной ткани и ее функцией..
Креатин в моче у здоровых взрослых людей практически отсутствует. Появляется в моче либо при употреблении значительных количеств креатина с пищей, либо при патологических состояниях. Увеличение содержания креатина в крови свыше 0,12 ммоль/л сопровождается появлением его в моче.
Наибольшее содержание креатина в моче отмечается при поражениях мышечной системы – миопатии и прогрессирующей мышечной дистрофии. Креатинурию можно наблюдать при поражениях печени, сахарном диабете, эндокринных расстройствах (гипертиреоз, аддисонова болезнь, акромегалия), инфекционных заболеваниях, системной красной волчанке, переломах костей, ожогах, белковом голодании, недостатке витамина Е, внутривенном введении ферментного гидролизата казеина.
У женщин креатина может выделяться больше, чем у мужчин, но креатинина меньше. Выделение креатина возрастает при беременности и в раннем послеродовом периоде.
Аминокислоты. Суточное выделение аминокислот с мочой составляет в среднем 1 г. Соотношение между содержанием отдельных аминокислот в крови и моче неодинаково. Количество той или иной аминокислоты, выделяемой с мочой, зависит от ее содержания в плазме крови, величины клубочковой фильтрации и степени реабсорбции этой аминокислоты в почечных каналъцах, т. е. от клиренса данной аминокислоты. В норме величина клиренса для большинства аминокислот 2‑6 мл/мин., для цистина 2‑4 мл/мин., а для глицина и гистидина 4 и 7 мл соответственно. Поэтому две последние аминокислоты в наибольших количествах присутствуют в моче.
Большая часть перешедших в ультрафильтрат аминокислот реабсорбируется в проксимальных канальцах. Аминокислоты всегда присутствуют в моче здорового человека, но содержание их там невелико. Однако оно резко возрастает при ряде заболеваний и в этом случае служит ведущим лабораторно-диагностическим признаком (фенилкетонурия, алкаптонурия, гистидинемия, цитрулинемия, гиперпролинемия).
Появление в моче больших количеств аминокислот (гипераминоацидурия) может быть следствием их повышенного содержания в крови и нарушения реабсорбции в канальцах. Гипераминоацидурия, связанная с повреждением нефрона, может быть приобретенной – при отравлениях солями тяжелых металлов и другими токсическими веществами, неполноценном питании или врожденной. В последнем случае причиной нарушения реабсорбции может явиться дефект транспорта аминокислот.
Гипераминоацидурия встречается при заболеваниях печени, что объясняется важной ролью этого органа в обмене аминокислот (реакции дезаминирования, трансаминирования и другие), а также при состояниях, сопровождающихся усиленным распадом тканевых белков (тяжелых инфекционных заболеваниях, злокачественных новообразованиях, обширных травмах, миодистрофии, гипертиреозе, при лечении кортикостероидами и АКТГ).
Патологические составные части мочи.
Наличие белка, сахара или гемоглобина в моче всегда является свидетельством патологии (хотя в норме их следы определяются).
Протеинурия. Этот симптом наблюдается при заболеваниях почек, которые сопровождаются структурно-функциональным нарушением гломерулярных мембран, например, при нефритах, нефрозах. Как физиологическое явление протеинурия встречается при беременности (часто клиницисты используют термин «альбуминурия». Он неточен, так как при заболевании почек в мочу могут выделяться не только альбумины, но и глобулины, особенно при нефрозах).
Различают: 1. почечную альбуминурию (результат повреждения нефрона) и 2. внепочечную альбуминурию (при заболеваниях мочевыводящих путей или предстательной железы).
Ферменты. В моче в незначительной концентрации присутствуют различные ферменты (липаза, α-амилаза, РНК-азы, ЛДГ, протеазы, фосфатазы). При ряде заболеваний их концентрация в моче возрастает: так, при остром панкреатите резко увеличивается диастазная (амилазная) активность мочи.
Глюкозурия. Она наблюдается при превышении максимума реабсорбции глюкозы (около 10 ммоль/л) в почечных канальцах, например, при сахаром диабете, когда выделение глюкозы с мочой может достигать нескольких граммов в сутки. Помимо диабета глюкозурия может отмечаться у больных тиреотоксикозом, при сильном стрессе, назначении глюкокортикоидов. В подавляющем большинстве случаев глюкозурия является следствием гипергликемии, превышающей почечный порог (около 10 ммоль/л). Глюкозурия, причиной которой является дефект транспортной системы почечных канальцев, называется ренальным диабетом (уровень глюкозы в крови при этом нормальный).
В моче могут присутствовать в определяемых количествах пентозы, фруктоза, галактоза (при врождённой недостаточности ферментов их метаболизма), что необходимо помнить при исследовании мочи на сахар.
Гемоглобинурия. Этот симптом отмечается при тяжелом внутрисосудистом гемолизе. Гематурия – появление эритроцитов в моче, бывает двух видов: 1. внепочечная – при травмировании мочевыводящих путей и 2. Почечная – при нарушении проницаемости почечных клубочков (острый нефрит).
Кетонурия. Кетонурия является следствием повышенного катаболизма липидов. Образующееся вследствие этого высокое содержание ацетил-КоА в тканях, например, при сахарном диабете и голодании, приводит к интенсивному образованию кетоновых тел, которые поступают в кровь и выдел









