В свертывании крови принимает участие комплекс белков, находящихся в плазме (плазменные факторы гемокоагуляции), большинство из которых является проферментами и обозначается римскими цифрами (фактор I, II и т.д.). Активация плазменных факторов осуществляется за счет протеолиза и сопровождается отщеплением пептидных ингибиторов. Для обозначения этого процесса к номеру фактора присоединяют букву «а» (фактор Па, Va и т.д.).
Плазменные факторы разделяются на две группы:
• витамин-К-зависимые, которые образуются преимущественно в печени при участии витамина К;
• витамин-К-независимые, для синтеза которых витамин К не требуется (табл. 5.7).
Таблица 5.7. Плазменные факторы свертывания крови
| Фактор
| Характеристика фактора
|
| I, фибриноген
II, протромбин
III, тканевый фактор
IV, Са++
V, акцелератор- глобулин
VII, проконвер- тин
VI1IC, антигемо- фильный глобулин А (АГГ)
IX, фактор Кристмаса, антигемо- фильный фактор В
X, фактор Стюарта—Прауэра
XI, плазменный предшественник тромбопластина
| Белок. Образуется в печени. Под влиянием тромбина переходит в фибрин. Принимает участие в агрегации тромбоцитов. Необходим для репарации тканей
Гликопротеин. Образуется в печени в присутствии витамина К. Под влиянием протромбиназы переходит в тромбин (фактор На)
Трансмембранный белок. Входит в состав мембран многих тканей. Является матрицей для развертывания реакций, направленных на образование протромбиназы по внешнему механизму
Участвует в образовании комплексов, входящих в состав теназы и протромбиназы. Необходим для агрегации тромбоцитов, реакции высвобождения, ретракции
Белок. Образуется в гепатоцитах. Витамин-К-независим. Активируется тромбином. Входит в состав протромбиназного комплекса
Витамин-К-зависимый гликопротеин. Образуется в печени, принимает участие в формировании протромбиназы по внешнему механизму. Активируется при взаимодействии с тромбопластином и факторами Alla, Ха, 1Ха, На
Гликопротеин. В плазме образует комплекс с vWF и специфическим антигеном. Активируется тромбином. Входит в состав те- назного комплекса. При его отсутствии или резком снижении концентрации возникает заболевание гемофилия А
Гликопротеин. Образуется в печени при участии витамина К. Активируется тромбином и фактором Vila. Переводит фактор X в Ха. При его отсутствии или резком снижении концентрации возникает заболевание гемофилия В
Гликопротеин. Образуется в печени при участии витамина К. Активируется факторами Vila и 1Ха. Фактор Ха является основной частью протромбиназного комплекса. Переводит фактор II в Па
Гликопротеин. Активируется фактором ХПа, калликреином совместно с высокомолекулярным кининогеном (ВМК)
|
Продолжение табл. 5. 7
| Фактор
| Характеристика фактора
|
| XII, фактор Хагемана, или фактор контакта
XIII, фибринста- билизируюиций фактор (ФСФ), фибриназа
Фактор Флетчера, пре калл икре ин Фактор Фитцджеральда, высокомолекулярный кининоген (ВМК)
| Белок. Активируется отрицательно заряженными поверхностями, адреналином, калликреином. Запускает внешний и внутренний механизмы образования протромбиназы и фибринолиза, активирует фактор XI и прекалликреин
Глобулин. Синтезируется фибробластами и мегакариоцитами. Стабилизирует фибрин. Необходим для нормального течения репаративных процессов
Белок. Участвует в активации фактора XII, плазминогена и ВМК.
Активируется калликреином, принимает участие в активации фактора XII, XI и фибринолиза
|
В эритроцитах обнаружены соединения, аналогичные тромбоцитарным факторам. Важнейшим из них является частичный тромбопластин (напоминает фактор Р3), который входит в состав мембраны. Кроме того, эритроциты содержат большое количество АДФ, фибриназу и другие факторы. При травме сосуда около 1 % эритроцитов вытекающей крови разрушается, что способствует образованию тромбоцитарной пробки и фибринового сгустка.
Лейкоциты содержат факторы свертывания, называемые лейкоцитарными. Так, моноциты и макрофаги при стимуляции антигеном синтезируют тканевый фактор. Эти же клетки являются продуцентами факторов свертывания — II, VII, IX и X. Приведенные факторы являются одной из причин возникновения диссеминированного (распространенное) внутрисосудистого свертывания крови (ДВС-синдром) при онкологических, многих воспалительных и инфекционных заболеваниях.
Важная роль в процессе свертывания крови отводится тканевым факторам, к которым относится тромбопластин (фактор III, TF). При разрушении тканей или стимуляции эндотелия эндотоксином и провоспали- тельными цитокинами большое количество тромбопластина поступает в кровоток и вызывает развитие ДВС-синдрома.
Механизм свертывания крови
Процесс свертывания крови представляет собой проферментно-ферментный каскад, в котором проферменты, переходя в активное состояние, способны активировать другие факторы свертывания крови. Подобная активация может носить последовательный и ретроградный характер.
Процесс свертывания крови включает 3 фазы. Первая — комплекс последовательных реакций, приводящих к образованию протромбиназы; во вторую фазу происходит переход протромбина в тромбин (фактора II в фактор Па); в третью — из фибриногена образуется фибриновый сгусток.
Первая фаза — образование протромбиназы может осуществляться по внешнему и внутреннему механизму. Внешний механизм предполагает обязательное присутствие тромбопластина (TF, или F-III), внутренний же связан с участием активированных тромбоцитов. Вместе с тем внутренний и внешний пути образования протромбиназы имеют много общего, так как активируются одними и теми же факторами (фактор ХПа, калликре- ин, ВМК и др.) и приводят в конечном итоге к появлению одного и того же активного фермента — фактора Ха, выполняющего в комплексе с фактором Va функции протромбиназы.
Важная роль в процессе свертывания крови отводится глицерофосфолипидам: фосфатидилсерину и фосфатидилэтаноламину. Одной из особенностей бислоя мембраны является его асимметрия. В наружном листке мембраны, контактирующей с кровью, преобладают фосфатидилхолин и сфингомиелин. Эти фосфолипиды содержат фосфохолин, обеспечивающий атромбогенность мембран. Молекула таких фосфолипидов электронейтральна.
Фосфатидилсерин и фосфатидилэтаноламин расположены преимущественно во внутреннем слое мембраны. На головке указанных фосфолипидов преобладает отрицательный заряд. Инициация свертывания крови может наступить лишь тогда, когда эти фосфолипиды появятся на наружной поверхности мембраны. Следовательно, для инициации свертывания крови необходимо нарушить исходную асимметрию фосфолипидов, что может произойти за счет обмена фосфолипидов между слоями.
Для процесса свертывания крови важна асимметрия в содержании ионов Са2+, концентрация которых в плазме и интерстициальной жидкости в 10 тыс. раз больше, чем в цитоплазме клетки и тромбоците. При травме сосуда в цитоплазму из внеклеточной жидкости переходит большое количество ионов Са2+ Поступление Са2+ в тромбоцит или клетки (травмированный эндотелий и др.) разрыхляет мембрану и выключает механизмы поддержания асимметрии фосфолипидного бислоя. При этом отрицательно заряженные молекулы фосфатидилсерина и фосфатидилэ- таноламина переходят на поверхность мембраны.
Зависимый от энергии процесс концентрации аминофосфолипидов во внутреннем листке мембраны связан с функционированием специфичных трансмембранных белков-переносчиков — транслоказ. осуществляющих однонаправленное передвижение фосфатидилсерина и фосфатидилэтаноламина во внутренний листок мембраны. При активации клеток и повышении уровня цитоплазматического Са2+ происходит ингибиция транслоказ. При этом наступает перемещение всех мембранных фосфолипидов, приводящее к выравниванию их концентрации в обоих листках мембраны.
Как только на поверхности клеточной мембраны увеличивается концентрация отрицательно заряженных фосфолипидов и они соприкасаются с кровью, содержащей высокую концентрацию ионов Са2+, образуются кластеры — активные зоны, к которым прикрепляются факторы свертывания. Эта реакция осуществляется следующим образом: ионы Са2+ с одной стороны присоединяются к головкам фосфатидилсерина, а с другой — соединяются с остатками у-карбоксиглутамино- вой кислоты, входящей в состав факторов свертывания крови (V, VIII, IX др.). За счет таких кальциевых мостиков в результате конформации открываются активные центры.
Формирование протромбиназы по внешнему пути начинается с активации фактора VII при его взаимодействии с тромбопластином, а также с факторами ХПа, 1Ха, Ха и калликреином. В свою очередь фактор Vila активирует не только фактор X, переводя его в фактор Ха, но и фактор IX, участвующий в образовании протромбиназы по внутреннему механизму.
Образование протромбиназы по внешнему пути происходит быстро и ведет к появлению фактора Ха и небольших порций тромбина (Па), который способствует необратимой агрегации тромбоцитов, активации факторов VIII и V и значительно ускоряет образование протромбиназы по внешнему и внутреннему механизму.
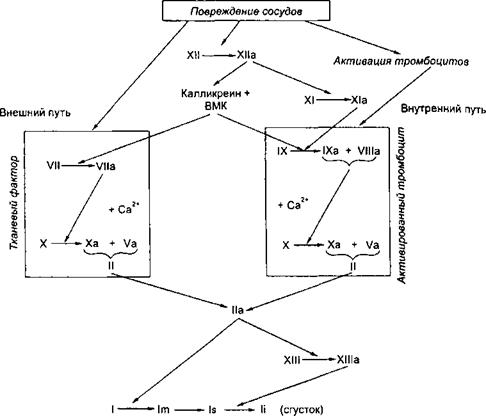
Рис. 5.2. Коагуляционный гемостаз.
Условные обозначения: стрелки — активация, ВМК — высокомолекулярный кининоген,! — фибриноген, Im — фибринмономер, Is — легко растворимый фибрин, Ii — труднорастворимый фибрин.
Инициатором внутреннего пути образования протромбиназы является фактор XII, который активируется травмированной поверхностью стенки сосуда, кожей, коллагеном, адреналином, после чего переводит фактор XI в Х1а. В этой реакции принимает участие калликреин (активируется фактором ХИа) и ВМК (активируется калликреином). Фактор Х1а оказывает непосредственное влияние на фактор IX, переводя его в фактор 1Ха. Специфическая деятельность последнего направлена на протеолиз фактора X (перевод его в фактор Ха) и протекает на поверхности фосфолипидов тромбоцита при обязательном участии фактора VIII (или Villa). Комплекс факторов IXa, Villa на фосфолипидной поверхности тромбоцитов называется теназным.
Благодаря прекалликреину и ВМК (как и фактору XII) объединяются внешний и внутренний пути свертывания крови.
Вторая фаза свертывания крови (переход фактора II в фактор Па) осуществляется под влиянием протромбиназы (комплекса Xa+Va) и сводится к протеолитическому расщеплению протромбина, благодаря чему появляется фермент тромбин, обладающий свертывающей активностью.
Третья стадия свертывания крови — переход фибриногена в фибрин — включает 3 этапа. На первом под влиянием фактора На от фибриногена отщепляются 2 фибринпептида А и 2 фибринпептида В, в результате чего образуются фибрин-мономеры (фактор Im). На втором этапе благодаря процессу полимеризации формируются вначале димеры и олигомеры фибрина, трансформирующиеся в дальнейшем в волокна фибрина — протофибриллы легкорастворимого фибрина, или фибрина s (soluble), быстро лизирующегося под влиянием протеаз (плазмин, трипсин). В процесс образования фибрина вмешивается фактор XIII (фибриназа, фибринстаби- лизирующий фактор), который после активации тромбином в присутствии Са2+ прошивает фибринполимеры дополнительными перекрестными связями, благодаря чему появляется труднорастворимый фибрин, или фибрин i (insoluble). В результате этой реакции сгусток становится резистентным к фибринолитическим (протеолитические) агентам и плохо поддается разрушению (рис. 5.2). Образовавшийся фибриновый сгусток благодаря тромбоцитам, входящим в его структуру, сокращается и уплотняется (ретракция) и прочно закупоривает поврежденный сосуд.
5.5.3. Естественные антикоагулянты
Несмотря на то что в циркуляции имеются все факторы, необходимые для образования тромба, в естественных условиях при наличии целости сосудов кровь остается жидкой. Это обусловлено наличием в кровотоке противосвертывающих веществ, получивших название естественных антикоагулянтов, и фибринолитического звена системы гемостаза.
Естественные антикоагулянты делят на первичные и вторичные. Первичные антикоагулянты всегда присутствуют в циркуляции; вторичные образуются в результате протеолитического расщепления факторов свертывания крови в процессе формирования и растворения фибринового сгустка.
Первичные антикоагулянты (табл. 5.8.) можно разделить на 3 группы:
• обладающие антитромбопластическим и антипротромбиназным действием (антитромбопластины);
• связывающие тромбин (антитромбины);
• предупреждающие переход фибриногена в фибрин (ингибиторы самосборки фибрина).
К антитромбопластинам относится ингибитор внешнего пути свертывания (TFPI). Установлено, что он способен блокировать комплекс факторов TF+VIIa+Xa, благодаря чему предотвращается образование протромбиназы по внешнему механизму.
К ингибиторам, блокирующим образование протромбиназы, относятся витамин-К-зависимые протеины С, S (РгС, PrS) и белок, синтезируемый эндотелием, — тромбомодулин. Под воздействием тромбомодулина и связанного с ним тромбина РгС переходит в активное состояние (РгСа), чему способствует кофактор PrS. РгСа разрезает пополам факторы Va и Villa и тем самым препятствует образованию протромбиназы по внутреннему пути и переходу протромбина в тромбин.
Одним из ведущих антикоагулянтов является белок антитромбин Ш (А-Ш). Самостоятельно A-III обладает слабым антикоагулянтным действием. В то же время он способен образовывать комплекс с гликозамингли- каном гепарином (Г) — А-П1+Г. Этот комплекс связывает факторы Па, 268
Таблица 5.8. Основные первичные естественные антикоагулянты
| Вещество
| Характерные признаки
|
| Антитромбин Ill
Гепарин
Кофактор гепарина II а2-Анти плазм ин
а2-Макроглобулин
а,-Антитрипсин
С1-эстеразный ингибитор или ингибитор комплемента I
TFP1
TFP12, или анексин V
Протеин С
Протеин S
Тромбомодулин
Ингибитор самосборки фибрина
«Плавающие» рецепторы
Аутоантитела к активным факторам свертывания
| а2-Глобулин. Синтезируется в печени. Прогрессивно действующий ингибитор тромбина, факторов Ха, IXa, Xia, ХПа, калликреина и в меньшей степени - плазмина и трипсина. Плазменный кофактор гепарина.
Сульфатированный полисахарид. Трансформирует антитромбин III из прогрессивного в антикоагулянт немедленного действия, значительно повышая его активность. Образует комплексы с тромбогенными белками и гормонами, обладающие антикоагулянтным и нсферментативным фибринолитическим действием
Антикоагулянт, действующий в присутствии гепарина
Белок. Ингибирует действие плазмина, трипсина, хемотрипсина, калликреина, фактора Ха, урокиназы
Слабый прогрессивный ингибитор тромбина, калликреина, плазмина и трипсина
Ингибитор тромбина, факторов IXa, Х1а, ХПа, трипсина и плазмина
а2-Нейроаминогликопротеид. Инактивирует калликреин, предотвращая его действие на кининоген, факторы ХПа, IXa, Xia и плазмин
Ингибирует комплекс TF+Vlla+Xa
Образуется в плаценте. Ингибирует комплекс TF+VIla+Xa Витамин-К-зависимый белок. Образуется в печени и в эндотелии. Обладает свойствами сериновой протеазы. Инактивирует факторы Va и Villa и стимулирует фибринолиз Витамин-К-зависимый белок. Образуется эндотелиальными клетками. Усиливает действие протеина С
Гликопротеин, фиксированный на цитоплазматической мембране эндотелия. Кофактор протеина С, связывается с фактором Па и инактивирует его
Полипептид, образуется в различных тканях. Действует на фибрин-мономер и фибрин-полимер
Гликопротеиды, связывают факторы Па и Ха, а возможно, и другие сериновые протеазы
Находятся в плазме, ингибируют факторы Па, Ха и др.
|
[Ха, Ха, Xia, XI 1а, калликреин и плазмин. Существует высокомолекуляр- чый гепарин с ММ от 25 до 35 кД и низкомолекулярный гепарин с ММ иенее 5 кД. Последний в меньшей степени нуждается во взаимодействии с X-III и нейтрализует преимущественно фактор Ха. Ингибитором свертывания является кофактор гепарина II, связывающий тромбин. Его действие эезко усиливается при взаимодействии с гепарином.
Ингибитором тромбина, факторов IXa, Xia, ХИа и плазмина является ^-антитрипсин. Слабым ингибитором тромбина, калликреина и плазмина служит а2-макроглобулин.
К первичным антикоагулянтам следует также отнести аутоантитела к активным факторам свертывания крови (Па, Ха и др.), которые всегда
присутствуют в кровотоке, а также покинувшие клетку рецепторы — так называемые плавающие рецепторы к активированным факторам свертывания крови.
К вторичным антикоагулянтам относят «отработанные» факторы свертывания крови (уже принявшие участие в свертывании) и продукты деградации фибриногена и фибрина (ПДФ), обладающие антиагрегационным и противосвертывающим действием, а также стимулирующие фибринолиз. Роль вторичных антикоагулянтов сводится к ограничению внутрисосудистого свертывания крови и распространения тромба по сосудам.
5.5.4. Фибринолиз
Фибринолиз является неотъемлемой частью системы гемостаза, всегда сопровождает процесс свертывания крови и активируется факторами ХПа, калликреином, ВМК и др. Являясь важной защитной реакцией, фибринолиз предотвращает закупорку кровеносных сосудов фибриновыми сгустками. Кроме того, фибринолиз ведет к реканализации сосудов после остановки кровотечения.
Ферментом, разрушающим фибрин, является плазмин, находящийся в циркуляции в неактивном состоянии в виде профермента плазминогена. Под воздействием его активаторов происходит расщепление пептидной связи ArgJ61—Val562 плазминогена, в результате чего образуется плазмин.
В кровотоке плазминоген встречается в двух основных формах — в виде профермента с N Нетерминальной глутаминовой кислотой — глу-плазми- ногена и в виде частично подвергшегося протеолизу лиз-плазминогена. Последний приблизительно в 20 раз быстрее трансформируется активаторами в плазмин и имеет большее сродство к фибрину.
Фибринолиз, как и процесс свертывания крови, может протекать по внешнему и внутреннему пути. Внешний путь активации фибринолиза осуществляется при участии тканевых активаторов, которые синтезируются в эндотелии сосудов. К ним относится тканевой активатор плазминогена (ТАП). Кроме того, активатором плазминогена является урокиназа, образуемая в почках, а также фибробластами и эндотелиоцитами.
Внутренний путь активации фибринолиза, осуществляемый плазменными активаторами, разделяется на Хагеман-зависимый и Хагеман-незави- симый. Хагеман-зависимый фибринолиз протекает под влиянием факторов ХПа, калликреина и ВМК, которые переводят плазминоген в плазмин. Хагеман-зависимый фибринолиз осуществляется наиболее быстро и носит срочный характер. Его основное назначение сводится к очищению сосудистого русла от нестабилизированного фибрина, образующегося в процессе внутрисосудистого свертывания крови. Хагеман-независимый фибринолиз может осуществляться под влиянием протеинов С и S.
Образовавшийся в результате активации плазмин вызывает расщепление фибрина. При этом появляются ранние (крупномолекулярные) и поздние (низкомолекулярные) продукты деградации фибрина — ПДФ (рис. 5.3).
В плазме находятся и ингибиторы фибринолиза. Важнейшим из них является ингибитор первого типа (PAI-1), который нередко называют эндотелиальным.
Ингибитором фибринолиза является а.2-аитиплазмин, связывающий не только плазмин, но и калликреин, урокиназу, ТАП и, следовательно, вмешивающийся как на ранних, так и на поздних стадиях фибринолиза. 270

Рис. 5.3. Фибринолиз
Условные обозначения ТАП — тканевый активатор плазминогена; ВМК — высокомолекулярный кининоген, ПДФ — продукты деградации фибриногена/фибрина
Сильным ингибитором плазмина служит аi-протеазный ингибитор (а,-ан- титрипсин). Кроме того, фибринолиз тормозится а2-макроглобулином и Сi-эстеразным ингибитором.
При ускорении свертывания крови и одновременном торможении фибринолиза создаются благоприятные условия для развития тромбозов, эмболий и ДВС-синдрома.
Наряду с ферментативным фибринолизом существует и неферментативный, который обусловлен комплексными соединениями естественного антикоагулянта гепарина с ферментами и гормонами. Неферментативный фибринолиз приводит к расщеплению нестабилизированного фибрина, очищая сосудистое русло от фибринмономеров и фибрина s.
5.5.5. Регуляция свертывания крови и фибринолиза
Свертывание крови, контактирующей со стеклом или кожей, осуществляется за 5—10 мин. Основное время в этом процессе уходит на образование протромбиназы, тогда как переход протромбина в тромбин и фибриногена в фибрин осуществляется быстро. Время свертывания крови может уменьшаться (гиперкоагуляция) или удлиняться (гипокоагуляция).
При острой кровопотере, гипоксии, интенсивной мышечной работе, болевом раздражении, стрессе свертывание крови значительно ускоряется, что может привести к появлению фибринмономеров и даже фибрина S в сосудистом русле.
Ускорение свертывания крови и усиление фибринолиза при всех перечисленных состояниях обусловлены повышением тонуса симпатической части автономной нервной системы и поступлением в кровоток адреналина и норадреналина При этом активируется фактор Хагемана (XII), что
приводит к запуску внешнего и внутреннего механизмов образования протромбиназы, а также стимуляции Хагеман-зависимого фибринолиза. Кроме того, под влиянием адреналина усиливается образование тканевого фактора и наблюдается отрыв от эндотелия фрагментов клеточных мембран, обладающих свойствами тромбопластина, что способствует резкому ускорению свертывания крови. Из эндотелия также выделяются ТАП и урокиназа, приводящие к стимуляции фибринолиза.
При повышении тонуса парасимпатической части автономной нервной системы также наблюдается ускорение свертывания крови и стимуляция фибринолиза. В этих условиях происходит выделение тромбопластина и активаторов плазминогена из эндотелия сердца и сосудов. Следовательно, основным эфферентным регулятором свертывания крови и фибринолиза является сосудистая стенка.
Вместе с тем развивающаяся гиперкоагуляция может смениться гипокоагуляцией, которая носит в естественных условиях вторичный характер и обусловлена расходом (потреблением) тромбоцитов и плазменных факторов свертывания крови, образованием вторичных антикоагулянтов, а также рефлекторным выделением в сосудистое русло гепарина и A-III в ответ на появление фактора Па.
При многих заболеваниях, сопровождающихся разрушением эритроцитов, лейкоцитов, тромбоцитов и тканей или гиперпродукцией тканевого фактора стимулированными эндотелиальными клетками, моноцитами и макрофагами, развивается ДВС-синдром. ДВС-синдром обнаружен более чем при 150 различных заболеваниях. Особенно часто он возникает при переливании несовместимой крови, обширных травмах, отморожениях, ожогах, длительных оперативных вмешательствах на легких, печени, сердце, предстательной железе, всех видах шока, краш-синдроме (длительное сдавление конечностей), инфекционных, воспалительных и онкологических заболеваниях, а также в акушерской практике при попадании в кровоток матери околоплодных вод, насыщенных тромбопластином плацентарного происхождения.
5.6. ИНСТРУМЕНТАЛЬНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ СИСТЕМЫ КРОВИ
Наиболее точными и менее трудоемкими методами исследования системы крови являются автоматические. Многие из применяемых в настоящее время автоматических счетчиков способны определять не только число клеток, но и другие гематологические показатели. Электронные счетчики могут анализировать значительное количество проб крови, сводя к минимуму технические ошибки. Наиболее часто для определения числа клеток крови используются кондуктометрические счетчики, принцип работы которых сводится к подсчету клеток путем пропускания их суспензии через отверстие малого диаметра (апертуру) и изменения электрического сопротивления, вызванного прохождением клеток. Для подсчета различных форменных элементов крови пользуются разными по размеру апертурами. Более того, при подсчете лейкоцитов и тромбоцитов необходимо предварительно лизировать эритроциты. Существуют более современные кондуктометрические счетчики, в которых подсчет эритроцитов и тромбоцитов проводится одновременно.
В последнее время получили распространение приборы, позволяющие одновременно анализировать до 18 параметров крови: число эритроцитов, 272 количество гемоглобина, гематокритное число, средний корпускулярный объем эритроцита, ширину распределений эритроцитов по объему, среднее содержание и среднюю концентрацию гемоглобина в эритроците, количество лейкоцитов, процент гранулоцитов, лимфоцитов и моноцитов, а также их абсолютное количество в 1 мм3, количество тромбоцитов в 1 мм3, средний объем тромбоцита, ширину распределения тромбоцита по объему и тромбокрит (доля объема цельной крови, занимаемой тромбоцитами). Дифференцированный подсчет перечисленных групп лейкоцитов основан на том, что специальный лизирующий реагент разрушает эритроциты и сжимает лейкоциты. Особенно сильно сжимается цитоплазма лимфоцитов, в меньшей степени гранулоцитов и еще в меньшей — моноцитов, что отражается на их сопротивлении и регистрируется счетчиком.
Используют автоматизированные счетчики лейкоцитарной формулы. Существует два типа автоматов:
• системы компьютерного анализа клеточного изображения;
• проточные системы, идентифицирующие различные формы лейкоцитов по размерам клетки и особенностям окрашивания. Однако они не способны полностью заменить визуального анализа мазка крови, ибо не существует аппаратов, способных надежно идентифицировать все незрелые или патологические клетки.
Современные методы определения концентрации гемоглобина основаны на способности этого протеина интенсивно окрашиваться. В качестве надежного способа измерения применяется цианметгемоглобиновый метод, в основе которого лежит переход всех известных соединений гемоглобина в устойчивое производное — циангемоглобин. Концентрация гемоглобин- цианида определяется на спектрофотометре при длине волны 540 нм и сравнивается с известным стандартом.
Определение различных органических ингредиентов плазмы производится или фотометрическим, или иммуноферментным методом, с использованием меченых антител или антигенов. Концентрация отдельных ингредиентов определяется по интенсивности окраски и сравнивается с имеющимся эталоном.
Состояние сосудисто-тромбоцитарного гемостаза оценивают по времени кровотечения при проколе пальца или мочки уха с регистрацией капли крови на фильтровальной бумаге. Для оценки сосудисто-тромбоцитарного гемостаза внедряют аппаратные методы. Чаще используют фильтрометр, в котором регистрируется скорость блокады микрофильтра агрегатами тромбоцитов при стандартизируемом пропускании через него исследуемой крови.
Исследование агрегации тромбоцитов осуществляют с помощью приборов агрегометров. Принцип их работы основан на фотометрической регистрации процесса агрегации по падению оптической плотности плазмы. Применяют различные типы агрегометров, соединенных для обработки полученных данных с компьютером, а для записи — с принтером. Существует стандартный набор агрегирующих агентов (АДФ, коллаген, адреналин, тромбин и другие), с помощью которых активируются тромбоциты и запускается процесс агрегации. В последние годы нашли применение агрегометры, основанные на кондуктометрических принципах склеивания тромбоцитов между собой и пригодные для исследования цельной крови.
Клетки многоклеточных организмов теряют непосредственный контакт с внешней средой и находятся в окружающей их жидкой среде — тканевой, или межклеточной, жидкости, откуда черпают необходимые вещества и куда выделяют продукты обмена.
Состав тканевой жидкости постоянно обновляется благодаря тому, что она находится в тесном контакте с непрерывно движущейся кровью Из крови в тканевую жидкость проникают кислород и другие необходимые клеткам вещества, в кровь, оттекающую от тканей, поступают продукты обмена клеток От тканей, помимо крови, оттекает лимфа, которая также уносит часть продуктов обмена веществ.
Кровь движется по кровеносным сосудам благодаря периодическим сокращениям сердца. Сердце и сосуды составляют систему кровообращения (рис 6.1).
Оттекающая от тканей венозная кровь поступает по полым венам в правое предсердие, а оттуда в правый желудочек сердца При сокращении его кровь нагнетается в легочную артерию Протекая через легкие, она отдает СО? и насыщается О2 Система легочных сосудов — легочные артерии, капилляры и вены — образует малый (легочный) круг кровообращения Обогащенная кислородом кровь из легких по легочным венам поступает в левое предсердие, а оттуда в левый желудочек При сокращении последнего кровь нагнетается в аорту и поступает в артерии, артериолы и капилляры всех органов и тканей, а оттуда по венам притекает в правое предсердие. Система этих сосудов образует большой круг кровообращения.
6.1. ДЕЯТЕЛЬНОСТЬ СЕРДЦА
6.1.1. Электрические явления в сердце, возникновение и проведение возбуждения
Сокращения сердца происходят вследствие периодически возникающих в нем процессов возбуждения Сердечная мышца (миокард) обладает рядом свойств, обеспечивающих ее непрерывную ритмическую деятельность, — автоматизмом, возбудимостью, проводимостью, сократимостью
Возбуждение в изолированном из организма сердце возникает периодически под влиянием процессов, протекающих в нем самом. Это явление получило название автоматизма Способностью к автоматизму обладают определенные участки миокарда, состоящие из специфической (атипическая) мышечной ткани, бедной миофибриллами, богатой саркоплазмой и напомина- -ющей эмбриональную мышечную ткань. Специфическая мускулатура образует в сердце проводящую систему, состоящую из синусно-предсердного (синоатриальный, СА) узла — внутрисердечного генератора ритма, расположенного в стенке предсердия у устьев полых вен и предсердно-желудочкового (атриовентрикулярный, АВ) узла, расположенного в межпредсердной перегородке на границе правого предсердия и желудочка. Предсердно-желудочковый узел переходит в тонкий ствол — предсердно-желудочковый пучок (атриовентрикулярный пучок, АВП), или пучок Гиса, который проходит между фиброз-
Рис. 6.2. Строение проводящей системы и хронотопография распространения возбуждения в сердце СА — синоатриальный узел, АВ — атриовентрикулярный узел, АВП — атриовентрикулярный пучок Цифры обозначают охват возбуждением отделов сердца (в секундах) от момента зарождения импульса в синоатриальном узле
ними кольцами предсердно-желудочковой перегородки и у верхнезаднего отдела мышечной части межжелудочковой перегородки делится на правую и левую ножки. В области верхушки сердца ножки предсердно-желудочкового пучка загибаются вверх и переходят в сеть сердечных проводящих миоцитов (волокна Пуркинье), погруженных в рабочий (сократительный) миокард желудочков (рис. 6.2).
6.1.1.1.  Электрическая активность клеток миокарда
Электрическая активность клеток миокарда
В естественных условиях клетки миокарда находятся в состоянии ритмической активности (возбуждения), поэтому об их потенциале покоя можно говорить лишь условно. У клеток сократительного миокарда он составляет около —90 мВ и определяется почти целиком концентрационным градиентом К+
Потенциалы действия (ПД), зарегистрированные в разных отделах сердца при помощи внутриклеточных микроэлектродов, существенно различаются по форме, амплитуде и длительности (рис 6.3, А). На рис
6.3, Ба схематически показан ПД одиночной клетки миокарда желудочка В ПД различают следующие фазы: деполяризации — фаза 0, быстрая начальная реполяризация — фаза 1; медленная реполяризация, так называемое плато, — фаза 2; быстрая конечная реполяризация — 3, фаза покоя — 4.
Фаза 0 в клетках миокарда предсердий, сердечных проводящих миоцитов (волокна Пуркинье) и миокарда желудочков имеет ту же природу, что и восходящая фаза ПД нервных и скелетных мышечных волокон — она обусловлена повышением натриевой проницаемости, т е. активацией быстрых натриевых каналов клеточной мембраны. Во время пика ПД в клетках миокарда желудочков происходит изменение знака мембранного потенциала (с —90 до +30 мВ).
Деполяриз ация мембраны в ызывает активацию медленных натрий-кальциевых каналов. Поток ионов Са2+ внутрь клетки по этим каналам приводит к развитию плато ПД {фаза 2). В пер иод плато натриевые каналы инактивируются и клетка находится в состоянии"абсолютной рефрактерности Вместе_с тем происходит активация калиевых каналов. Выходящий из клетки поток ионов К+ обеспечивает быструю реполяризацию мембра-
| Рис. 6.3. Различные типы потенциалов действия кардиомиоцитов, коррелированные с временным ходом ЭКГ
| |
А — конфигурация потенциалов действия кардиомиоцитов различных отделов сердца; СА — синоатриальный узел, П — предсердие; АВ — атриовентрикулярный узел; АВП — атриовентрикулярный пучок (пучок Гиса); ПП и ЛП — правая и левая ножки пучка, Ж — желудочки, 1—6 — потенциалы действия клеток миокарда; 7 — ЭКГ
Б — потенциал действия одиночного кардиомиоцита; а — ПД желудочка. Стрелками показаны преобладающие потоки Na4’, Са2+, К+, ответственные за различные фазы (0—4) ПД; б — авторитмическая активность синусно-предсердного (синоатриального) узла. Стрелками показана медленная диастолическая деполяризация.
ны (фаза 5), во время которой кальциевые каналы закрывают ся, что ускоряет процесс рёПилярй’Зйцйи;'поскольку падает"входящий кальциевый ток, деполяризующий мембрану.
В клетках рабочего миокарда предсердий и желудочков потенциал покоя (в интервалах между следующими друг за другом ПД) поддерживается на более или менее постоянном уровне. Однако в клетках синусно-предсердного узла, выполняющего роль внутрисердечного генератора ритма, наблюдается спонтанная диастолическая деполяризация (рис. 6.3, Eg), при достижении критического уровня которой (примерно —50 мВ) возникает новый ПД. На этом механизме основана авторитмическая активность указанных кардиомиоцитов.
Биоэлектрическая активность этих клеток имеет и другие важные особенности: 1) малую крутизну подъема ПД; 2) малую выраженность плато, плавно переходящую в фазу быстрой реполяризации, во время которой мембранный потенциал достигает уровня -60 мВ (вместо —90 мВ в рабочем миокарде), после чего вновь начинается фаза медленной диастолической деполяризации. Сходные черты имеет электрическая активность клеток предсердно-желудочкового узла, однако скорость спонтанной диастолической деполяризации у них значительно ниже, чем у клеток синусно-предсердного узла, соответственно рит







 Электрическая активность клеток миокарда
Электрическая активность клеток миокарда



