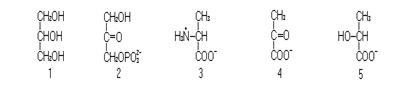Фенилаланин – незаменимая аминокислота с неполярным, незаряженным радикалом, частично кетогенная и частично гликогенная. Тирозин – условно заменимая аминокислота с полярным незаряженным радикалом, как и фенилаланин, частично гликогенная и частично кетогенная.
Основным источником фенилаланина являются пищевые белки, тогда как потребности в тирозине покрываются как за счет пищевых белков, так и за счет синтеза из фенилаланина. Ещё одним источником этих аминокислот являются эндогенные белки. Внутриклеточный протеолиз белков является основным

поставщиком фенилаланина и тирозина при голодании. При голодании протеолизу подвергаются наиболее массовые белки организма, такие как белки крови, печени и мышц. Образующиеся при протеолизе аминокислоты используются на ресинтез белков, без которых организм не может обойтись, для синтеза глюкозы и биологически активных соединений.
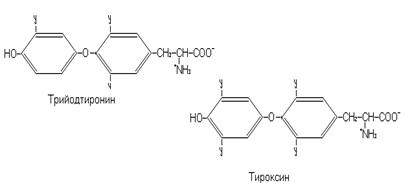
Фенилаланин и тирозин входят в состав многих белков организма. Тирозина особенно много в тиреоглобулине (115 остатков). Остатки тирозина в тиреоглобулине йодированы и представлены в виде моно-, ди -, три и тетрайодтирозина. Тиреоглобулин является предшественником тиреоидных гормонов, таких как трийодтиронин и тироксин. Остатки тирозина в белках могут фосфорилироваться и дефосфорилироваться, за счет чего обратимо может меняться их биологическая активность. В частности, рецептор инсулина обладает тирозинкиназной активностью и способен к аутофосфорилированию. В нормальных тканях взрослого индивида только 0,03% белков фосфорилировано по остаткам тирозина. Фосфорилирование по остаткам тирозина более значимо в эмбриональных и раковых тканях.
Обе аминокислоты используются во вторичных путях метаболизма. Из вторичных путей можно выделить синтез гормонов,
нейромедиаторов и пигментов. Тирозин участвует в синтезе

Рис. 41. Метаболизм фенилаланина и тирозина.
меланинов, животных пигментов предохраняющих организм от вредного действия ультрафиолетового излучения. Синтез меланинов начинается с реакции гидроксилирования тирозина медь содержащим ферментом тирозиназой. Генетический дефект этого фермента приводит к заболеванию называемому альбинизмом. При альбинизме нарушается синтез меланинов, поэтому кожные покровы и волосы имеют белый цвет, а радужка глаз красная из-за капилляров сетчатки, которые становятся видимыми. Отсутствие защиты от ультрафиолета может привести к ожогам кожи и сетчатки глаз. У больных альбинизмом высокая частота рака кожи, связанная с повреждающим действием ультрафиолета на геном клетки.
В щитовидной железе из остатков тирозина входящего в тиреоглобулин синтезируются гормоны трийодтиронин и тироксин. Эти гормоны влияют на утилизацию кислорода, на процессы развития и другие процессы.
Катаболизм фенилаланина и тирозина представлен на рисунке 42. Фумаровая кислота, образующаяся при катаболизме этих аминокислот окисляется в цикле Кребса через два с четвертью оборота, а ацетоуксусная кислота, взаимодействует с сукцинил-КоА образуя ацетоацетил-КоА и сукцинат. Ацетоацетил-КоА взаимодействует с молекулой КоА, образуя две молекулы ацетил-КоА, которые для дальнейшего окисления поступают в цикл Кребса. Биоэнергетика окисления фенилаланина, с учетом затрат на нейтрализацию аммиака в орнитиновом цикле, составит 38,5 молекул АТФ, а для тирозина – 40,5.
Из фенилаланина и тирозина синтезируются катехоламины. Синтез осуществляется в нейронах и в мозговом слое надпочечников.
Адреналин надпочечников выполняет функцию гормона, а образованный в нейронах норадреналин – нейромедиатора. Адреналин усиливает липолиз в адипоцитах и гликогенолиз в мышцах и гепатоцитах, в гепатоцитах усиливается и глюконеогенез. Норадреналин и дофамин могут играть роль, как тормозного, так и возбуждающего нейромедиатора.
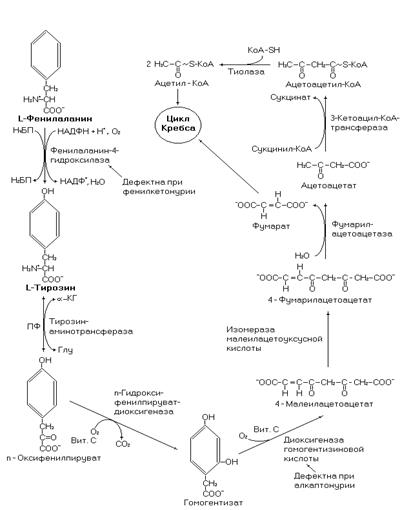
Рис. 42. Катаболизм фенилаланина и тирозина.
Превращение фенилаланина в тирозин нарушается при наследственном заболевании фенилкетонурии. При этой патологии дефектен фермент фенилаланин-4-гидроксилаза, поэтому

Рис. 43. Синтез катехоламинов.
фенилаланин вступает на путь образования фенилуксусной, фенилпировиноградной, фенилмолочной кислот. Эти соединения образуются и в норме, но в гораздо меньших количествах. Их накопление вызывает развитие умственной отсталости. Поэтому лечение возможно с помощью диеты с низким содержанием фенилаланина. В период лечения необходим лабораторный контроль, за уровнем кетоновых тел в крови.
Другой наследственной патологией катаболизма фенилаланина является алкаптонурия. Эта патология вызвана мутацией в гене, кодирующем структуру оксидазы гомогентизиновой кислоты. Моча таких больных темнеет при стоянии на свету. Однако в отличие от фенилкетонурии серьезных нарушений здоровья носителя дефектного гена не происходит.
Задания к разделу «Обмен фенилаланина и тирозина»
Задание 1
Назовите наследственные патологии, связанные с дефектами ферментов тирозиназы, гомогентиназы и фенилаланин-4-гидроксилазы. Напишите реакции, катализируемые этими ферментами.
Задание 2
В катаболизме фенилаланина образуется ацетоацетат. Получите из ацетоацетата два других кетоновых тела. Объясните роль кетоновых тел в организме.
Задание 3
Напишите реакции синтеза адреналина из тирозина. Объясните роль катехоламинов в организме.
Задание 4
Используя известные метаболические пути, получите глюкозу из фумарата, подсчитайте биоэнергетику процесса.
Обмен лизина
Лизин – диаминомонокарбоновая аминокислота с положительно заряженным радикалом, кетогенная, незаменимая.
 L-Лизин
L-Лизин
Наряду с аргинином лизин в значительных количествах присутствует в составе ядерных белков гистонов, определяя их положительный заряд. Участвует в формировании и функционировании активных центров некоторых ферментов.
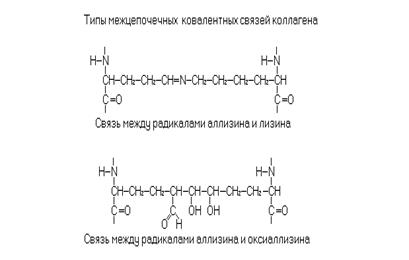
В коллагенах остатки лизина могут гидроксилироваться лизиноксидазой с участием витамина C или окисляться до аллизина (вместо аминогруппы в радикале образуется альдегидная группа) или оксиалллизина. Аллизин и оксиаллизин участвуют в образовании поперечных ковалентных сшивок между отдельными молекулами тропоколлагена, что необходимо для формирования коллагеновых фибрилл. Некоторые остатки лизина в белках метилированы.
Катаболизм аминокислоты протекает по сложной схеме, поэтому не будет подробно рассматриваться. Однако следует отметить, что в катаболизме этой аминокислоты не участвуют трансаминазы.
С обменом лизина связаны два редких генетических заболевания, предположительно связанных с дефектами ферментов катаболизма лизина: 1 – периодическая гиперлизинемия, 2 – стойкая гиперлизинемия. При первом заболевании в организме повышено содержание не только лизина, но и аммиака. Высокое
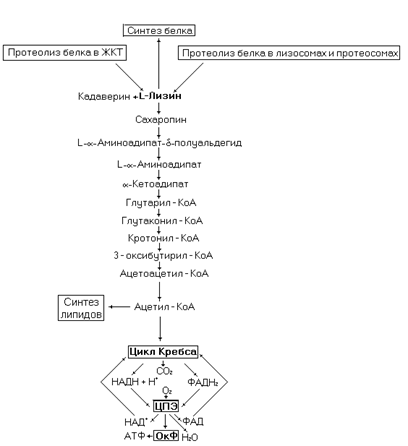
Рис. 44. Метаболические превращения лизина.
содержание аммиака вызвано ингибирующим влиянием высоких концентраций лизина на фермент аргиназу. Вследствие этого нарушена утилизация аммиака в орнитиновом цикле. Нагрузка лизином у таких больных может вызвать кому и смерть.
При второй форме заболевания содержание лизина в крови постоянно повышенное, содержание аммиака в норме. У некоторых больных отмечается умственная отсталость.
Задания к разделу «Обмен лизина»
Задание 1
Получите b-гидроксибутират из ацетоацетил-КоА в 3 реакции. Подсчитайте биоэнергетику процесса.
Задание 2
Напишите реакцию образования кадаверина из лизина. Охарактеризуйте полученное соединение.
Задание 3
Напишите реакцию гидроксилирования остатка лизина в проколлагене. Объясните роль гидроксилизиновых остатков в белках. Назовите другие химические модификации радикала лизина в белках.
Задание 4
Назовите генетическое заболевание, связанное с нарушением обмена лизина, при котором в крови повышено содержание лизина и аммиака. Какое отношение имеет лизин к накоплению в организме аммиака.
Задание 5
Получите миристиновую кислоту из ацетил-КоА. Подсчитайте биоэнергетику процесса.
Обмен лейцина
Лейцин – кетогенная, незаменимая аминокислота с гидрофобным радикалом.
 L –Лейцин
L –Лейцин
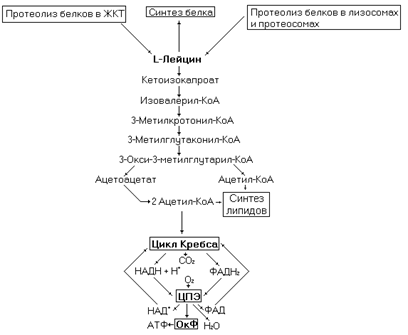
Рис. 45. Метаболизм лейцина.
Радикал лейцина наряду с другими гидрофобными радикалами принимает участие в формировании третичной структуры белка за счет гидрофобных взаимодействий. Радикалы лейцина участвуют в образовании контактной площадки активного центра ряда ферментов (наряду с радикалами других аминокислот), а, следовательно, в связывании и пространственной ориентации молекулы субстрата.
Высокое содержание гидрофобных радикалов делает молекулу белка нерастворимой в воде. Много аминокислот с гидрофобными радикалами (в том числе и лейцина) в мембранных белках.
Лейцин чисто кетогенная аминокислота (при её катаболизме образуется ацетоацетат и ацетил-КоА). Хотя лейцин относят к незаменимым аминокислотам, её синтез возможен при поступлении с пищей в организм a-кетоизокапроновой кислоты. Это соединение образуется при трансаминировании лейцина с a-кетоглутаратом, а поскольку трансаминазная реакция обратима, то существует возможность синтеза аминокислоты обращением реакции.
Углеродный скелет лейцина легко вступает в липидный обмен как через ацетоацетат, так и через ацетил-КоА. Ацетоацетат может гидрироваться до b- гидроксибутирата, декарбоксилироваться до ацетона или метаболизировать до двух молекул ацетил-КоА. Ацетил-КоА вступает в синтез жирных кислот, холестерина и производных этих соединений.
Биоэнергетика окисления молекулы лейцина составит 29 молекул АТФ (с учетом затрат на нейтрализацию аммиака в орнитиновом цикле).
К патологии обмена лейцина можно отнести болезнь «кленового сиропа». При этой наследственной болезни нарушено окислительное декарбоксилирование кетокислот с разветвленной цепью. В крови накапливаются валин, лейцин, изолейцин и кетопроизводные этих аминокислот. Моча больных приобретает характерный запах кленового сиропа или жженого сахара. Заболевание заканчивается смертью в возрасте до 1 года.
Катаболизм лейцина протекает следующим образом.

Рис. 46. Катаболизм лейцина.
Задания к разделу «Обмен лейцина»
Задание 1
Проведите реакцию трансаминирования лейцина с a- кетоглутаровой кислотой. Полученную в реакции аминокислоту запустите в орнитиновый цикл.
Задание 2
Докажите, что лейцин является кетогенной аминокислотой.
Задание 3
Окислите лейцин до конечных продуктов его катаболизма и подсчитайте биоэнергетику процессов.
Обмен валина
Валин – незаменимая, гликогенная аминокислота с гидрофобным радикалом.
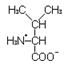 L-Валин
L-Валин
Как и лейцин, валин незаменимая аминокислота, однако, может быть синтезирована из a-кетоизовалерата при поступлении его с пищей. Синтез осуществляется за счет обращения трансаминазной реакции.
В белках валин участвует в формировании третичной структуры (за счет гидрофобных взаимодействий). Основной источник валина для организма – пища.
Катаболизм аминокислоты осуществляется через стадию образования сукцинил-КоА, реакции, в которой участвует аденозилкобаламин, производное витамина В12. При недостатке в организме витамина В12 развивается метилмалонатная ацидурия,
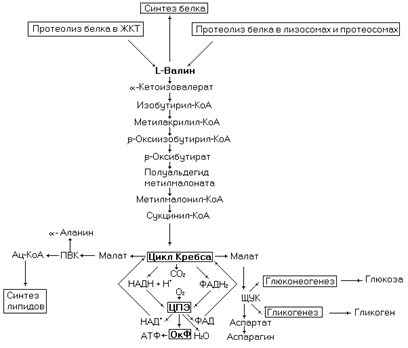
Рис. 47. Метаболические превращения валина.
характеризующаяся высоким содержанием метилмалоновой кислоты в моче. При наследственном заболевании, связанном с низкой активностью трансаминазы валина, развивается гипервалинемия.
Другим наследственным нарушением обмена валина является болезнь «кленового сиропа», описанная выше для лейцина.
Биоэнергетика окисления молекулы валина – 30 молекул АТФ (с учетом затрат на нейтрализацию аммиака в орнитиновом цикле).
Катаболизм валина осуществляется в реакциях отображенных на рисунке 48.
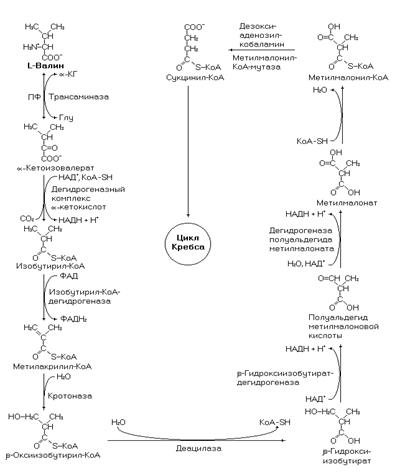
Рис. 48. Катаболизм валина.
Задания к разделу «Обмен валина»
Задание 1
Напишите реакции катаболизма валина до промежуточного продукта цикла Кребса, назовите коферменты, участвующие в катаболизме валина. Биоэнергетика процесса.
Задание 2
Какое соединение обмена валина будет накапливаться в организме при недостаточности витамина B6.
Задание 3
Напишите реакции катаболизма валина до конечных продуктов его обмена. Подсчитайте биоэнергетику процесса.
Задание 4
Напишите реакцию образования валина из a-кетоизовалерата.
Обмен изолейцина
Изолейцин – незаменимая, гликогенная аминокислота с гидрофобным радикалом.
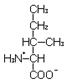 L-Изолейцин
L-Изолейцин
Изолейцин поступает в организм с пищей, образуется в процессе протеолиза эндогенных белков, синтезируется из пищевого a-кето-b-метилвалерата. Данная аминокислота входит в состав многих белков, где за счет гидрофобных взаимодействий участвует в формировании их третичной структуры. Наличие в полипептидной цепи радикала изолейцина препятствует образованию витка a-спирали (вследствие массивности радикала) в этом участке.
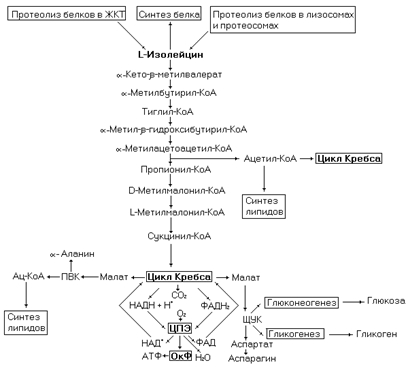
Рис. 49. Метаболические превращения изолейцина.
Катаболизм аминокислоты осуществляется в последовательности реакций отображенных на рисунке 50.
Необходимо отметить, что первая реакция катаболизма изолейцина может катализироваться и другими трансаминазами. Биоэнергетика окисления изолейцина составляет 36,5 моль АТФ на 1 моль окисленного субстрата (с учетом затрат на нейтрализацию аммиака в орнитиновом цикле)
.

Рис. 50. Катаболизм изолейцина.
Сукцинил-КоА легко преобразуется до малата (через реакции цикла Кребса). Малат выводится из митохондрий дикарбоксилатной транспортной системой в цитозоль, где участвует в анаболических реакциях (гликогенез, глюконеогенез, синтез аминокислот). Другой промежуточный продукт катаболизма изолейцина – ацетил-КоА может участвовать в синтезе липидов.
Катаболизм изолейцина нарушается при недостаточности в организме витамина В12, вследствие чего развивается метилмалонатная ацидурия.
Другим нарушением метаболизма этой аминокислоты является болезнь «кленового сиропа» описанная выше.
Задания к разделу «Обмен изолейцина»
Задание 1
Напишите реакции обмена изолейцина с участием ферментов изомераз.
Задание 2
Напишите реакции катаболизма изолейцина до конечных продуктов обмена. Подсчитайте биоэнергетику процесса.
Задание 3
Напишите реакцию катализируемую метилмалонил-КоА-мутазой. Какое нарушение возникает при блоке этой реакции.
Задание 4
Используя известные метаболические пути, получите глюкозу из сукцинил-КоА. Подсчитайте биоэнергетику процесса.
Обмен триптофана
Триптофан – незаменимая аминокислота, кетогенная и гликогенная одновременно, относится к группе аминокислот с гидрофобным радикалом.
 L-Триптофан
L-Триптофан
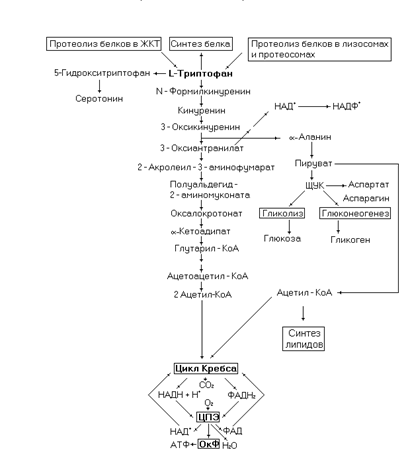
Рис. 51. Метаболические превращения триптофана.
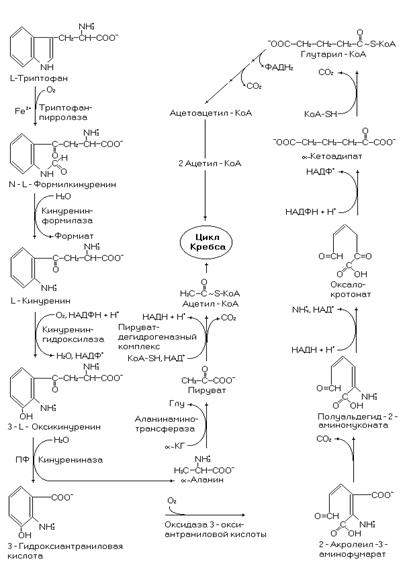
Рис. 52. Катаболизм триптофана.
На рисунке 52 не все ферменты и реакции обозначены, однако даже представленного материала достаточно, чтобы понять сложность процесса.
В катаболизме триптофана образуется a-аланин, из которого, через ряд реакций, синтезируются углеводы. Поэтому эта аминокислота частично гликогенная. Другой продукт деградации триптофана – ацетоацетил-КоА делает её частично кетогенной и выводит на пути синтеза липидов. При недостаточном поступлении с пищей никотиновой кислоты и её амида триптофан может использоваться для синтеза пиридиновых нуклеотидов (НАД+ и НАДФ+).
Триптофан поступает в организм с пищевыми белками, образуется при эндогенном протеолизе белков. Участвует в синтезе белков, но присутствует в них в малых количествах. В головном мозге триптофан используется для синтеза серотонина выполняющего функцию нейромедиатора. При недостаточном поступлении в организм витамина PP (необходим для синтеза коферментов НАД+ и НАДФ+) молекула триптофана используется в синтезе коферментов. Однако, вследствие низкого содержания этой аминокислоты в белках этот синтез ограничен.
Болезнь Хартнупа – наследственное заболевание, связанное с недостаточностью одного из ферментов катаболизма триптофана. Характерными симптомами являются: сыпь на коже, перемежающаяся мозжечковая атаксия и умственная отсталость. В моче больных повышено содержание триптофана и a-N-индол-3-ацетилглутамина.
Задания к разделу «Обмен триптофана»
Задание 1
Напишите реакции синтеза серотонина в головном мозгу. Опишите физиологическую роль полученного соединения.
Задание 2
В процессе катаболизма триптофана образуется соединение, участвующее в гликогенезе. Напишите реакции синтеза гликогена из промежуточного продукта катаболизма триптофана. Подсчитайте биоэнергетику процесса.
Задание 3
Напишите структуры токсических соединений образующихся из триптофана в толстом кишечнике. Опишите дальнейшие превращения этих соединений в организме.
Задание 4
В организме человека (из триптофана) синтезируются два кофермента участвующие в оксидоредуктазных реакциях. Напишите структуры этих коферментов, объясните их роль в метаболизме.
Задания по интеграции катаболизма простых белков и обмена аминокислот и связей с обменами других соединений
Задание 1
В процессе окисления жирных кислот с нечетным числом углеродных атомов образуется метаболит, чьи углеродные атомы могут полностью сформировать углеродный скелет нескольких аминокислот.
1. Напишите реакции синтеза этих аминокислот из промежуточного метаболита окисления жирных кислот с нечетным числом углеродных атомов.
2. Назовите источники аминогрупп необходимых для этих синтезов.
Задание 2
В реакциях липолиза триацилглицеролов и глицерофосфолипидов образуется продукт, углеродные атомы которого могут полностью сформировать углеродный скелет a-аланина, серина, цистеина и глицина.
1. Получите a-аланин из продукта гидролиза триацилглицеролов.
2. Получите серин из продукта гидролиза глицерофосфолипидов.
3. Получите глицин из двух продуктов гидролиза фосфатидилсерина.
4. Получите цистеин из продукта гидролиза триацилглицерола.
Задание 3
Заменимые аминокислоты могут синтезироваться из продукта образующегося в гликолизе, докажите это утверждение, синтезируйте глицин.
Задание 4
Метаболизируйте аспарагин до оксалоацетата, а из него получите рибозо-5-фосфат. Назовите метаболические пути, участвующие в этих превращениях. Подсчитайте биоэнергетику процессов.
Задание 5
В процессах катаболизма нуклеиновых кислот и нуклеотидов образуется аммиак.
1. Напишите реакцию образования аммиака из адениловой кислоты.
2. Используя известные метаболические пути, включите азот аммиака в обе аминогруппы аспарагина.
Задание 6
Напишите реакцию гидролитического дезаминирования гуанина. Полученный в реакции аммиак введите в состав аминогруппы радикала глутамина, а затем выведите этот аммиак из организма в составе солянокислого аммония.
Задание 7
Напишите реакцию гидролитического дезаминирования аденина, полученный в реакции аммиак введите в орнитиновый цикл и синтезируйте мочевину.
Задание 8
Две протеиногенных аминокислоты поступают в цикл Кребса в виде двух продуктов (каждая).
1. Назовите эти аминокислоты.
2. Объясните, почему эти аминокислоты являются одновременно и гликогенными и кетогенными.
3. Используйте кетогенный продукт их катаболизма в синтезе b-гидроксибутирата.
Задание 9
Ряд протеиногенных аминокислот используется в реакциях вторичных метаболических путей. В числе таких реакций образование биогенных аминов.
1. Напишите реакцию образования гистамина.
2. Напишите реакцию образования b-аланина.
3. Получите 5-гидрокситриптофан, а далее нейромедиатор ЦНС.
Задание 10
Катаболизм нескольких аминокислот идет с образованием другой аминокислоты, как промежуточного продукта.
1. Назовите такие аминокислоты.
2. Напишите схемы образования одной аминокислоты из другой.
Задание 11
Напишите схему синтеза заменимых аминокислот с глутаминовой кислотой в центре.
Задание 12
В метаболическом пути синтеза пуринов образуется инозиновая кислота, в превращении которой в АМФ и ГМФ участвуют две аминокислоты. Напишите реакции аминирования пуринов с участием этих аминокислот.
Задание 13
Остатки аминокислот в белках могут химически модифицироваться. Бывают обратимые модификации, которые необходимы для изменения активности белка. Модификации другого типа необратимы, используются в процессе созревания белка. Оба типа модификаций контролируемы и происходят с участием ферментов. Однако есть другой тип модификаций без участия ферментов.
1. Напишите реакцию фосфорилирования и дефосфорилирования остатка серина в белке, объясните значение этих реакций для ферментативной активности гликогенсинтетазы.
2. Напишите реакции гидроксилирования радикалов лизина и пролина. Объясните роль этих реакций в процессе созревания коллагена.
3. Напишите реакцию неферментативного гликозилирования белка. Объясните роль этой реакции в развитии патологических процессов.
Задание 14
Избирательный протеолиз является этапом в процессе созревания ряда белков.
1. Назовите белки, избирательный протеолиз которых осуществляется в полостях организма. Объясните, почему протеолиз этих белков не происходит в клетках.
2. Назовите места внутриклеточного избирательного протеолиза.
3. Как регулируется активность протеаз?
Задание 15
Назовите сроки жизни различных белков организма. Объясните, почему необходимо обновление белков. Что является сигналом для деградации того или иного белка?
Задание 16
Реакция взаимодействия галогенов с бензолом одна из классических реакций органической химии. Назовите белок и галоген, в котором ряд аминокислотных остатков находится в моно-, ди-, три- и тетра- галоген замещенном состоянии. Для каких целей и как используются эти галоген замещенные остатки?
Задание 17
Сахарный диабет характеризуется усилением глюконеогенеза из аминокислот. Парадокс ситуации заключается в том, что при этом заболевании нарушено всасывание глюкозы в клетки жировой и мышечной тканей (основные по массе в организме), вследствие чего содержание глюкозы в крови повышено (гипергликемия), а организм дополнительно производит глюкозу, расходуя на это дефицитные аминокислоты и энергию. Почему при сахарном диабете возрастает скорость глюконеогенеза из аминокислот?
Задание 18
Витамины, по определению, необходимые для жизнедеятельности организма соединения, не синтезирующиеся в организме, должны поступать с пищей. В большинстве своем они используются на синтез коферментов. Объясните, почему к витаминам относят витамин РР, если синтез коферментов образующихся из него, возможен из триптофана.
Задание 19
Вспомнив известные вам метаболические пути, докажите принципиальную возможность синтеза глутаминовой кислоты, используя атомы только a-аланина.
Задание 20
Обмены различных классов соединений связаны между собой и зависят друг от друга. При сахарном диабете, в первую очередь нарушаются обмен углеводов и липидов. Постройте причинно следственную цепочку, объясняющую снижение скорости синтеза белков участвующих в иммунном ответе при этом заболевании.
Задание 21
Энергия в организме выделяется и запасается, главным образом, при окислении углеводов и липидов. Эти соединения могут откладываться про запас и использоваться по мере надобности. Почему белки не откладываются про запас, а используются на энергетические нужды (белки мышц, печени и крови) либо при истощении запасов углеводов, либо при избыточном поступлении с пищей? Вариант – при патологии.
Задание 22
Глутатион – биологически активный трипептид (g-глутамил-цистеинил-глицин). Докажите теоретическую возможность того, чтобы все углеродные атомы этого соединения были из глюкозы.
Задание 23
Триацилглицеролы могут быть синтезированы только из углеродных атомов аминокислот. Докажите возможность такого синтеза из тирозина. Напишите схему этого синтеза.
Задание 24
Докажите принципиальную возможность синтеза предшественника гема – протопорфирина 9 типа, используя углеродные атомы валина и глицина.
Задание 25
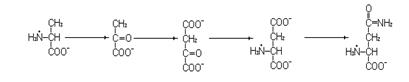
1. Назовите соединения.
2. Напишите реакции последовательного превращения этих соединений, обозначив ферменты, коферменты и дополнительные соединения, участвующие в этих превращениях.
3. Напишите реакции превращения этих веществ в обратной последовательности.
Задание 26

Два соединения, представленных в задании, в процессе своего метаболизма образуют общий метаболит.
1. Назовите соединения.
2. Напишите метаболические пути превращения этих соединений в общий метаболит.
Задание 27
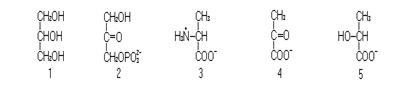
На рисунке представлены соединения, принадлежащие различным классам. Каждое из соединений может быть получено из других.
1. Назовите соединения.
2. Напишите реакции получения соединения 3 из других соединений, назовите ферменты и коферменты реакций.
Задание 28

Три структуры, приведенные в задании, объединяет общая реакция. Однако для осуществления этой реакции необходимы дополнительные компоненты, не приведенные на рисунке. Напишите эту реакцию.
Задание 29
Реабсорбция аминокислот из первичного ультрафильтрата осуществляется в проксимальном отделе нефрона. При нарушении всасывания одной из аминокислот может возникнуть мочекаменная болезнь.
1. Назовите эту аминокислоту.
2. Почему эта аминокислота формирует камни в мочевыводящих путях?
Задание 30
В метаболизме аминокислот участвуют коферментные формы витаминов, в том числе, в катаболизме a-аланина.
1. Почему при недостаточности одного из водорастворимых витаминов (коферментная форма участвует в катаболизме a-аланина) развивается ацидоз.
2. Назовите витамин, кофермент и соединение которым обусловлен ацидоз.
Задание 31
Три соединения: глюкоза, изолейцин и капроновая кислота содержат одинаковое число углеродных атомов. Однако при полном окислении этих соединений запасается различное количество АТФ.
1. Определите количество АТФ запасаемое при окислении каждого из соединений.
2. Какие из предложенных соединений и в какой форме могут откладываться про запас. Какая запасная форма топлива наиболее выгодна и почему?
Задание 32
Одним из направлений использования аминокислот является их участие в синтезе нейромедиаторов. В головном мозге образуется g-аминомасляная кислота. Образование, распад и ресинтез этого соединения осуществляется с использованием реакций двух метаболических путей.
1. Напишите реакции синтеза g-аминомасляной кислоты (ГАМК) и её дальнейшего метаболизма.
2. Опишите механизм действия ГАМК на постсинаптическую мембрану.
3. Назовите метаболические пути, в которых осуществляется синтез, распад и ресинтез ГАМК.
Задание 33
Существует несколько типов реакций дезаминирования аминокислот.
1. Напишите реакцию, катализируемую гистидазой, определите тип дезаминирования.
2. Напишите реакцию, катализируемую глутаминазой, определите тип дезаминирования.
3. Напишите реакцию, катализируемую оксидазой L-аминокислот, определите тип дезаминирования.
4. Напишите реакцию, катализируемую глутаматдегидрогеназой, определите тип дезаминирования.
Задание 34
Две наследственные патологии обмена аминокислот дают положительную реакцию мочи новорожденных с хлоридом железа.
1. Назовите эти патологии и опишите их.
2. Как можно отдифференцировать эти заболевания?
Задание 35
Орнитин – диаминомонокарбоновая кислота не участвующая в биосинтезе белка. Эта аминокислота активно участвует в обезвреживании аммиака, образуется в двух метаболических путях.
1. Назовите метаболические пути, в которых образуется орнитин.
2. Напишите реакции, в которых идет образование орнитина.
3. Напишите реакции катаболизма орнитина до конечных продуктов. Подсчитайте биоэнергетику процесса.
Задание 36
Мышечное сокращение поддерживается энергией гидролиза АТФ, однако, интенсивная мышечная работа быстро истощает запасы этого соединения.
1. Какое макроэргическое соединение мышц участвует в рефосфорилировании АДФ до АТФ?
2. Напишите реакции синтеза этого макроэрга из аминокислот.
3. Напишите структуру конечного продукта деградации мышечного макроэрга. О чем свидетельствует высокое содержание в моче конечного продукта катаболизма мышечного макроэрга?
Задание 37
Человек съел на обед половину курицы (0,5 кг), лаваш (0,3 кг) и выпил 2 стакана сладкого чая.
а) Где и в каких структурах организма окажутся элементы пищи через 7 часов после её приема.
1.Опишите процесс пищеварения обеда в ЖКТ.
2. Напишите схему последовательного превращения белков пищи в организме.
Задание 38
Дезаминирование аминокислот и нуклеотидов в клетках приводит к образованию аммиака. Аммиак легко диффундирует через клеточную мембрану. Однако при взаимодействии аммиака с протоном образуется ион аммония, для которого мембрана является барьером.
1. Напишите реакцию дезаминирования гистидина.
2. Напишите реакцию образования иона аммония.
3. Опишите патологические изменения клеточного метаболизма при накоплении ионов аммония.
4. Напишите любую известную вам реакцию временного обезвреживания иона аммония.
Задание 39

1. Дополните приведенные схемы названиями ферментов и коферментов участвующих в этих превращениях.
2. Объедините две схемы в одну, дополнив её пропущенными реакциями.
Задание 40
Молочная кислота (лактат) образуется в процессе анаэробного гликолиза из глюкозы. Образование лактата – метаболический тупик. Однако лактат может быть вовлечен в дальнейший метаболизм через обращение реакции его образования.
1. Используйте углеродные атомы лактата для синтеза аспарагина. Напишите этот синтез. Все углеродные атомы аспарагина должны принадлежать лактату.
2. Получите из лактата a-аланин.
Задание 41
В процессе катаболизма нуклеиновых кислот образуется рибозо-5-фосфат.
1. Назовите метаболические пути, с помощью которых углеродные атомы рибозо-5-фосфата могут быть вовлечены в синтез заменимых аминокислот.
2. Какие аминокислоты могут быть синтезированы из углеродных атомов рибозо-5-фосфата? Напишите реакции синтеза одной из таких аминокислот.
Задание 42
Одна из протеиногенных аминокислот участвует в синтезе биологически активного соединения неорганической природы. Это соединение расслабляет гладкую мускулатуру, регулирует апоптоз, участвует в регуляции других биологических функций.
1. Назовите аминокислоту и неорганическое соединение, образующееся из неё. Напишите реакцию образования этого соединения.
2. Назовите биологические функции, в регуляции которых участвует это неорганическое соединение.
Задание 43
Углеродные скелеты гликогенных аминокислот могут участвовать не только в синтезе углеводов, но в определенной ситуации вовлекаться в синтез жирных кислот. Докажите это. Синтезируйте пальмитиновую кислоту из тирозина. Подсказка – в синтезе будет участвовать малатдегидрогеназа декарбоксилирующая (малик-фермент).
Задание 44
В биосинтезе белка участвуют a-L-аминокислоты. Однако в процессе старения белков может осуществляться превращение L-изомеров некоторых аминокислот в D-изомеры (рацемизация). Назовите белок организма, по содержанию в котором D-формы аминокислоты можно определить возраст человека. Как это сделать?
Задание 45
Белок молока казеиноген относится к фосфопротеидам. Радикалы, каких аминокислот фосфорилированы в этом белке? Напишите схему включения компонентов этого белка в структуры организма новорожденного.
Задание 46

На рисунке к заданию изображены структуры двух соединений, принадлежащих одному метаболическому пути. Одно из веществ конечный продукт катаболизма протеиногенной аминокислоты.
1. Напишите реакцию, объединяющую эти соединения.
2. Окислите одно из веществ до конечных продуктов по альтернативному пути. Подсчитайте биоэнергетику процесса.
Задание 47








 L-Лизин
L-Лизин

 L –Лейцин
L –Лейцин

 L-Валин
L-Валин

 L-Изолейцин
L-Изолейцин

 L-Триптофан
L-Триптофан