Также как и одноатомные спирты, гликоли могут иметь первичные, вторичные и третичные гидроксилы и все, что было сказано о свойствах одноатомных спиртов, относится и к соответствующим гликолям.
v Дегидратация гликолей. Аналогично спиртам диолы способны подвергаться дегидратации в зависимости от их строения и условий проведения реакций.
· Внутримолекулярная дегидратация до сопряженных диенов. Этот тип реакции легко реализуется для гликолей с гидроксильными группами у третичных и вторичных атомов углерода.

Более эффективно дегидратация идет на оксиде алюминия. Выход составляет от 70 до 85%.
При нагревании этиленгликоля с хлоридом цинка происходит дегидратация с образованием ацетальдегида.
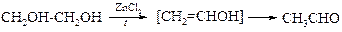
· Внутримолекулярнаядегидратация, сопровождаемая пинаколиновой перегруппировкой. При действии минеральных кислот 2,3-диметилбутандиол-2,3 (пинакон) претерпевает пинаколиновую перегруппировку и превращается в метил- трет -бутилкетон (пинаколин).
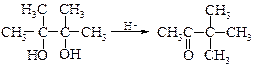
пинакон пинаколин
Предполагается, что пинаколиновая перегруппировка включает две важные стадии. Сначала происходит отщепление воды от протонированного гликоля с образованием карбкатиона (1), а затем протекает перегруппировка карбкатиона с 1,2-метильным сдвигом с образованием протонированного кетона (2).
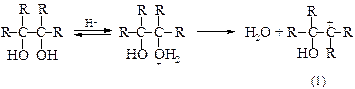

Как и в большинстве случаев 1,2-сдвигов к электронодефицитным атомам углерода, мигрирующая группа ни в какой момент не бывает совершенно «свободной»: она до тех пор не отрывается от «покидаемого» ею атома углерода, пока не образует связи с электронодефицитным центром (3).
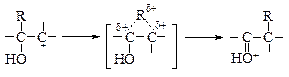 (3)
(3)
· Дегидратация с образованием циклических эфиров и эпоксидов. Этиленгликоль и ряд других 1,2-гликолей способны при нагревании с концентрированной серной кислотой или 80%-ной фосфорной кислотой превращаться в 1,4-диоксаны.
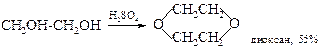
1,4-Диолы и 1,5-диолы превращаются в присутствии каталитических количеств минеральных кислот в тетрагидрофуран и тетрагидропиран. Эти реакции впервые были реализованы А. Фаворским.
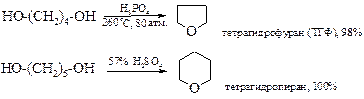
В последние годы ТГФ предпочитают получать гидрированием фурана при 80-140°С, а катализаторами служат никель и осьмий или палладий.
· Межмолекулярная дегидратация позволяет получить линейные олигомерные эфиры. Как правило, получается смесь эфиров.
7 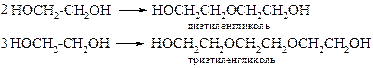
Однако в промышленности ди- и триэтиленгликоль получаются в качестве побочного продукта при синтезе этиленгликоля из оксида этилена.
v Кислотные свойства гликолей. Благодаря наличию второй гидроксильной группы, проявляющей –I-эффект, кислотность гликолей, особенно α-гликолей, выше по сравнению с одноатомными спиртами. Поэтому гликоли способны реагировать не только со щелочами, но и с гидроксидами тяжелых металлов с образованием комплексных соединений. В этих соединениях кроме ковалентных связей участвуют и донорно-акцепторные связи.
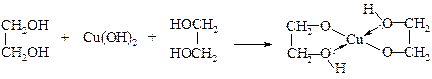
v Образование простых и сложных эфиров. Гликоли образуют со спиртами в присутствии минеральных кислот полные и неполные простые эфиры. Они могут быть синтезированы также действием галогеналканов на гликоляты.

Аналогично спиртам гликоли или гликоляты реагируют с органическими одноосновными кислотами или их производными, образуя сложные эфиры:

С двухосновными кислотами этиленгликоль образует сложные линейные полимеры.
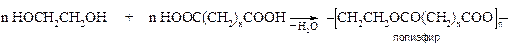
§ С минеральными кислородсодержащими кислотами гликоли образуют сложные эфиры по одной или обеим гидроксильным группам, например, моно- и динитрогликоли: НОСН2-СН2ОNО2 и О2NОСН2-СН2ОNО2.
§ При действии щелочных катализаторов гликоли взаимодействуют с ацетиленом, образуя виниловые и дивиниловые эфиры:

с акрилонитрилом ‑ моно - и бис-цианэтиловые эфиры:
 с эпоксидами при 140-180 °С – ди, три- и полигликоли:
с эпоксидами при 140-180 °С – ди, три- и полигликоли:

v Образование галогенгидринов. При действии галогенводородных кислот гликоли легко превращаются в галогенгидрины. Например, при нагревании пропиленгликоля с хлороводородом образуется смесь хлоргидринов.
HOCH2CH(OH)CH3 + HCl → ClCH2CH(OH)CH3 + HOCH2CH2ClCH3 + H2O
Следует отметить, что вторая гидроксильная группа замещается труднее. Для этой цели хлоргидрины необходимо обрабатывать хлоридом фосфора PCl5 или тионилхлоридом SOCl2.
v Окисление гликолей. Реакции окисления гликолей можно разбить на две группы:
а) реакции окисления с сохранением углеродной цепи;
б) реакции окисления цис- гликолей с расщеплением углеродной цепи.
§ При действии на этиленгликоль азотной кислотой в зависимости от концентрации получают глиоксаль или глиоксиловую кислоту.

§ Окисление этиленгликоля пероксидом водорода в присутствии солей железа(II) приводит к гликолевой кислоте – НОСН2СООН, а окисление перманганатом калия – к щавелевой кислоте НООС-СООН.
§ Второй тип реакций ведет к расщеплению углерод-углеродной связи. Так, при обработке иодной кислотой соединений, содержащих две или большее число гидроксильных групп, находящихся у соседних атомов углерода (a -гликоли), протекает окисление с расщеплением углерод-углеродной связи. Аналогично протекает реакция и для соответствующих a-гидроксикарбонильных и a-дикарбонильных соединений.



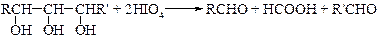


Эта реакция особенно важна при определении структуры сахаров. Качественно окисление иодной кислотой можно обнаружить по образованию белого осадка при добавлении нитрата серебра к образовавшейся в ходе реакции иодноватой кислоте (HIO3). Поскольку реакция обычно протекает количественно, то можно получить очень ценную информацию на основании данных о природе и количестве образовавшихся продуктов реакции и количестве израсходованной иодной кислоты.
Метод окисления 1,2-гликолей иодной кислотой, разработанный Л. Малапраде в 1928 г., удачно дополняется окислением гликолей тетраацетатом свинца, предложенным в 1931 г. Р. Криге: если первая реакция протекает только в водных средах, то вторую можно проводить в бензоле или уксусной кислоте.
Обе реакции протекают через циклические эфиры, образованные гликолем с окислителем. Этим объясняется тот факт, что цис- гликоли разрушаются быстрее, чем транс- изомеры. Предполагается следующий механизм окисления гликолей. Кинетические измерения показывают, что образование цикла является наиболее медленной стадией реакции.
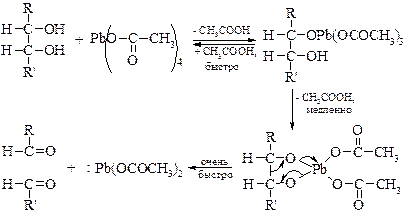
v Получениециклических ацеталей. Альдегиды в кислой среде ацеталируют 1,2-гликоли с образованием циклических ацеталей.
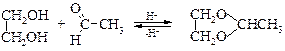
При обработке их кислотами регенерируются исходные вещества. В щелочных условиях ацетали весьма устойчивы.
1,3-Гликоли способны реагировать подобным образом, давая шестичленные циклические ацетали. Для осуществления реакций ацеталирования необходимым условием является нахождение гидроксильных групп в цисоидной конфигурации.
Применение гликолей
Из представителей гликолей наибольшего внимания заслуживает сам этиленгликоль, а также ряд соединений, синтезированных на его основе.
§ Этиленгликоль - вязкая бесцветная жидкость, сладкая на вкус. Сильно понижает температуру замерзания воды, и этим свойством этиленгликоля пользуются для приготовления антифриза. Этиленгликоль весьма гигроскопичен, поэтому его применяют при изготовлении печатных красок
Азотнокислый эфир этиленгликоля – динитроэтиленгликоль – сильное взрывчатое вещество, заменяющее нитроглицерин.
Полиэфиры этиленгликоля широко применяются в различных отраслях промышленности: как пленкообразующие вещества для лаков и красок, в производстве пластмасс и особенно синтетических волокон, например, лавсана.
§ Среди производных этиленгликоля одним из важнейших является этиленхлоргидрин, применяемый для разнообразных синтезов. Он используется для получения новокаина, индиго и горчичного газа (иприта) (ClCH2CH2)2S. Название иприт связано с тем, что в 1917 г. немцы применили этот отравляющий газ против французов у г. Ипр.
С аммиаком и аминами хлоргидрин образует аминоспирт этаноламин(коламин), входящий в состав гликолипидов.
HOCH2CH2Cl + 2NH3 → HOCH2CH2NH2 + NH4Cl
коламин
При действии сильных щелочей этиленхлоргидрин превращается в этиленоксид.
§ Диэтиленгликоль представляет собойжидкость, применяющуюся как растворитель и для заполнения тормозных гидравлических приспособлений.
§ Диоксан –жидкость, смешивающаяся с водой в любых соотношениях. Обычно его получают взаимодействием этиленгликоля с дихлорэтаном. Применяется в основном в качестве растворителя, в том числе, для эфиров целлюлозы, масел и жиров.
§ Бутандиол-1,4 –исходное вещество для получения бутадиена в странах, бедных нефтью, и для синтеза тетрагидрофурана.
§ Тетрагидрофуран применяется в качестве апротонного растворителя природных и синтетических смол, эфиров целлюлозы и ацетилена, для получения бутадиена.
13.9. многоатомные спирты
Из многоатомных спиртов простейшим и наиболее важным представителем является глицерин (пропантриол-1,2,3). Он был открыт в 1779 г. знаменитым шведским химиком К. Шееле.
Получение глицерина
v Гидролизжиров. Глицерин был получен гидролизом жиров, которые являются сложными эфирами глицерина и высших гомологов уксусной кислоты и их олефиновых изологов. При гидролизе жиров перегретым паром глицерин остается в водном растворе, который отделяют от слоя расплавленных жирных кислот.
При щелочном гидролизе жиров получают натриевые соли высших жирных кислот – мыла. Отсюда процесс гидролиза сложных эфиров при действии щелочей называется омылением. В настоящее время этот процесс лежит в основе получения глицерина для косметических и фармацевтических целей.
v Синтезна основе пропилена.
§ Первый синтез глицерина осуществили Ш. Фридель и М. Сильва в 1872 г. по следующей схеме:
 .
.
§ В настоящее время глицерин получают из пропилена, выделяемого при крекинге нефти:

Недостатком этого метода является большой объем сточных вод, содержащих минеральные соли и органические вещества, которые требуют трудоемкой утилизации, и непроизводительный расход хлора.
§ Способ, не связанный с применением хлора, основан на окислении пропилена до акролеина с последующим его восстановлением до аллилового спирта и гидроксилированием последнего до глицерина:

v Синтезна основе пропаргилового спирта. Для этого используют конденсацию ацетилена с формальдегидом в пропаргиловый спирт, который селективным гидрированием переводят в аллиловый спирт. Затем по методу, описанному в предыдущей схеме, получают глицерин:

Некоторое количество глицерина образуется при отдельных видах брожения сахаров.
Очень перспективный технический синтез глицерина разработали в Польше Я. Береш и Л. Якубович. Восстановлением простейшего непредельного альдегида акролеина, полученного в условиях кротоновой конденсации по Оппенауэру, синтезируют аллиловый спирт, который превращают в глицерин:


Разработанные и внедренные в производство способы получения глицерина позволили сократить расход пищевых жиров на технические цели.




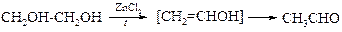
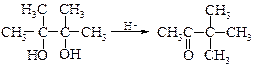
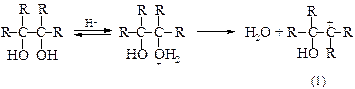

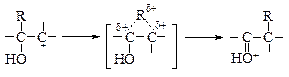 (3)
(3)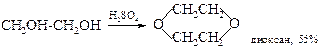
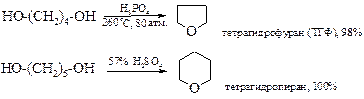
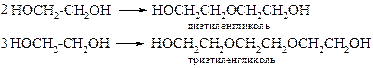
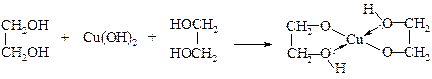


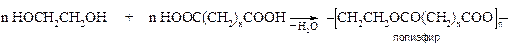

 с эпоксидами при 140-180 °С – ди, три- и полигликоли:
с эпоксидами при 140-180 °С – ди, три- и полигликоли:




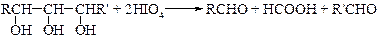


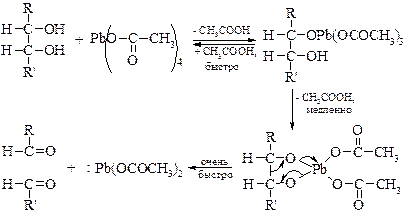
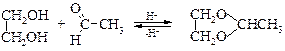
 .
.







