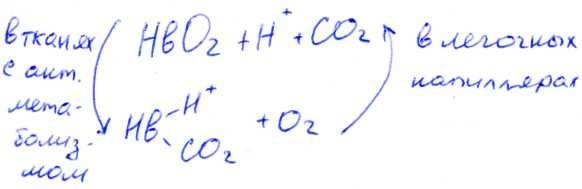Регуляция обмена железа в организме человека:система IRE / IRP и ее роль в синтезе апоферритина и рецепторов трансферина на уровне трансляции этих белков.
Система IRE/IRP
Регуляцию поступления железа в клетку обеспечивает система IRE/IRP (англ. IRE, iron-responsiveelement - железочувствительный элемент и IRP, iron-responsiveelement-bindingproteins - белок, связывающийся с железочувствительным элементом). Основой регуляции является наличие особого участка на матричной РНК - железочувствительного элемента IRE, связывающего специфичный к нему белок IRP.
В данном случае используется способность молекул IRP связываться с участком IRE соответствующих мРНК для двух белков – рецептора трансферрина и ферритина. При этом в комплексе с железом IRP не активен и не присоединяется к мРНК, без железа - может присоединяться.
1. Присоединение IRP к мРНК рецептора трансферрина ближе к ее 3'-концу защищает мРНК от разрушения РНКазами, действующими с 3'-конца мРНК:
при низкой концентрации железа в клетке белок IRP является активным, присоединяется к мРНК и, как следствие, мРНК рецепторов трансферрина существует дольше, образуется больше белков-рецепторов и повышается поток железа в клетки.
при высоком содержании железа в клетке белок IRP присоединяет железо, становится неактивным, с мРНК связаться не может и, соответственно, не защищает ее от разрушения. Синтез рецепторов к трансферрину не происходит, дополнительное железо клеткой не захватывается.

Регуляция синтеза рецепторов к трансферину
2. Взаимодействие IRP с мРНК ферритина происходит ближе к 5'-концу, т.е. там где начинается трансляция:
при низком содержании железа в клетке присоединение "пустого" активного белка IRP к мРНК для ферритина со стороны 5'-конца не позволяет ей участвовать в процессе трансляции и синтезе новых молекул ферритина,
когда концентрация железа в клетке возрастает, оно присоединяется к IRP, снижает его сродство к мРНК и позволяет синтез ферритина.

Регуляция синтеза ферритина
Конечным результатом при наличии железа в клетке является исчезновение рецепторов к трансферрину с мембраны и увеличение синтеза молекул ферритина, депонирующего железо. При отсутствии железа активируется синтез рецепторов к трансферрину и захват железа из крови, и подавление синтеза запасающего белка ферритина.
Задача.
Ответ:а) 2,3-бисфосфоглицерат (2,3-БФГ) – вещество, синтезируемое из промежуточного продукта окисления глюкозы – 1,3-бисфосфоглицерата.
б) В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров. Центральная полость – место присоединения БФГ.
В молекуле дезоксигемоглобина по сравнению с оксигемоглобином есть дополнительные ионные связи, соединяющие протомеры, поэтому размеры центральной полости больше в дезоксигемоглобине, следовательно 2,3-БФГ может присоединиться только к дезоксигемолглобину.
В тканях 2,3-БФГ присоединяется к дзоксигемоглобину и снижает сродство гемоглобина к кислороду.
лёгкие
в) HbO2 + 2,3-БФГ ↔ Hb*2,3-БФГ + O2
ткани
В результате взаимодействия 2,3-БФГ с дезоксигемоглобином образуется 5 дополнительных ионных связей, что снижает сродство гемоглобина в кислороду.

1. Альбумины сыворотки крови:местобиосинтеза,особенностисостав,структуры,физико-химических свойств,функций.
Альбумин - белок плазмы крови
Глобулярный белок плазмы крови, синтезируется исключительно в печени. Хотя по классификации его относят к простым белкам, отмечается широкая микрогетерогенность молекул альбумина, что связано с количеством и качеством агрегированных с альбумином молекул.
Значение альбумина в плазме крови заключается:
1. В поддержании коллоидно-осмотического (онкотического) давления крови (благодаря высокой гидрофильности);
2. Транспортная – благодаря большому количеству заряженных и гидрофобных участков альбумин переносит
· пигменты – (билирубин), одна молекула альбумина может одновременно связать 25-50 молекул билирубина,
· длинноцепочечные жирные кислоты – основная физиологическая функция, 6-8 штук на одну молекулу альбумина,
· катионы (например, Ca2+ и Mg2+) благодаря большому количеству глутамата, другие металлы (Hg+) также способен связать анионы (Cl–),
· соли желчных кислот,
· витамины,
· гормоны (альдостерон, прогестерон, гидрокортизон),
· органические красители,
· лекарственные вещества (дигоксин, барбитураты, пенициллин, ацетилсалициловая кислота, сердечные гликозиды).
Изменения количества белка в крови могут иметь как абсолютный (истинный), так и относительный характер. Сдвиги абсолютного характера являются следствием колебаний содержания белка в крови. В свою очередь, относительные изменения зависят от объема крови, т.е. наблюдаются при обезвоживании или гипергидратации.
2. Фибринолитическая система крови компоненты,биологическая роль.



3.Задача.Ответ: а) 2,3-бисфосфоглицерат (2,3-БФГ) – вещество, синтезируемое из промежуточного продукта окисления глюкозы – 1,3-бисфосфоглицерата.
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров. Центральная полость – место присоединения БФГ.
Б)Влияние величины pH и концентрации CO2 на связывание и освобождение O2 гемоглобином называется Эффектом Бора.
Hb + O2 ↔ HbO2
Ионная форма реакции объясняет влияние концентрации H+ на связывание O2 Hb-ион.
HHb+ + O2 ↔ HbO2 + H+
Уменьшение pH и увеличение H+ приводит к высвобождению O2 из HbO2.
В) 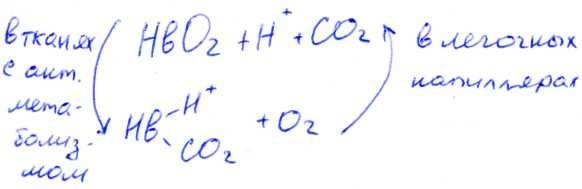

1.

2. К железосодержащим белкам относятся:
Гемопротеины – гемоглобин, миоглобин, цитохромы, цитохромоксидаза, гомогентизатоксидаза, пероксидаза, миелопероксидаза, каталаза, тиреопероксидаза.
Железофлавопротеины – сукцинатдегидрогеназа, НАДФ-оксидаза (в гранулоцитах), ацил-S-КоА-дегидрогеназа, ксантиноксидаза, пролил-гидроксилаза и др.
Железосвязывающие белки – трансферрин, ферритин, гемосидерин, мобилферрин, лактоферрин и др.
Суточная потребность
С пищей в сутки должно поступать для мужчин 10 мг, для женщин детородного возраста в связи с регулярной кровопотерей – 20 мг, у женщин при беременности – 40-50 мг и при лактации – 30-40 мг.

Метаболизм железа
После всасывания железо либо откладывается в клетках кишечника в составе ферритина, либо сразу попадает в кровоток и в комплексе с трансферрином переносится в клетки печени, костного мозга или других тканей. Нагруженный железом трансферрин (холотрансферрин) взаимодействует со своим специфическим мембранным рецептором. Трансферриновый рецептор на низком уровне экспрессируется во всех типах клеток, на высоком уровне – в активно делящихся клетках.
Наибольшее количество трансферриновых рецепторов находится на поверхности эритробластов (300 тыс - 400 тыс на одну клетку). Период полужизни комплекса трансферрин-Fe не превышает 60-90 мин и большая часть железа, транспортируемая трансферрином, поступает в костный мозг. При усиленном эритропоэзе период полужизни комплекса сокращается до 10-15 мин, в противоположной ситуации он удлиняется до нескольких часов.
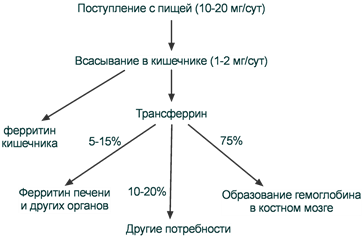
Пути поступления и использования ионов железа
Суточная потребность
С пищей в сутки должно поступать для мужчин 10 мг, для женщин детородного возраста в связи с регулярной кровопотерей – 20 мг, у женщин при беременности – 40-50 мг и при лактации – 30-40 мг.

В)-глобулиныg

1.

Регуляция всасывания
Транскрипционные факторы, от активности которых зависит экспрессия DMT и HCP1, чувствительны к содержанию железа в энтероците и к степени внутриклеточной гипоксии. Больные с выраженной железодефицитной анемией способны повышать абсорбцию железа до 20-40 мг/сут.
Останется железо в энтероците или будет выводиться в кровь зависит от насыщенности им трансферрина. При "пустом" трансферрине железо будет более активно переноситься через базолатеральные мембраны наружу и присоединяться к трансферрину.
Значительно лучше железо всасывается из мясных продуктов – на 20-30%, из яиц и рыбы – на 10-15%, меньше всего железо всасывается из растительных продуктов – на 1-5%.
Наличие в пище фитиновой кислоты (сухие завтраки, растительные продукты), кофеина и танина (чай, кофе, напитки), фосфатов, оксалатов (растительные продукты) ухудшает всасывание железа, т.к. они образуют нерастворимые комплексы.
3.Задача.ОТВЕТ: а), в) Основным гемоглобином у человека является HbA. Он состоит из 4-х протомеров (2α2β), каждый из которых в свою очередь состоит из 8 полипептидных спиралей, свернутых в плотную глобулярную структуру, содержащую внутренне гидрофобное ядро и «карман» для связывания гема. В активном центре между Гис E7и Гис F8 присоединяется гем.
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.

В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина 8 друг с другом. Следовательно, образованию агрегатов HbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки О2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия – гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина: После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества HbF не заместятся на HbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген HbA, а другой ген HbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
б) Эти изменения могут быть результатом точечных мутаций

1.
Ферменты сыворотки крови
I. Ферменты, секретируемые в плазму, и выполняющие в ней специфические функции – истинноплазменные ферменты. В плазме их активность много больше, чем в органах (церулоплазмин, псевдохолинэстераза, липопротеинлипаза, белковые факторы систем свертывания крови, фибринолиза и кининогенеза, ренин).
Снижение активности этих ферментов в плазме будет свидетельствовать о снижении синтетической способности клеток или о накоплении ингибиторов в плазме крови.
II. Ферменты, не характерные для плазмы – органоспецифичные. Именно определение активности этих ферментов чаще всего используют для верификации диагноза и контроля лечения. Выделяют две группы органоспецифичных ферментов:
1.Ферменты клеточного метаболизма (индикаторные) – их активность резко повышается в плазме крови в случае нарушения проницаемости клеточных мембран или их альтерации:
Например,
· при изменениях со стороны сердечной мышцы происходит повышение активности сердечного изофермента креатинкиназы (КК-MB), изоферментов лактатдегидрогеназы 1 и 2 (ЛДГ-1 и ЛДГ-2), аспартатаминотрансферазы,
· нарушения скелетных мышц – мышечного изофермента креатинкиназы (КК-MM), алкогольдегидрогеназы,
· костной ткани – щелочной фосфатазы (ЩФ), альдолазы (АЛД),
· предстательной железы – кислой фосфатазы,
· гепатоцитов – аланинаминотрансферазы, глутаматдегидрогеназы, холинэстеразы, сорбитолдегидрогеназы,
· желчевыводящих путей – щелочной фосфатазы, γ-глутамилтранспептидазы (γ-ГТП).
2. Ферменты, экскретируемые в выводные протоки желчных путей, панкреатические и слюнные протоки. В норме активность таких ферментов в плазме намного ниже, чем в клетках и имеет постоянное значение (α-амилаза, липаза поджелудочной железы). Изучение активности этих ферментов позволяет судить о функционировании соответствующего органа.
2.

Рефлекторный (кратковременный) спазм сосудов, который возникает при травме. Он значительно уменьшает объем кровотока через поврежденный сосуд или даже прекращает в нем движение крови. Затем спазм сосудов поддерживается действием серотонина, адреналина, тромбоксана, эндотели- нов, которые выделяются из тромбоцитов или клеток поврежденных сосудов
Продукцией под влиянием мембранной фосфолипазы и фермента тромбоксан-синтетазы мощного вазодилататора и ингибитора агрегации тромбоцитов – простагландина (простациклина) 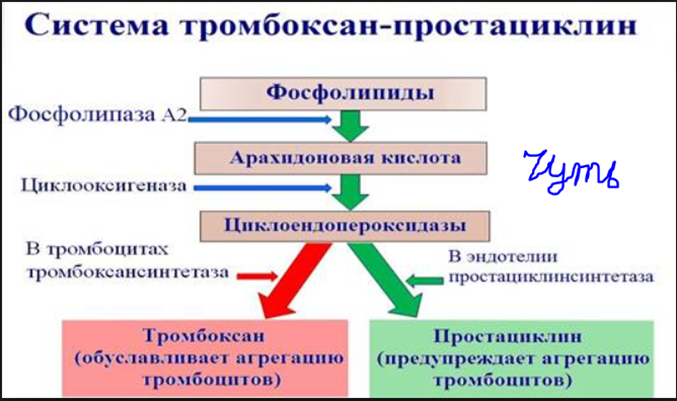

3.Задача.Ответ: а)Заболевание – серповидноклеточная анемия.
б) В гемоглобине S мутантными оказались 2β-цепи, в которых Глу, высокомолекулярная отрицательно заряженная аминокислота в положении 6, была заменена Вал, содержащим гидрофобный радикал.
HbS 2β-цепь Вал-Гли-Лей-Тре-Про-Вал-Глу-Лиз
в) Гемоглобин S
В дезоксигемоглобине S имеется участок, комплиментраный другому участку таких же молекул, содержащему изменённую. В результате молекулы дезоксигемоглобина начинают слипаться, образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа.
Нарушение доставки кислорода в ткани вызывает боли и даже некроз клеток в данной области.

1.



2.
Обнаружены три способа перемещения железа из просвета кишечника в энтероциты:
1. Негемовое железо (III) захватывается интегрином, восстанавливается до Fe (II) параферритином, и при помощи мобилферрина перемещается к месту использования, роль этого пути невысока.
2. Негемовое железо (III) восстанавливается до Fe (II) при помощи аскорбиновой кислоты, соляной кислоты или при участии ферроредуктазы (DcytB, дуоденального цитохрома B) и далее переносится внутрь белком DMT-1 (divalentmetalion transporter-1).
3. Гемовое железо связывается с белком НСР1 (hemecarrierprotein 1), и в цитозоле высвобождается из гема при действии гемоксигеназы, и далее переносится по клетке.
Строение гемоглобина
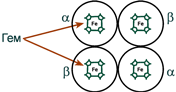
Строение гемоглобина А
Б) На связывание кислорода гемоглобином сильное влияние оказывает pH и CO2. Связывание CO2 и H+снижает способность гемоглобина связывать O2.
В) 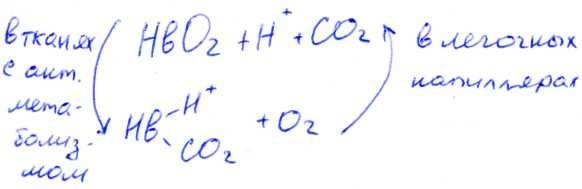

Строение и синтез гема
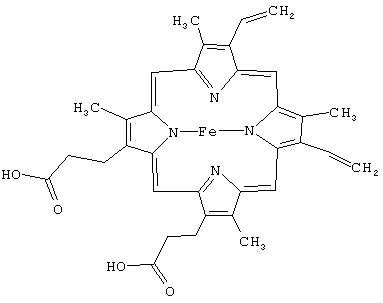
Гем – структура, включающая в себя порфириновое кольцо (состоящее из 4 пиррольных колец) и иона Fe2+. Железо связывается с порфириновым кольцом двумя координационными и двумя ковалентными связями.
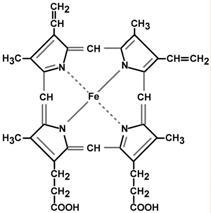
Строение гема
Синтез гема в основном идет в предшественниках эритроцитов, в клетках печени, почек, слизистой кишечника и в остальных тканях. Первая реакция синтеза с участием δ-аминолевулинат-синтазы (греч. δ - "дельта") происходит в митохондриях. Следующая реакция при участии аминолевулинатдегидратазы (порфобилиноген-синтазы) протекает в цитозоле. Здесь из двух молекул δ‑аминолевулиновой кислоты образуется циклический порфобилиноген (монопиррол).
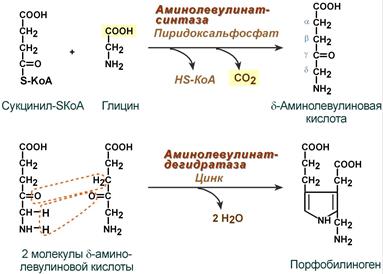

Синтез гема из порфобилиногена
Регуляция синтеза гема
Основным регуляторным ферментом синтеза гема является аминолевулинатсинтаза.
1. Гем:
- влияет на транскрипцию фермента. После взаимодействия с молекулой белка-репрессора формирует активный репрессорный комплекс, связывается с ДНК и подавляет транскрипцию, мРНК для фермента не образуется и синтез фермента прекращается.
- напрямую оказывает отрицательный аллостерический эффект на фермент.
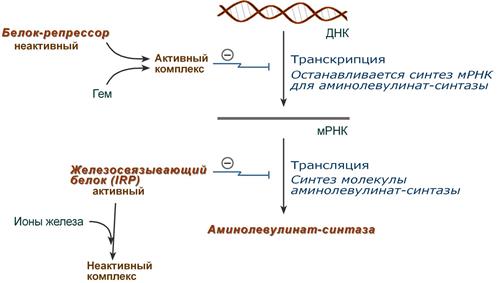
Регуляция синтеза аминолевулинатсинтазы
2. Ионы железа. Их достаточное количество оказывает положительный эффект при синтезе молекулы аминолевулинатсинтазы.
В клетке имеется железосвязывающий белок (англ. IRP, iron-responsiveelement-bindingproteins – белок, связывающий железочувствительный элемент), который в отсутствии ионов железа обладает сродством к железочувствительному участку IRE (англ. iron-responsiveelement) на матричной РНК фермента. Это связывание блокирует трансляцию мРНК в рибосоме, т.е. подавляет синтез белковой цепи. Ионы железа связываются с железосвязывающим белком, образуя с ним неактивный комплекс, и инициируют синтез фермента.
3. Положительным модулятором аминолевулинатсинтазы служит внутриклеточная гипоксия, которая в эритропоэтических тканях индуцирует синтез фермента.
4. В печени повышение активности аминолевулинатсинтазы вызывают различные соединения, усиливающие работу микросомальной системы окисления (жирорастворимые вещества, стероиды) – при этом возрастает потребление гема для образования цитохрома Р450, и снижается внутриклеточная концентрация свободного гема. В результате происходит усиление синтеза фермента.
Всасывание
При попадании в желудок под действием HCl желудочного сока железо высвобождается из элементов пищи.
Всасывание происходит в проксимальном отделе тонкого кишечника в количестве около 1,0-2,0 мг/день (10-15% пищевого железа). При этом железо должно быть в виде двухвалентного иона, в то же время с пищей поступает преимущественно трехвалентное железо. Для восстановления Fe3+ в Fe2+ используется аскорбиновая кислота и соляная кислота. Только железо мясных продуктов находится в двухвалентной гемовой форме, и поэтому хорошо всасывается.
Три пути всасывания железа в кишечнике
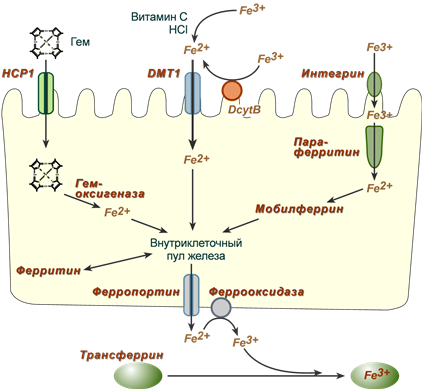
Регуляция всасывания
Транскрипционные факторы, от активности которых зависит экспрессия DMT и HCP1, чувствительны к содержанию железа в энтероците и к степени внутриклеточной гипоксии. Больные с выраженной железодефицитной анемией способны повышать абсорбцию железа до 20-40 мг/сут.
Останется железо в энтероците или будет выводиться в кровь зависит от насыщенности им трансферрина. При "пустом" трансферрине железо будет более активно переноситься через базолатеральные мембраны наружу и присоединяться к трансферрину.
Значительно лучше железо всасывается из мясных продуктов – на 20-30%, из яиц и рыбы – на 10-15%, меньше всего железо всасывается из растительных продуктов – на 1-5%.
Наличие в пище фитиновой кислоты (сухие завтраки, растительные продукты), кофеина и танина (чай, кофе, напитки), фосфатов, оксалатов (растительные продукты) ухудшает всасывание железа, т.к. они образуют нерастворимые комплексы.
Задача.Ответ.а)Воспаление.
Б) белок плазмы крови, относящийся к группе белков острой фазы,
В) 


1.

Перенос кислорода от лёгких к тканям кровью осуществляется в 2 формах:
· в растворённом состоянии,
· в виде оксигемоглобина.
Растворенный в плазме кислород составляет около 1,5% от всего переносимого кровью кислорода или 0,03 мл/100 мл крови. Невысокое содержание данной формы кислорода связано с его ограниченной растворимостью в воде. Величина растворённого в крови кислорода может быть увеличена при использовании гипербарической оксигенации.
В виде оксигемоглобина переносится основная часть кислорода крови. Связывание кислорода с гемоглобином зависит от целого ряда факторов и, прежде всего, от парциального давления кислорода. В артериальной крови оно равно 80 мм рт. ст., в венозной -30-40 мм рт. ст. Соответственно насыщение гемоглобина кислородом в артериальной крови составляет 100%, в венозной крови около 70%.
2. Обнаружены три способа перемещения железа из просвета кишечника в энтероциты:
1. Негемовое железо (III) захватывается интегрином, восстанавливается до Fe (II) параферритином, и при помощи мобилферрина перемещается к месту использования, роль этого пути невысока.
2. Негемовое железо (III) восстанавливается до Fe (II) при помощи аскорбиновой кислоты, соляной кислоты или при участии ферроредуктазы (DcytB, дуоденального цитохрома B) и далее переносится внутрь белком DMT-1 (divalentmetalion transporter-1).
3. Гемовое железо связывается с белком НСР1 (hemecarrierprotein 1), и в цитозоле высвобождается из гема при действии гемоксигеназы, и далее переносится по клетке.
Строение гемоглобина

Строение гемоглобина А
Гемоглобин представляет собой белок, включающий 4 гемсодержащие белковые субъединицы. Между собой протомеры соединяются гидрофобными, ионными, водородными связями по принципу комплементарности. При этом они взаимодействуют не произвольно, а определенным участком - контактной поверхностью. Этот процесс высокоспецифичен, контакт происходит одновременно в десятках точек по принципу комплементарности. Взаимодействие осуществляют разноименно заряженные группы, гидрофобные участки, неровности на поверхности белка.
Белковые субъединицы в нормальном гемоглобине могут быть представлены различными типами полипептидных цепей: α, β, γ, δ, ε, ξ (соответственно, греч. - альфа, бета, гамма, дельта, эпсилон, кси). В состав молекулы гемоглобина входят по две цепи двух разных типов.
Гем соединяется с белковой субъединицей, во-первых, через остаток гистидина координационной связью железа, во-вторых, через гидрофобные связи пиррольных колец и гидрофобных аминокислот. Гем располагается как бы "в кармане" своей цепи и формируется гемсодержащийпротомер.



В пространстве
Ограничение распространения тромба местом повреждения сосуда.
Осуществляется путем ингибирования факторов свертывания крови, которые являются ферментами.
Ингибиторы:
1) Антитромбин III (основной)
Составляет 80-90% от общего числа подобных веществ.
Активатор - гепарин.
Связывает факторы-ферменты (II, IX, X, XII) и снижает их активность.
Также активирует урокиназу, плазмин, калликреин.
Но не инактивирует сериновые протеазы.
Действует только на ферменты, циркулирующие в крови.
Но не действует на ферменты, находящиеся в составе мембранных комплексов.
Дефект антитромбина III приводит к тромбозам и эмболии сосудов.
3.Задача.ОТВЕТ:А)Ионная форма реакции объясняет влияние концентрации H+ на связывание O2 Hb-ион.
HHb+ + O2 ↔ HbO2 + H+
Уменьшение pH и увеличение H+ приводит к высвобождению O2 из HbO2.
Б) 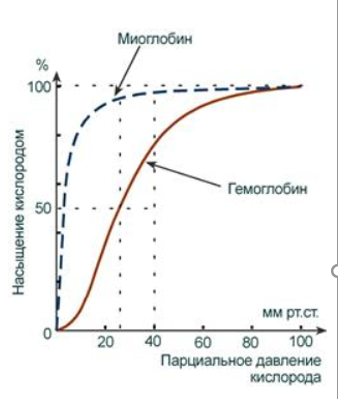
В)Белок локализован в мышечной ткани. Миоглобин обладает более высоким сродством к кислороду по сравнению с гемоглобином. Это свойство обусловливает функцию миоглобина – депонирование кислорода в мышечной клетке и использование его только при значительном уменьшении парциального давления О2 в мышце (до 1-2 мм рт.ст).
Ферменты сыворотки крови

Ферменты сыворотки крови
III. Ферменты, секретируемые в плазму, и выполняющие в ней специфические функции – истинноплазменные ферменты. В плазме их активность много больше, чем в органах (церулоплазмин, псевдохолинэстераза, липопротеинлипаза, белковые факторы систем свертывания крови, фибринолиза и кининогенеза, ренин).
Снижение активности этих ферментов в плазме будет свидетельствовать о снижении синтетической способности клеток или о накоплении ингибиторов в плазме крови.
IV. Ферменты, не характерные для плазмы – органоспецифичные. Именно определение активности этих ферментов чаще всего используют для верификации диагноза и контроля лечения. Выделяют две группы органоспецифичных ферментов:
1.Ферменты клеточного метаболизма (индикаторные) – их активность резко повышается в плазме крови в случае нарушения проницаемости клеточных мембран или их альтерации:
Например,
· при изменениях со стороны сердечной мышцы происходит повышение активности сердечного изофермента креатинкиназы (КК-MB), изоферментов лактатдегидрогеназы 1 и 2 (ЛДГ-1 и ЛДГ-2), аспартатаминотрансферазы,
· нарушения скелетных мышц – мышечного изофермента креатинкиназы (КК-MM), алкогольдегидрогеназы,
· костной ткани – щелочной фосфатазы (ЩФ), альдолазы (АЛД),
· предстательной железы – кислой фосфатазы,
· гепатоцитов – аланинаминотрансферазы, глутаматдегидрогеназы, холинэстеразы, сорбитолдегидрогеназы,
· желчевыводящих путей – щелочной фосфатазы, γ-глутамилтранспептидазы (γ-ГТП).
2. Ферменты, экскретируемые в выводные протоки желчных путей, панкреатические и слюнные протоки. В норме активность таких ферментов в плазме намного ниже, чем в клетках и имеет постоянное значение (α-амилаза, липаза поджелудочной железы). Изучение активности этих ферментов позволяет судить о функционировании соответствующего органа.
2.
Нейтрализация тромбина осуществляется теми антикоагулянтами, которые постоянно находятся в крови и поэтому ППС функционирует постоянно. К таким веществам относятся:
· фибрин, который адсорбирует часть тромбина;
· антитромбины (известно 4 вида антитромбинов), они препятствуют превращению протромбина в тромбин;
· гепарин - блокирует фазу перехода протромбина в тромбин и фибриногена в фибрин, а также тормозит первую фазу свертывания крови;
· продукты лизиса (разрушения фибрина), которые обладают антитромбиновой активностью, тормозят образование протромбиназы;
· клетки ретикуло-эндотелиальной системы поглощают тромбин плазмы крови.
При быстром лавинообразном нарастании количества тромбина в крови ППС не может предотвратить образование внутрисосудистых тромбов. В этом случае в действие вступает вторая противосвертывающая система (ВПС), которая обеспечивает поддержание жидкого состояния крови в сосудах рефлекторно-гуморальным путем по следующей схеме. Резкое повышение концентрации тромбина в циркулирующей крови приводит к раздражению сосудистых хеморецепторов. Импульсы от них поступают в гигантоклеточное ядро ретикулярной формации продолговатого мозга, а затем по эфферентным путям к ретикуло-эндотелиальной системе (печень, легкие и др.). В кровь выделяются в больших количествах гепарин и вещества, которые осуществляют и стимулируют фибринолиз (например, активаторы плазминогена).Гепарин ингибирует первые три фазы свертывания крови, вступает в связь с веществами, которые принимают участие в свертывании крови. Образующиеся при этом комплексы с тромбином, фибриногеном, адреналином, серотонином, фактором XIII и др. обладают антикоагулянтной активностью и литическим действием на нестабилизированный фибрин.Следовательно, поддержание крови в жидком состоянии осуществляется благодаря действию ППС и ВПС.Регуляция свертывания крови. Регуляция свертывания крови осуществляется с помощью нейро-гуморальных механизмов.
3.Задача Ответ: а)В норме наружная поверхность каждого эритроцита имеет отрицательный заряд, обусловленный сиаловыми кислотами, входящими в состав клеточных мембран. Одинаковый заряд вызывает силы отталкивания между клетками («электростатическая распорка»). В результате эритроциты находятся во взвешенном состоянии, оседают медленно, что и определяет нормальную СОЭ [8, 19, 28].
При патологических процессах на поверхности эритроцита скапливается большое количество молекул белка (фибриногена, гамма-глобулина, парапротеина и др.), которые не только ослабляют электростатический заряд, но и способствуют склеиванию (агрегации) эритроцитов между собой в виде монетных столбиков. Относительная плотность каждого агрегата в расчёте на единицу его объёма увеличивается, агрегаты начинают быстрее опускаться вниз и скорость оседания эритроцитов увеличивается.
Б) 
в) 

Различными функциями, объединенных по общему признаку – быстрое и значительное увеличение концентрации при бактериальной, вирусной, паразитарной инфекции, физической или химической травме, токсической или аутоиммунной реакции, злокачественных новообразованиях.

1.



2.
ДВС-синдром — это приобретенное нарушение свертывающей системы крови, возникающее в результате чрезмерного образования факторов свертывания, которые вызывают появление тромбов (сгустков крови) в мелких кровеносных сосудах, что сопровождается повреждением органов и тканей, а затем повышенной кровоточивостью.
ДВС-синдром — это не самостоятельное заболевание, а осложнение имеющегося болезненного процесса. Он «дозозависим», то есть его выраженность тем больше, чем сильнее тяжесть основного заболевания.
ДВС-синдром всегда мультисистемен, то есть даже, если основное заболевание развивается только в одном органе, при развитии ДВС-синдрома неизбежно вовлечение всего сосудистого русла, всех органов и систем.
Причины
Причины ДВС-синдрома:
· тяжелые инфекции (вирусные, бактериальные, грибковые и др.);
· хирургические вмешательства;
· злокачественные (то есть растущие с повреждением окружающих тканей) опухоли (опухоли крови, рак легкого, яичника, молочной железы и др.);
· реакции повышенной чувствительности на переливание компонентов крови;
· острые отравления (кислоты, щелочи, змеиные яды).
Стадии:
I стадия ДВС-синдрома — фаза гиперкоагуляции. Характеризуется: -активация плазменной системой крови; -внутрисосудистой агрегацией Т и др форм Эл крови; -наруш микроциркуляции.
II стадия ДВС-синдрома — фаза гипокоагуляции. -дефицит антитромбниа III -гепарин утрачивает свои антикоагуляционные, антитромботические свойства.
III стадия ДВС-синдрома -восстановление функции органов. Стадия может закончиться полным выздоровлением. Возможно развитие тяжелых осложнений: почечная, печеночная недостаточность, неврологические, кардиальные и другие осложнения.
Лечение:
Лечение Базисной терапией ДВС-синдрома во всех фазах является применение гепарина, которое сочетается с введением дезагрегантов, коррекцией гемодинамических нарушений, заместительной плазмотерапией, применением ингибиторов фибринолиза, заместительной антианемической терапией. Такое лечение проводят на фоне терапии основного заболевания и дополняют реанимационными мероприятиями, направленными на борьбу с развивающимися острыми синдромами.
В первой фазе ДВС-синдрома внутривенно вводят гепарин, дроперидола, раствор, раствор папаверина гидрохлорида, раствор дибазола. Основным средством терапии второй фазы ДВС-синдрома остается гепарин, плюс переливание плазмы и ингибиторов фибринолиза. При необходимости корректируют анемию. В третьей стадии процесса осуществляются реабилитационные мероприятия, а также меры, направленные на профилактику рецидивов ДВС-синдрома.

1. Влияние рН на сродство гемоглобина к кислороду носит название эффекта Бора. При закислении среды сродство снижается, при защелачивании – повышается.
При повышении концентрации протонов (закисление среды) в тканях возрастает освобождение кислорода из оксигемоглобина. В легких после удаления угольной кислоты (в виде СО2) из крови и одновременном увеличении концентрации кислорода высвобождаются ионы Н+ из гемоглобина.
Реакция взаимодействия кислорода с гемоглобином упрощенно имеет вид:

Изменение сродства гемоглобина к кислороду в тканях и в легких при изменении концентрации ионов H+ и О2 обусловлено конформационными перестройками глобиновой ч