Использование феромонных ловушек для борьбы со стволовыми вредителями леса
Введение
Стволовые вредители леса и борьба с ними
Использование феромонов в борьбе с вредителями леса
Половые феромоны
Наиболее изучены половые феромоны, или половые аттрактанты. Они выделяются в ничтожно малых количествах, достаточных, однако для привлечения другого пола. Так, секреции одной неоплодотворенной самки достаточно для привлечения десятков тысяч особей самцов того же вида, расположенных от нее на расстоянии десятков, иногда сотен метров. Некоторые феромоны синтезированы и уже используются в борьбе с отдельными видами вредных насекомых или для учета их появления и численности в природе.
Термином «половые феромоны» обозначают соединения, выделяемые самками как для привлечения самцов, находящихся на некотором расстоянии, так и для побуждения их к спариванию, если они находятся вблизи. Этот же термин применяют к соединениям, выделяемым самцами для возбуждения самок. Последние соединения иногда называют афродизиаками, хотя, строго говоря, этот термин относится к лекарственным препаратам, усиливающим либидо у человека. Половые феромоны - наиболее изученная группа химических средств взаимодействия насекомых, и в настоящее время они найдены и охарактеризованы у множества различных видов. Только у Lepidoptera обнаружено свыше 200 видов, выделяющих женские феромоны, и не менее 60 видов, у которых аттрактанты выделяют самцы.
Простейшим по химической структуре половым аттрактантом является валериановая кислота - женский феромон щелкуна калифорнийского. Однако большинство феромонов относится к ненасыщенным спиртам, ацетатам или карбоксикислотам с длинной цепью (табл. 1).
Среди них лучше всего изучена 9-кетодеценовая кислота, выделяемая пчелиной маткой (царицей) и привлекающая трутней к совокуплению с ней. Однако это только одно из 32 соединений подобной структуры, обнаруженных в голове матки. Родственная ей 9-гидроксидеценовая кислота, например, также представляет собой активное соединение, вызывающее образование и стабилизацию роя рабочих пчел.
В некоторых случаях роль феромонов играют алифатические циклические соединения, например фронталин и экзобревикомин - феромоны жуков родов Brevicomis и Ips. Феромоны долгоносика хлопкового (Anthonomus grandis) составляют производные циклогексана. Существуют также ароматические феромоны. Фенол служит женским феромоном некоторых личинок жуков; очевидно, он образуется из тирозина, получаемого с пищей. Феромоном моли Leucania impuris является бензальдегид. Единственный известный феромон алкалоидной природы образуют самцы бабочек Danaus в андрокониях крыла.
Таблица 1. Структура некоторых типичных половых феромонов насекомых
| Структура и название
| Пол
| Организм
|
| СН3(СН2)3СО2Н Валериановая кислота
| ♀
| Личинка щелкуна калифорнийского (Limonius californicus)
|
| СН3СО(СН2)5CH = СНСО2Н транс-9-Кето-2-деценовая кислота
| ♀
| Пчела медоносная (Apis mellifera)
|
| СН3(СН2)3СН = СН(СН2)6ОАс цис-7-Додеценилацетат
| ♀
| Капустная совка (Trichoplusia ni)
|
| СН3(СН2)2СН = СН(СН2)7ОАс цис-8-Додеценилацетат
| ♀
| Восточная плодожорка (Grapholitha molesta)
|
| СН3СН2СН = СН(СН2)10ОАс цис-11-Тетрадеценилацетат транс-11-Тетрадеценилацетат
| ♀
| Дубовая листовертка (Archips semiferanus)
|
| СН3(СН2)15ОАс Гексадеканилацетат СН3(СН2)4СН = СН(СН2)10ОАс цис-11-октадеценилацетат
| ♂
| Бабочка (Lycorea ceres ceres)
|
| СН3(СН2)9СО(СН2)3СН = СН(СН2)4СН3 цис-6-генэйкозен-11-он
| ♀
| Волнянка (Orygia pseudotsugata)
|
Феромоны содержатся в насекомых в очень низкой концентрации, и для их выделения и идентификации требуется огромное число особей. Каждая самка волнянки псевдотсуговой содержит около 40 нг феромона в последних сегментах брюшка. Чтобы выделить в достаточном количестве материал для определения, необходимо иметь не менее 6000 насекомых. Для извлечения 1,5 мг феромона из хлопковой моли было использовано около 1 млн. неоплодотворенных самок.
У любого насекомого химическая структура преобладающего феромона обычно очень специфична, и небольшое изменение молекулы может привести к исчезновению или уменьшению ее активности. Большинство углеводородных феромонов содержит изолированную двойную связь, положение и стереохимия (цис- или транс-) которой имеет существенное значение. Это можно проиллюстрировать на примере феромона капустной совки (Trichoplusia ni). При тестировании ряда его синтетических аналогов было обнаружено, что все они значительно менее активны, чем природный феромон, а большинство вообще не обладает активностью (рис. 3) (Джекобсон, 1976).

Рис. 3. Влияние положения двойной связи в ацетатах С12-спиртов на их активность как половых аттрактантов у самцов капустной совки. Ас - ацетат.
Природный феромон - это цис-7-алкенилацетат. Его синтетический транс-7-изомер проявляет некоторую активность. По-видимому, существует общая закономерность: если не меняется положение двойной связи в молекуле, в определенной степени активны и цис- и транс-формы. У дубовой листовертки природный феромон самки представляет собой смесь транс- и цис-изомеров в отношении 2: 1, что достаточно необычно. Природный феромон волнянки псевдотсуговой - чистый цис-6-генэйкозен-11-он, однако его синтетическая транс-форма также активно привлекает самцов этой моли (Харборн, 1985).
Хотя структурные требования для активности половых феромонов сравнительно жестки, не исключено, что совершенно неродственные соединения оказывают одинаковое действие. Это доказано на примере таракана американского (Periplaneta americana), половое возбуждение которого наряду с природным женским феромоном могут вызывать вещества, присутствующие в экстрактах из растительных тканей (Харборн, 1985). Одно из таких активных соединений, найденное у голосеменных, идентифицировано как D-борнилацетат (рис. 4) и активно в концентрации 0,07 мг/см2.

Рис. 4. Структура некоторых соединений, имитирующих половые феромоны
Следует отметить, что L-изомер в 100 раз менее активен, чем D-изомер. Таким образом, в данном случае стереохимия имеет большое значение. Летучие соединения, действующие как феромоны на таракана, найдены также у ряда покрытосеменных; при обследовании 100 видов у восьми из них обнаружены активные компоненты неизвестной природы. Некоторые синтетические органические соединения также могут имитировать активность природных феромонов. Два из них нашли применение. Это тримедлур, активный в отношении средиземноморской дрозофилы, и куэлур, который привлекает самцов дынной мухи (Dacus cucurbitae). Строение этих двух соединений изображено на рис. 4. В некоторых случаях при изучении химии полового поведения были выявлены специфические взаимоотношения между растением и насекомым, которое на нем живет и размножается. Так, Риддифорд и Вильяме (Харборн, 1985) обнаружили, что павлиноглазки Полифема (Antherea polyphemus) могут спариваться только в присутствии листьев красного дуба (Quercus rubra). Анализ показал, что эманация листьев содержит летучий углеводород транс-2-гексаналь, попадание которого на рецепторы антенн самок служит триггером для выделения ими феромонов, которые в свою очередь побуждают самцов к спариванию. Подобная ситуация, возможно, наблюдается и у насекомых других видов, например у жуков-долгоносиков Rhabdoscelum obscurus, которые не выделяют половых аттрактантов, если кормятся не на сахарной свекле (Харборн, 1985); в этом случае триггерное действие предположительно оказывают неизвестные растительные соединения, специфичные для сахарной свеклы.
Пути биосинтеза половых феромонов изучены пока еще недостаточно, что связано с практическими трудностями введения меченых предшественников в железы насекомых. Однако полагают, что обычно половые феромоны синтезируются в теле насекомых. Большинство более простых феромонов (табл. 1) - производные жирных кислот. Они могут синтезироваться непосредственно путем конденсации соответствующего числа ацетатных единиц или непрямым путем, а из жирных кислот обычных липидов - в результате декарбоксилирования, укорочения цепей и т. п. Только в некоторых случаях, например как у бабочек-данаид и короедов, половые феромоны происходят из пищи. У этих насекомых выделенное из растительного материала вещество используется или непосредственно, или после соответствующей химической модификации. Одно время считали, что женские феромоны дубовой листовертки - смесь тетрадеценилацетатов (табл. 1) - также имеют пищевое происхождение, но в более поздних работах было показано, что это не так (Харборн, 1985).
Рассмотрим особенности половых феромонов основных жуков-короедов.
Большой сосновый лубоед - Blastophagus piniperda L. Самки первыми нападают на дерево-прокормитель - сосну - и вбуравливаются в флоэму коры. В опытах с ольфактометром самки, извлеченные из коры, а также самцы в брачный период не привлекали ни самцов, ни самок. Следовательно, в этот период самцы и самки, извлеченные из флоэмы сразу же после вбуравливания в нее, не оказывают воздействия друг на друга. Из задней кишки самок и самцов Большого соснового лубоеда были выделены транс-Вербенол и вербенон.
Короед типограф - Ips typographus L. Свежая древесина ели, пораженная самцами, привлекает больше жуков обоих полов, чем еще не заселенная самцами древесина. Феромон выделяется как при весеннем, так и втором лёте. Феромон короеда типографа привлекает также три вида широко распространенных хищников (Thanasimus formicarius, Medetera signaticornis и Epuraea pygmaea).
Ренвик и Питман и др. выделили транс-вербенол (33) из эфирного экстракта задней кишки самок и вербеной из экстракта задней кишки самцов Dendroctonus frontalis. Как показали Вите и Крозиер, именно вербеной, а не вербенол вызывает скопление этих насекомых.
В 1968 г. Ренвик и Вите с помощью газовой хроматографии летучих веществ выделили из пентанового экстракта задней кишки самок соединение, вызывающее при полевых испытаниях скопления особей обоего пола. Исследователи не смогли определить строение полученного соединения, но определили методом масс-спектроскопии его молекулярный вес - 142. Идентификацию этого соединения успешно осуществили Кинзер и др., которые ранее выделили это соединение из самцов D. breuicomis (соединение 36). Несмотря на то что названные авторы выделили его из другого вида и не доказали его идентичности с соединением, полученным Ренвиком и Вите из D. frontalis, они назвали это соединение фронталином. Оба соединения (фронталин и транс-вербенол) позднее выделил методом газовой хроматографии Костер из задней кишки вышедших из древесины девственных самок D. frontalis. У девственных самок содержание фронталина и транс-вербенола в 4,1 и 1,9 раза соответственно было выше, чем у жуков, покинувших древесину. Вите и Ренвик предлагают проводить сравнение результатов газовой хроматографии с результатами полевых испытаний для выявления активных соединений, вызывающих агрегацию жуков-короедов D. breuicomis и D- frontalis.
С помощью вакуумного насоса просасывали воздух (20 л/мин) через ящик, содержащий кусочки бревен желтой сосны, зараженные самцами короедами Ips confusus. После этого воздух пропускали через 2 охлажденные ловушки (в первой - 4°С и во второй - 70°С).
В опытах с полевым ольфактометром оттаявшее содержимое обеих ловушек обладало сильным привлекающим действием. Привлекающее соединение экстрагировали из его водной эмульсии петролейным эфиром и концентрировали, отгоняя растворитель при 80°С. Полученное бесцветное масло при хранении в холодильнике не теряло активности в течение нескольких недель. Однако оно теряло активность при продолжительном нагревании выше 85°С.
Ренвик и др. пропускали через газовый хроматограф воздух из сосуда, содержащего заднюю кишку самцов, питавшихся свежей флоэмой желтой сосны. Соединения, вышедшие из колонки (1525 см ´ 0,313 см) с 5%-ным апиезоном на хромосорбе W, промытом кислотой, с временем удерживания 6 мин при 110° (скорость тока азота 25 мл/мин) сильно привлекали мигрирующих жуков.
В 1966 г. Вуд и др. описали методы получения больших количеств феромона из буровой муки, образуемой самцами в килограммовых количествах. Было обнаружено, что отдельные самцы выбрасывают по 9,4 мг буровой муки в день в течение примерно 15 дней. Для выделения аттрактанта буровую муку замачивали и растирали в теплом бензоле, затем отгоняли растворитель и перегоняли концентрированный остаток в специальном приборе при температуре 85 - 90°С и давлении 0,01 мм. Дистиллят хроматографировали на колонке с силикагелем и активную фракцию (активность проявлялась в количестве 10-6 г) элюировали смесью бензол - эфир. Экстракт разделяли на фракции с помощью препаративной газовой хроматографии на колонке (91,5 ´ 0,9375 см) с 8%-ным SE 30 на хромосорбе G с запрограммированной температурой от 80 до 200°С (скорость тока 45 мл/мин). Активная фракция (0,5 г из 2,5 кг буровой муки) выходила через 14-23 мин между 2 другими пиками, которые были идентифицированы как нонанал- и геранилацетаты. При дальнейшей хроматографии на полярной колонке (8%-ный карбовакс 20М) на хромосорбе G при 120°С получили 14 мг вещества, активного в концентрации 5·10-5 г. Вещество было выделено в виде частично разделившихся минорных пиков. Три компонента, обусловивших совместно привлекающую активность, были идентифицированы сочетанием методом ИК-, масс- и ЯМР-спектроскопии как (-)-метил-6-метилен-7-октен-4-ол (38), циc-вербенол (39) и (+)-2-метил-6-метилен-2,7-октадиен-4-ол (40) (рис. 5). Методы выделения и идентификации этих соединений изложены в обзоре Сильверстайна и др.

Рис. 5. Выделенные феромоны Ips confusus
В 1966 г. с помощью газовой хроматографии Питман и др. выделили из задней кишки, мальпигиевых сосудов и экскрементов самцов, питавшихся в течение двух дней в небольших бревнах желтой сосны, неидентифицированную фракцию, которая вызывала ответную реакцию у ползающих жуков. Хотя авторы полагали, что выделяемый ими материал содержал лишь единственный феромон, в действительности это была смесь веществ (Джекобсон, 1976).
Вите считает, что по привлечению жуков к приманке нельзя судить об активности препарата на разных стадиях его выделения, как это делали Вуд и др. Однако последние показали, что хемоклинотаксис жуков в лабораторном аль-фактометре вполне равнозначен реакции полета насекомых на половой феромон.
Простой полевой метод, в котором струю воздуха пропускали через контейнеры, содержащие куски древесины, зараженной короедом Ips confusus, показал, что к аттрактанту чувствительны особи обоего пола. Широкие алюминиевые цилиндры укрепляли вертикально и горизонтально, и в них помещали зараженные, заведомо аттрактивные куски древесины. Воздух продували с помощью вентилятора над зараженными поленьями и направляли его либо на бревно или дерево, чтобы вызвать нападение на них вредителей, либо на дощечку или стекло для сбора привлеченных насекомых. Модификацию этого метода использовали для получения большого количества аттрактивного материала. Насекомых ловили во вращающиеся сетчатые или чашевидные ловушки, в которые помещали аттрактант. Такая вращающаяся сетчатая ловушка с аттрактантом I. confusus выловила через 7,5 ч 39 I. confusus, 35 I. latidens+I. guildi, 10 Dendroctonus valens, 72 других видов жука-короеда и 25 хищников жуков-короедов.
Как показали полевые испытания, привлечение насекомых в природе подчинено определенному суточному ритму с максимумами от 8 до 10 ч утра и с 2 до 6 ч вечера. Жуки предпочитали места, защищенные от ветра; что же касается освещения, то оно в меньшей степени влияло на ответную реакцию, хотя прямого солнечного света насекомые избегали. С подветренной стороны ответная реакция жуков проявлялась по ольфакторному градиенту. При освоении нового лесного массива колония насекомых может перемещаться под влиянием аттрактанта на расстояния порядка 500 - 1000 м.
Три соединения, входящие в состав феромона, были испытаны в безлесных кустарниковых зонах в 1 км от природной зараженной сосновой (Pinus ponderosa) вырубки в Калифорнии. В этой зоне преобладали ветры, направленные из долины к месту заражения. Использовали ловушки цилиндрической формы из жесткой ткани, покрытой клеем, которые были установлены на палках высотой 1,5 м. Воздух (50 см3/мин) пропускали через сосуд, содержащий аттрактант, и затем через ловушку. Как смесь 1,5 мг соединения (38) с 1 мг соединения (39) и с 0,5 мг соединения (40), так и кусок древесины, зараженный 20 самцами, сильно привлекали жуков. Экстракт из 2 г буровой муки самцов привлекал жуков в меньшей степени. Растворы этих трех соединений в гексане или гептане, нанесенные на ватные или бумажные тампоны, вызывали значительно более слабую ответную реакцию. Самцы и самки 2 хищников Enoclerus lecontei и Temnochila virescens var. chlorodia, а также Tomicobia tibialis, паразитирующие на Ips, реагировали на синтетический аттрактант. Бедард и Браун описали портативную переносную систему с испарителем и ловушкой для оценки в природе эффективности химических аттрактантов насекомых, особенно для I. confusus.
Райе испытал в полевых ольфактометрах и клейких ловушках (Tanglefoot) большое количество монотерпенов, обнаруженных в растении-хозяине, пораженном I. confusus. α-Пинен и β-пинен были высокоаттрактивными для хищников (Е. lecontei и Т. virescens var. chlorodia); 3-карен, мирцен и лимонен были менее аттрактивны. Гептан был очень аттрактивен для Temnochila virescens, но не для Е. lecontei.
Описание феромонной ловушки
Феромонные ловушки предназначены для мониторинга короеда стенографа и борьбы с ним методом массового отлова. В основе ловушки усечённая воронка диаметром 16-30 см. с прилепленным к ней сборником для жуков. Сборник снабжён отверстиями для отвода дождевой воды. Над воронкой установлен крестообразный барьер высотой в 1,5 - 1,8 раза превышающий ширину воронки (см. рис. 6).
Комплектация одной ловушки:
. Верхняя часть ловушки - два согнутых по длине прямоугольника из пластика, скрепленные вверху веревкой для подвешивания ловушки, а внизу - скрепкой для подвешивания диспенсера - 1 шт.
. Воронка - 1 шт.
. Короткая Г-образная проволока - 1 шт.
. Стакан - сборник жуков - 1 шт.
. Скрепки для прикрепления воронки к верхней части ловушки - 4 шт.
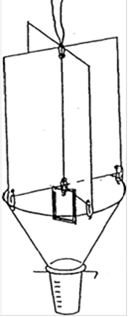
Рис. 6. Феромонная ловушка.
Внутри ловушки крепиться диспансер, представляющий собой препаративную форму синтетического агрегационного феромона короеда.
Диспенсер с феромоном подвешивается на скрепку, соединяющую внизу верхнюю часть ловушки и, таким образом, он находится ниже верхнего края воронки. Готовую ловушку (с раскрытым и прикрепленным к ней диспенсером) подвешивают с помощью веревки в нужное место.
Инструкция по применению феромонного диспенсера для короеда-стенографа. Диспенсер раскрывается только перед помещением в ловушку или на ловчее дерево.
Диспенсеры легко отрываются от общей ленты. В верхней части диспенсера (там, где находится отверстие для закрепления его в ловушке), пленка запаяна не до конца. Чтобы раскрыть диспенсер, необходимо потянуть за его недопаянные части в разные стороны (см. рис. 7).
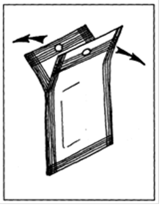
Рис. 7. Феромонный диспенсер для короеда стенографа.
При этом диспенсер раскрывается пополам, и в ловушку вывешивается только та половина (рабочая), в которую запаян картонный прямоугольник (!) и на которой написано "Вертенол". Эта рабочая половина диспенсера прикрепляется к нижнему перекрестью ловушки с помощью скрепки.
Результаты исследования
Испытания феромонной ловушки на протяжении времени показало, что количество насекомых, попавшихся в эти ловушки довольно большое (см. таблицу 2). При этом помимо вредителей леса присутствует некоторое количество насекомых, попавших в эти ловушки случайно (боярышница, коровка, шмель и др.). Возможно, часть из них была привлечена погибшими насекомыми и скопившейся в ловушках дождевой водой.
Таблица 2. Количество насекомых, попавших в ловушку
| № учета
| Виды насекомых
| Общее количество
| Среднее число на 1 ловушку
|
| 1выезд
| боярышница (Aporia crataedi)
| 7
| 0,116
|
|
| муравей (Formica polyctena Foerst.)
| 17
| 0,283
|
|
| толстоголовая оса большая (Crabro cribrarius)
| 3
| 0,05
|
|
| могильщик погребальный (Necrophorus verpillo)
| 8
| 0,133
|
|
| рагий-сыщик (Rhagium unduisitor)
| 11
| 0,183
|
|
| щелкун (Slateridae)
| 13
| 0,216
|
|
| клоп итальянский (Graphosoma lineatum)
| 6
| 0,1
|
|
| щитоноска (Coccus hesperidum L.)
| 1
| 0,016
|
|
| щелкун красноногий (Melanotus rufipes)
| 10
| 0,166
|
|
| щелкун блестящий (Selatosomis aeneus)
| 4
| 0,066
|
|
| шмель лесной (Botbus silvasum)
| 6
| 0,1
|
|
| грибоед красноголовый (Tripeax rissica)
| 11
| 0,183
|
|
| долгоносик полосатый (Sitona eineatus)
| 2
| 0,033
|
|
| коровка (Сoccineceidae)
| 1
| 0,016
|
|
| синий рогохвост (Paururus juvencus)
| 11
| 0,183
|
|
| черный сосновый усач (Monochamus galloprovincialis oliv)
| 2
| 0,033
|
|
| сосновая тля (Lachnus pineus Mordk),
| 12
| 0,2
|
|
| щитник двузубчатый (Picromesus bidens),
| 1
| 0,016
|
|
| сибирский гравёр (Melolonthe hippocasteni Fabr)
| 2
| 0,033
|
|
| смолевка сосновая (Pissodes pini)
| 2
| 0,033
|
|
| короед стенограф (Ips sexdentatus)
| 1
| 0,016
|
| 2выезд
| боярышница (Aporia crataedi)
| 9
| 0,115
|
|
| муравей (Formica polyctena Foerst.)
| 6
| 0,1
|
|
| толстоголовая оса большая (Crabro cribrarius)
| 2
| 0,033
|
|
| могильщик погребальный (Necrophorus verpillo)
| 8
| 0,133
|
|
| рагий-сыщик (Rhagium unduisitor)
| 6
| 0,1
|
|
| щелкун (Slateridae)
| 4
| 0,066
|
|
| щелкун красноногий (Melanotus rufipes)
| 8
| 0,133
|
|
| щелкун блестящий (Selatosomis aeneus)
| 3
| 0,05
|
|
| грибоед красноголовый (Tripeax rissica)
| 8
| 0,133
|
|
| долгоносик полосатый (Sitona eineatus)
| 2
| 0,033
|
|
| синий рогохвост (Paururus juvencus)
| 5
| 0,083
|
|
| черный сосновый усач (Monochamus galloprovincialis oliv)
| 2
| 0,033
|
|
| сосновая тля (Lachnus pineus Mordk),
| 14
| 0,23
|
|
| сибирский гравёр (Melolonthe hippocasteni Fabr)
| 5
| 0,083
|
|
| комлевый бурый усач (Criocephelus rusticus L)
| 3
| 0,05
|
|
| большой сосновый долгоносик (Hylobis abietis).
| 8
| 0,133
|
|
| щитник черношипный (Carpocoris fuscispinus)
| 1
| 0,016
|
|
| большой хвойный рогохвост (uroceras gigas)
| 1
| 0,016
|
| 3выезд
| боярышница (Aporia crataedi)
| 1
| 0,033
|
|
| могильщик погребальный (Necrophorus verpillo)
| 3
| 0,1
|
|
| рагий-сыщик (Rhagium unduisitor)
| 6
| 0,203
|
|
| щелкун (Slateridae)
| 4
| 0,133
|
|
| щелкун красноногий (Melanotus rufipes)
| 5
| 0,166
|
|
| щелкун блестящий (Selatosomis aeneus)
| 1
| 0,033
|
|
| грибоед красноголовый (Tripeax rissica)
| 1
| 0,033
|
|
| долгоносик полосатый (Sitona eineatus)
| 2
| 0,066
|
|
| синий рогохвост (Paururus juvencus)
| 4
| 0,133
|
|
| черный сосновый усач (Monochamus galloprovincialis oliv)
| 2
| 0,066
|
|
| сосновая тля (Lachnus pineus Mordk),
| 3
| 0,1
|
|
| бронзовка золотистая (Agrilus viridis)
| 26
| 0,866
|
|
| усач-инквизитор (Rhagium inquisitor)
| 1
| 0,033
|
|
| черный длинноусый усач (Acenthocinus aedilis L).
| 2
| 0,066
|
| 4выезд
| усач-инквизитор (Rhagium inquisitor)
| 4
| 0,133
|
|
| муравей (Formica polyctena Foerst.)
| 1
| 0,033
|
|
| толстоголовая оса большая (Crabro cribrarius)
| 3
| 0,1
|
|
| могильщик погребальный (Necrophorus verpillo)
| 5
| 0,167
|
|
| рагий-сыщик (Rhagium unduisitor)
| 2
| 0,066
|
|
| щелкун (Slateridae)
| 2
| 0,066
|
|
| щелкун красноногий (Melanotus rufipes)
| 2
| 0,066
|
|
| щелкун блестящий (Selatosomis aeneus)
| 1
| 0,033
|
|
| грибоед красноголовый (Tripeax rissica)
| 4
| 0,133
|
|
| долгоносик полосатый (Sitona eineatus)
| 1
| 0,033
|
|
| синий рогохвост (Paururus juvencus)
| 5
| 0,167
|
|
| черный сосновый усач (Monochamus galloprovincialis oliv)
| 2
| 0,066
|
|
| сосновая тля (Lachnus pineus Mordk),
| 8
| 0,266
|
|
| сибирский гравёр (Melolonthe hippocasteni Fabr)
| 3
| 0,1
|
|
| большой сосновый долгоносик (Hylobis abietis).
| 2
| 0,066
|
|
| щитник черношипный (Carpocoris fuscispinus)
| 1
| 0,033
|
|
| большой хвойный рогохвост (uroceras gigas)
| 1
| 0,033
|
| 5выезд
| усач-инквизитор (Rhagium inquisitor)
| 2
| 0,066
|
|
| боярышница (Aporia crataedi)
| 1
| 0,033
|
|
| толстоголовая оса большая (Crabro cribrarius)
| 1
| 0,033
|
|
| щелкун (Slateridae)
| 7
| 0,233
|
|
| щелкун красноногий (Melanotus rufipes)
| 2
| 0,066
|
|
| щелкун блестящий (Selatosomis aeneus)
| 3
| 0,01
|
|
| грибоед красноголовый (Tripeax rissica)
| 3
| 0,01
|
|
| долгоносик полосатый (Sitona eineatus)
| 2
| 0,066
|
|
| синий рогохвост (Paururus juvencus)
| 6
| 0,2
|
|
| черный сосновый усач (Monochamus galloprovincialis oliv)
| 2
| 0,066
|
|
| сосновая тля (Lachnus pineus Mordk),
| 7
| 0,233
|
|
| сибирский гравёр (Melolonthe hippocasteni Fabr)
| 1
| 0,033
|
|
| комлевый бурый усач (Criocephelus rusticus L)
| 2
| 0,066
|
|
| большой сосновый долгоносик (Hylobis abietis).
| 2
| 0,066
|
|
| щитник черношипный (Carpocoris fuscispinus)
| 1
| 0,033
|
|
| смолевка сосновая (Pissodes pini)
| 2
| 0,066
|
|
| щитник черношипный (Carpocoris fuscispinus)
| 2
| 0,066
|

Рис. 8. Соотношение жуков и других насекомых в разные выезды
Хотя количество короедов оказалось незначительным, в целом жуки являются преобладающей группой на протяжении всего времени учета (Рис. 8).
Из гистограммы (Рис. 8) видно, что во все дни нашего выезда количество жуков, попавших в ловушку, всегда превышало количество других насекомых (муравьев, шмелей, ос, бабочек). При этом только в третий учет это соотношение почти сравнялось, но зато во второй учет количество жуков в два раза превысило количество попавших других насекомых, в четвертый выезд - в 2,5 раза, а в пятый выезд более чем в три раза.
Все это подтверждает, что данный феромонный препарат является эффективным для борьбы с жуками вредителями. Несмотря на то, что в установленные ловушки попал всего один короед-стенограф, в них попадали другие жуки-вредители. Так, из таблицы 1 видно, что очень большое количество в ловушки попало таких жуков-вредителей как рагий-сыщик (Rhagium unduisitor), могильщик погребальный (Necrophorus verpillo), щелкун красноногий (Melanotus rufipes), грибоед красноголовый (Tripeax rissica).
В ловушку также попало большое количество бронзовок золотистых и сибирской сосновой тли.
Все это говорит о том, что данный препарат может быть использован не для борьбы с короедом стенографом, а с другими видами жуков стволовых вредителей.
Причин, почему в ловушки не попали именно короеды стенографы может быть множество. Это может быть связанно и с климатическими отличиями между Подмосковным и Сибирским регионом, и с особенностью погоды во время прохождения практики (Большую часть практики стояла дождливая погода, что могло повлиять на результаты исследования). Так климат Подмосковья является менее влажным, чем сибирский. Другой причиной может являться нарушение технологии получения феромона.
Заключение
Феромоны - это биологически активные вещества, выделяемые насекомыми в окружающую среду для коммуникации между особями своего вида и вызывающие их поведенческие или физиологические реакции. Половые и агрегационные феромоны широко применяются в странах с развитым сельским и лесным хозяйством в интегрированной системе защиты растений как основное средство мониторинга насекомых-вредителей. На сегодняшний день это наиболее рентабельный путь обнаружения и оценки численности вредителей по сравнению с другими известными методами.
Существует два способа использования феромонов как средства борьбы с вредителями: метод массового отлова насекомых в ловушки, снабженные диспенсером, испускающим феромон, и метод дезориентации (распыление феромона и как следствие - невозможность найти партнера для спаривания).
Преимущества феромонных препаратов для борьбы с вредителями заключаются:
во-первых, в их специфичности, так как феромон действует только на определенный вид вредителя, а значит, такой препарат безвреден для нецелевой фауны;
во-вторых, в природном происхождении действующих веществ и их малых количествах, необходимых для применения (от десятка мкг до 1-2 мг на ловушку), что делает этот способ борьбы безвредным для окружающей среды;
в-третьих, из-за малых количеств феромонов для применения возможен синтез веществ на лабораторных установках, что также уменьшает нагрузку на окружающую среду.
Нами было проведено исследование по использованию разработанного в Томске феромонного препарата «Деналол» для борьбы с короедом-типографом. Феромонные ловушки использовались в качестве опыта, впервые в условиях Томской области.
Выводы
Проведенные исследования показали:
. Эффективность данных феромонных ловушек очень мала.
. Это связано либо с недоработкой феромона, либо с тем, что погодные условия Томской и Московской области различны. За все время эксперимента в наши ловушки попал всего один короед. Зато в установленные ловушки попадали другие насекомые. Так, в третий выезд, в 23 ловушку попало 26 бронзовок золотистых (Agrilus viridis), что трудно назвать простым совпадением. Кроме этого в установленные ловушки в каждый наш выезд попадали различные виды щелкунов и боярышниц. Так, особо большое количество было рагий-сыщиков (Rhagium unduisitor) и могильщиков погребальных (Necrophorus verpillo).
. В ловушки попадали не только вредные насекомые, но и полезные (муравьи, шмели, осы и др.). Возможно, что это попадание было случайным.
. Данный препарат не эффективен как средство борьбы с короедом-стенографом, но, при определенных доработках он может быть использован для борьбы с другими видами лесных вредителей.
Список использованной литературы
.Барбье М. Введение в биохимическую экологию. - М.: Мир, 1978. - 229 с.
.Бей-Биенко Г.Я. Общая энтомология. - М.: Высшая школа, 1971. - 327 с.
.Биологическая борьба с вредными насекомыми и сорняками: Пер. с англ. / Под ред. Б.И. Рукавишникова. - М.: Наука, 1968. - 261 с.
.Биологические средства защиты растений: Сб. ст. / Под ред. Е.М. Шумакова и др. - М.: Наука, 1974. - 174 с.
.Бондаренко Н.В. Биологическая защита растении. - Л.: Колос. Ленингр. отд-ние, 1978. - 203 с.
.Бугаев В.А. Основы лесоустройства. - Воронеж: Изд-во Воронеж. ун-та, 1982. - 232 с.
.Буда В.Г., Скиркявичус А.В. Основы феромонной коммуникации у насекомых // Хеморецепция насекомых. - 1982. - № 7. - С. 24 - 36.
.Булеза В.В., Сафонкин А.Р., Мыттус Э.Р. и др. Половые аттрактанты листоверток-вредителей сада // Химическая коммуникация животных. - М.: Наука, 1986. - С. 57 - 65.
.Вайткявичене Г.Б., Скиркявичус А.В. Феромон пчелиной матки и морфологические аспекты его восприятия рабочими пчелами и трутнями Apes mellifera L. // Хеморецепция насекомых. - 1987. - № 9. - С. 30 - 47.
.Введение в проблемы биохимической экологии: Биотехнология, сельское хозяйство, охрана среды / М.М. Телитченко, С.А. Остроумов. - М.: Наука, 1990. - 228 с.
.Ведерников Н.Е., Яковлев В.Г. Защита хвойных сеянцев от болезней. - М.: Лесная промышленность, 1972. - 89 с.
.Воробьева Л.И. Техническая микробиология. - М.: Изд-во МГУ, 1987. - 168 с.
.Воронкова В.В. Методы выделения феромонов чешуекрылых // Агрохимия. - 1987. - № 4. - С. 124 - 132.
.Воронкова В.В., Щербакова Г.Д., Бочарова Н.И. и др. О выделении и идентификации феромона озимой совки Agrotis segetim // Химическая коммуникация животных. - М.: Наука, 1986. - С. 37 - 43.
.Воронцов А.И. Лесная энтомология. - М.: Лесная промышленность, 1975. - 250 с.
.Воронцов А.И. Патология леса. - М.: Лесная промышленность, 1978. - 272 с.
.Вредители сельскохозяйственных культур и лесных насаждений: В 3 т. / Под ред. В.П. Васильева. - Киев: Урожай, 1975.
.Горожанкина С.М., Константинов В.Д. География тайги Западной Сибири. - Новосибирск: Наука. Сиб. отд-ние, 1979. - 188 с.
.Гричанов И.Я. Нарушение химической коммуникации бабочек хлопковой совки (Heliothis armigera hubner) компонентами полового феромона самок и антиферомонами // Химическая коммуникация животных. - М.: Наука, 1986. - С. 73 - 79.
.Гулий В.В., Голосова М.А. Вирусы в защите леса от вредных насекомых. - М., Лесная промышленность, 1975. - 167 с.
.Джекобсон М. Половые феромоны насекомых: Пер. с англ. - М.: Мир, 1976. - 391 с.
.Егоров Н.С., Олескин А.В., Самуилов В.Д. Биотехнология: проблемы и перспективы. - М.: Высшая школа, 1987. - 159 с.
.Емельянов В.А., Мыттус Э.Р. Половые феромоны насекомых. - Елгава: Латв. сельскохозяйственная академия, 1987. - 37 с.
.Журавлев И.И., Крангауз Р.А., Яковлев В.Г. Болезни лесных деревьев и кустарников. - М.: Лесная промышленность, 1974. - 157 с.
.Зинкевич Э.П. Природа феромонов // Человек и природа. - 1984. - № 7. - С. 3 - 9.
.Ильинский А.И. Определитель вредителей леса. - М.: Сельхозиздат, 1962. - 392 с.
.Ильичев А.Л. Роль отдельных компонентов в многокомпонентной феромонной системе чешуекрылых // Биологические науки. - 1988. - № 10. - С. 5 - 15.
.Исмаилов В.Я., Олещенко И.Н., Орлов В.Н., Алексеенко А.В. Новый подход к регулированию численности насекомых с помощью синтетических половых феромонов // Химическая коммуникация животных. - М.: Наука, 1986. - С. 109 - 111.
.Кедровые леса Сибири / И.В. Семечкин, Н.П. Поликарпов, А.И. Ирошников и др. - Новосибирск: Наука, 1985. - 256 с.
.Киршенблат Я.Д. Телергоны - химические средства взаимодействия животных. - М.: Наука, 1974. - 107 с.
.Киршенблат Я.Д. Телергоны и их биологическое значение // Успехи современной биологии. - 1958. - Т. 46. - С. 316 - 326.
.Крушев Л.Т. Биологические методы защиты леса от вредителей. - М.: Лесная промышленность, 1973. - 192 с.
.Лебедева К.В., Мельников Н.Н. Последние достижения в области применения и исследования феромонов чешуекрылых // Агрохимия. - 1987. - № 3. - С. 127 - 136.
.Лебедева К.В., Миняйло В.А., Пятнова Ю.Б. Феромоны насекомых. - М.: Наука, 1984. - 268 с.
.Маслов А.Д., Кутеев Ф.С., Прибылова М.В. Стволовые вредители леса. - М.: Лесная промышленность, 1973. - 144 с.
.Микроорганизмы в борьбе с вредными насекомыми и клещами: Пер. с англ. / Под ред. М.С. Гилярова. М.: Сельхозиздат, 1976. - 304 с.
.Мыттус Э.Р., Гранат Д.А. Применение феромонов для защиты растений. - Таллинн: Эст. НИИНТИ, 1983. - 30 с.
.Надзор, учет и прогноз массовых размножений хвое- и листогрызущих насекомых в лесах СССР / Под ред. А.И. Ильинского и И.В. Тропина. - М.: Лесная промышленность, 1965. - 526 с.
.Наставление по авиационно-хи<












