Термодинамика изучает взаимосвязь между тепловой, механической и химической энергией и законы, управляющие взаимными превращениями этих видов энергии в процессах, протекающих в природе.
С помощью термодинамического анализа определяют, осуществим ли изучаемый процесс, не возникают ли противодействия его протеканию и до какой степени он может пройти. Однако термодинамика не рассматривает ни механизма, ни скорости изучаемого процесса. Под термодинамической системой понимают совокупность веществ (твердых, жидких, газообразных), выбранных для изучения и физически или мысленно обособлены от окружающей среды, между которыми происходит либо обмен энергией, либо массой, либо и то, и другое вместе.
Если в термодинамической системе не происходит никаких процессов и если действие термодинамической системы на окружающую среду равно действию окружающей среды на систему, то данная система находится в термодинамическом равновесии - ее состояние во времени не изменяется. Равновесие, однако, может относиться лишь к некоторым свойствам термодинамической системы. В таком случае говорят не о термодинамическом равновесий, а, например, о механическом равновесии - в системе не происходит перемещения вещества (диффузия, растворение и т.п.), о химическом равновесии - в системе не протекают химические реакции, о тепловом равновесии - в системе не происходит теплообмен и т.д. Термодинамическое равновесие, таким образом, объединяет все виды равновесия.(механическое, тепловое, химическое, электрическое и т.д.).
Термодинамическим процессом называют любое изменение в системе, связанное с изменением хотя бы одной термодинамической величины. Термодинамический процесс может быть обратимым или необратимым.
Обратимые и необратимые процессы, протекающие при постоянной температуре, называются изотермическими; при постоянном давлении - изобарическими; при постоянном объеме - изохорическими и при постоянном теплосодержании - адиабатическими. Первый, закон термодинамики. Все вещества обладают определенным запасом внутренней энергии II, под которой подразумевается общий ее запас, включая энергию поступательного и вращательного движений, энергию внутримолекулярных колебаний атомов и атомных групп, энергию движения электронов в атомах, внутриядерную энергию, т.е. все виды энергии, кроме кинетической и потенциальной энергии системы.
Внутренняя энергия определяется начальным и конечным состоянием системы и не зависит от пути перехода, измеряется в джоулях (калориях) и обычно относится к одному молю вещества.
Если в первоначальном состоянии внутренняя энергия вещества (или система) была U 1, а в конечном U 2, то величина 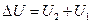 характеризует изменение внутренней энергии.
характеризует изменение внутренней энергии.
Первый закон термодинамики представляет частный случай выражения универсального закона сохранения энергии применительно к процессам, происходящим с выделением или поглощением тепла. Его формулировка: количество теплоты (q), полученное системой, равно увеличению ее внутренней энергии (U) и произведенной ею работы (А):
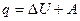
Внутренняя энергия является функцией состояния и однозначно определяется параметрами состояния системы:
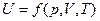
где р - давление; V - объем; Т -температура,
Выражение упрощается для процессов, в ходе которых остается неизменным один из параметров состояния системы:
в изотермическом процессе, где 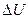 =0 (для идеального газа)
=0 (для идеального газа) 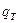 =А и, следовательно, вся работа выполняется за счет подведенной теплоты;
=А и, следовательно, вся работа выполняется за счет подведенной теплоты;
в изохорическом процессе, где работа не выполняется из-за неизменного объема системы, 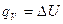 т.е. теплота расходуется только на приращение внутренней энергии системы;
т.е. теплота расходуется только на приращение внутренней энергии системы;
в изобарическом процессе, где А = 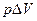 :
:
Энтальпия является термодинамической функцией состояния системы. Обозначается буквой Н и имеет смысл, аналогичный внутренней энергии U. Понятие энтальпии было введено для упрощения изучения изобарических процессов. Ее определяют из выражения
Н = U + р V.
Второй закон термодинамики. Теплота не может самопроизвольно переходить от тела с более низкой температурой к телу с более высокой температурой:
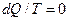
Это уравнение справедливо для любого замкнутого процесса.
Энтропия. Для характеристики степени, необратимости энергетических переходов при различных физических и химических процессах применяется величина, называемая энтропией, которая и является мерой обесцененной энергии:
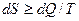
где 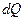 - элементарное количество теплоты, поглощенное или выделенное в ходе процесса. Знак > отвечает необратимым процессам, знак = соответствует обратимым процессам.
- элементарное количество теплоты, поглощенное или выделенное в ходе процесса. Знак > отвечает необратимым процессам, знак = соответствует обратимым процессам.
Энтропия имеет ту же единицу измерения, что и теплоемкость (Дж/моль • К). Это не говорит об аналогии их физического значения. Теплоемкость характеризует количество теплоты, необходимое для нагревания массы вещества На 1 К. Энтропия характеризует количество рассеянной энергии, отнесенное к 1 К данной температуры.
Свободная энергия. Свободная энтальпия. Энтропия служит критерием для оценки равновесного состояния только таких термодинамических систем, которые изолированы от окружающей среды. Однако обеспечить полное отсутствие теплового контакта между системой и окружающей средой очень трудно и в практике это встречается редко. Поэтому для определения вероятности и условий равновесия физико-химических реакций введены другие термодинамические функции, а именно: свободная энергия F (функция Гельм-гольца) и свободная энтальпия G (функция Гиббса).
Свободную энергию системы определяют по уравнению
F = U - TS
где F - внутренняя энергия системы; S - энтропия системы; Т - температура системы.
Свободная энергия применяется для определения равновесия термодинамической системы в процессах, протекающих при постоянных температуре и объеме, поэтому
иногда ее называют изохорно-изотермическим потенциалом системы.
Однако для большинства металлургических реакций свободная энергия не является наиболее удобной термодинамической функцией состояния, с помощью которой можно определить возможность самопроизвольного развития процесса, так как эти реакции в большинстве случаев протекают при условиях, характеризующихся постоянными температурой и давлением. Поэтому равновесие металлургических реакций наилучшим образом характеризует иная термодинамическая функция - свободная энтальпия G (или изобарно-изотермический потенциал), значение которой соответствует энтальпии (общей энергии) термодинамической системы, уменьшенной на-связанную энергию:
G = Н-ТS
Изменение свободной энтальпии химической реакции при произвольной температуре Т рассчитывают по уравнению
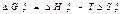
Для расчета изменения свободной энтальпии металлургических реакций, которые всегда протекают при высоких температурах, используют приближенные методы.
Химическое сродство. Химическое сродство элементов является причиной образования из них соединений. В изобарио-изохорических процессах сродство определяется по величине изменения свободной энергии, в избарино-изотермических - по изменению свободной энтальпии, при наличии химическою сродства соответственно:
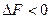 и
и 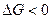
Очевидно, что чем больше сродство веществ реакции, тем большей убылью свободной, энергии или свободной энтальпий она сопровождается. Чтобы можно было сравнивать сродство различных веществ, участвующих в однотипных реакциях (например, окисления, образования нитридов и т.д.), значения 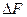 или
или 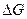 рассчитывают на одинаковое количество одного вещества реакции.
рассчитывают на одинаковое количество одного вещества реакции.
Третий закон термодинамики. Третий закон термодинамики, в отличие от обоих предыдущих, менее общий и касается, прежде всего, поведения веществ, при температурах, близких к абсолютному нулю. Он позволяет установить абсолютное значение энтропии, чего не позволяет ни первый, пи второй законы. Третий закон термодинамики иногда формулируют следующим образом: температура абсолютного нуля не может быть достигнута при конечном числе циклов. Отсюда третье начало трактуется как принцип недостижимости абсолютного нуля.Другая формулировка третьего начала - энтропия чистых веществ, существующих в виде идеальных кристаллов, при температуре абсолютного нуля равна нулю, положена в основу расчетов абсолютных значений энтропии различных; веществ.



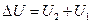 характеризует изменение внутренней энергии.
характеризует изменение внутренней энергии.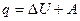
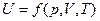
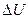 =0 (для идеального газа)
=0 (для идеального газа) 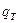 =А и, следовательно, вся работа выполняется за счет подведенной теплоты;
=А и, следовательно, вся работа выполняется за счет подведенной теплоты;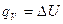 т.е. теплота расходуется только на приращение внутренней энергии системы;
т.е. теплота расходуется только на приращение внутренней энергии системы;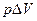 :
: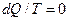
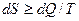
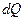 - элементарное количество теплоты, поглощенное или выделенное в ходе процесса. Знак > отвечает необратимым процессам, знак = соответствует обратимым процессам.
- элементарное количество теплоты, поглощенное или выделенное в ходе процесса. Знак > отвечает необратимым процессам, знак = соответствует обратимым процессам.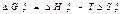
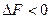 и
и 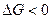
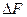 или
или 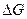 рассчитывают на одинаковое количество одного вещества реакции.
рассчитывают на одинаковое количество одного вещества реакции.


